| |
| Med Sci (Paris). 2009 May; 25(5): 483–488. Published online 2009 May 15. doi: 10.1051/medsci/2009255483.Régulation du transport vésiculaire par la courbure membranaire Guillaume Drin,* Joëlle Bigay, and Bruno Antonny* Université de Nice Sophia Antipolis et CNRS, Institut de Pharmacologie moléculaire et cellulaire, UMR 6097, 660, route des Lucioles, 06560 Valbonne, France |
La cellule eucaryote est le siège d’un trafic permanent. Notamment, des vésicules de transport acheminent des protéines entre la surface cellulaire et les compartiments subcellulaires délimités par une membrane : appareil de Golgi, réticulum endoplasmique (RE), endosomes… Les protéines synthétisées dans le RE atteignent l’appareil de Golgi, empilements de citernes membranaires, pour y subir différentes modifications avant de rejoindre la surface cellulaire. Ces protéines sont intégrées spécifiquement dans des vésicules COPII (coat protein complex II) émergeant d’un site d’export du RE en même temps que des protéines plus spécialisées permettant aux vésicules, une fois formées, de cibler le compartiment pré-golgien et de fusionner avec lui. Les protéines « passagères » délivrées dans ce compartiment transitent alors vers l’appareil de Golgi au gré d’un phénomène dit de maturation des citernes [
1], selon un modèle généralement accepté. Dans ce modèle, l’empilement golgien serait en perpétuel renouvellement : la première citerne devient la deuxième alors que le compartiment pré-golgien se transforme en première citerne, etc… Via ce flux, les protéines transitent de la face cis à la face trans de l’appareil de Golgi. En dépit de ce flux incessant, l’appareil de Golgi possède une architecture constante où chaque citerne conserve une composition précise en protéines dites résidentes (enzymes de modification). Cela signifie que ces protéines doivent résister à l’avancée des citernes et doivent constamment rebrousser chemin. Par ailleurs, les protéines ayant servi au ciblage et à la fusion des vésicules COPII doivent retourner dans le RE pour intégrer de nouvelles vésicules COPII. C’est ici qu’interviennent diverses vésicules de type COPI qui assurent le recyclage « rétrograde » de protéines d’une citerne tardive vers une citerne plus précoce et du cis-Golgi vers le RE [
2]. Les protéines « passagères » correctement maturées ayant atteint le trans-Golgi seront acheminées par d’autres systèmes tubulovésiculaires de transport vers la membrane plasmique, les endosomes ou lysosomes (Figure 1).
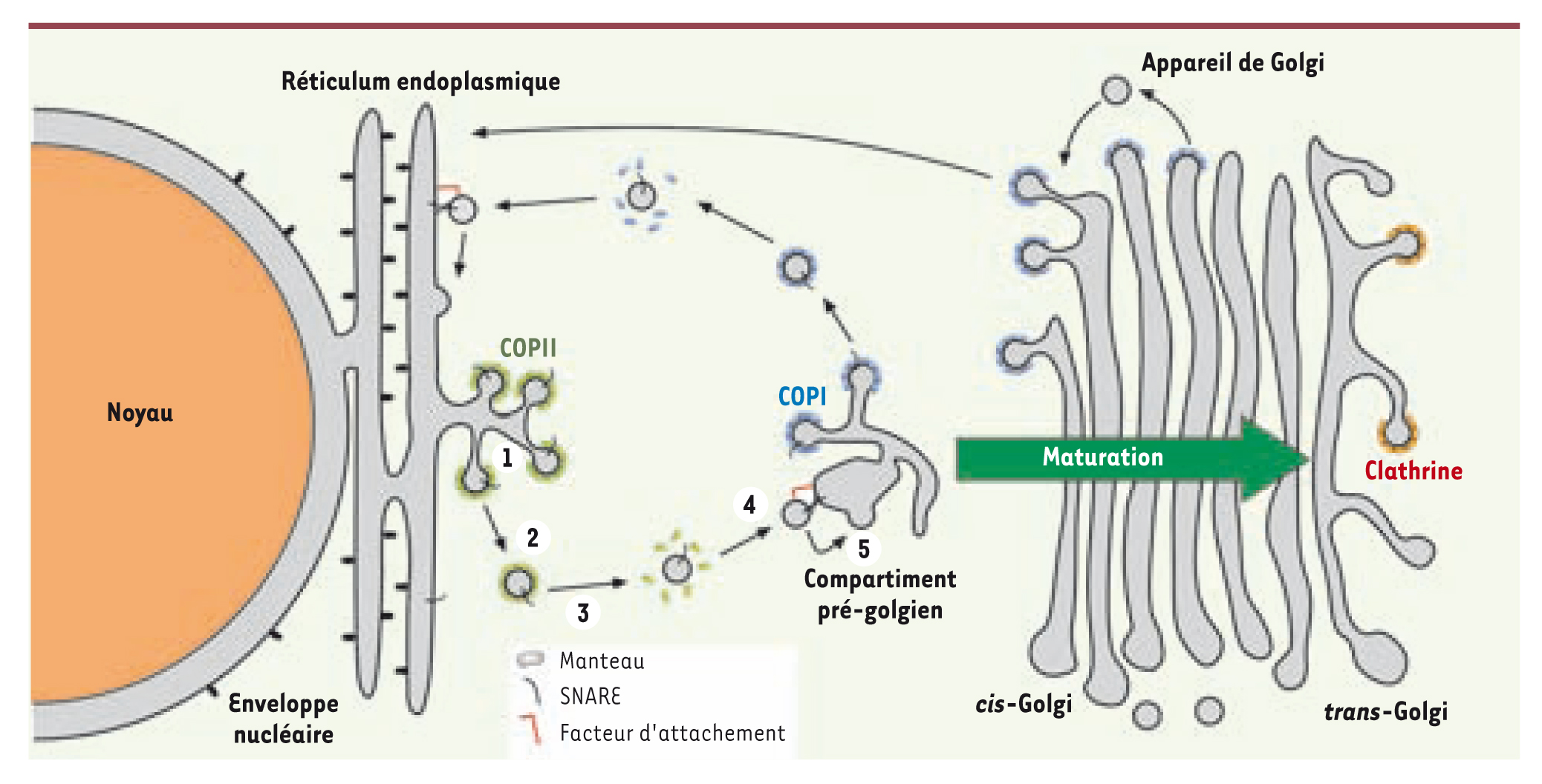
 | Figure 1.
Transport vésiculaire au niveau de l’appareil de Golgi et du réticulum endoplasmique. Le transport vésiculaire implique le bourgeonnement d’une membrane en vésicule sous l’action d’un manteau protéique (1), son détachement par fission (2), la dépolymérisation du manteau (3), l’attachement et le ciblage de cette vésicule (4) et sa fusion (5) avec son compartiment cible. Les protéines passagères ne sont pas représentées par souci de clarté. Les SNARE sont des protéines responsables du processus de fusion membranaire (adapté de [
3]). |
Les vésicules, d’un diamètre de 50-70 nm, sont générées à partir de la membrane d’un compartiment par l’action spécifique d’un manteau protéique : manteau COPI, COPII ou à clathrine [3]. Les protéines qui constituent ces manteaux peuvent recruter des protéines à transporter et, en polymérisant, déformer localement la membrane en un bourgeon. Ce bourgeon évolue jusqu’à se détacher du compartiment et donner une vésicule. Celle-ci, débarrassée de son manteau, s’attache alors à son compartiment cible, fusionne avec celui-ci et délivre sa cargaison [
4]. Actuellement, des études sont menées pour disséquer les mécanismes moléculaires responsables de chacune de ces étapes, en particulier pour comprendre comment les protéines du manteau engendrent ou reconnaissent des déformations de la membrane. Attardons-nous sur les vésicules COPII pour lesquelles de récents travaux permettent de proposer comment des protéines d’un manteau collaborent pour embarquer une cargaison et induire le bourgeonnement de la membrane [
5]. |
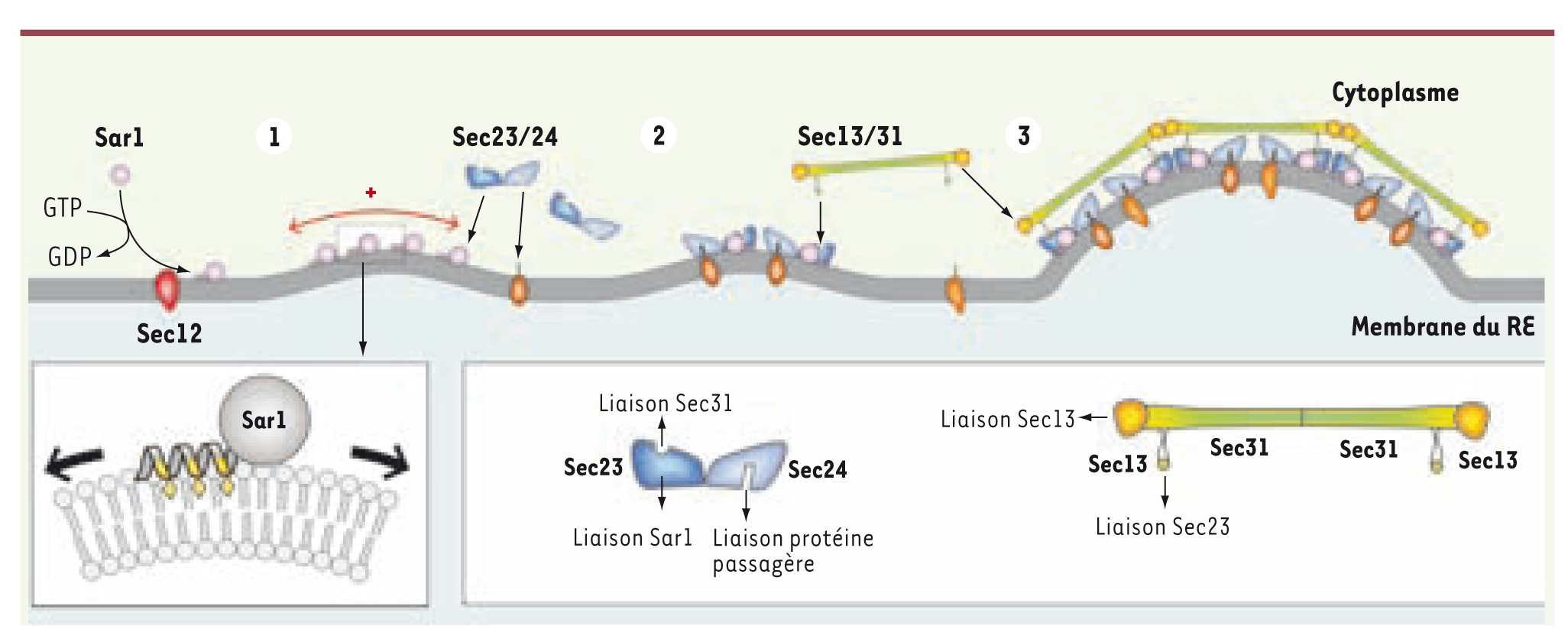
Comment fabriquer une vésicule : l’exemple des vésicules COPII La genèse des vésicules COPII démarre par l’activation de la petite protéine G Sar1. Elle est soluble et inactive dans le cytoplasme lorsqu’elle est liée à une molécule de GDP (guanosine diphosphate). Lorsque le facteur d’échange Sec12 catalyse la substitution du GDP par un GTP (guanosine triphosphate), il provoque le changement de conformation de Sar1, qui ainsi activée s’attache à la membrane du RE [
6] et se positionne dans un site d’export via son interaction avec la protéine Sec16 [
7]. Sar1 recrute alors le premier étage du manteau COPII, l’hétérodimère Sec23/Sec24 qui à son tour recrute diverses protéines « passagères » diffusant dans la membrane pour peu qu’elles arborent un motif de reconnaissance spécifique. Par ailleurs, Sec23/24 sert de point d’ancrage pour le second étage du manteau, Sec13/31 qui polymérise et rassemble les complexes Sar1-Sec23/24 et leur cargaison. Mais comment ces protéines déforment-elles la membrane ? Sar1, une fois activée, expose une hélice amphipathique de 23 acides aminés pour s’ancrer à la membrane. Ce motif structural possède une face hydrophobe qui fuit l’eau et s’insère entre les chaînes carbonées des lipides et une face polaire dirigée vers le solvant qui interagit avec la tête polaire des lipides. Une membrane lipidique plane possède deux feuillets de surface identique. Lorsque, localement, de nombreuses protéines Sar1 s’insèrent dans le feuillet externe (côté cytoplasme), elles induisent un écartement des lipides et donc l’expansion de ce feuillet alors que la surface de l’autre feuillet reste inchangée. Pour s’accommoder de cette asymétrie, la membrane se bombe du côté cytoplasmique et acquiert une courbure définie comme positive [
8]. Ensuite, le recrutement du dimère Sec23/24 par Sar1 stabilise la courbure ainsi initiée. En effet, Sec23/24 possède une structure tridimensionnelle en nœud papillon : la face de Sec23/24 qui interagit avec la membrane est concave, lui permettant d’agir comme un moule qui contraint la membrane à garder une forme sphérique [
9]. Enfin, les hétérotétramères Sec13/31 entrent en jeu. Chaque hétérotétramère est une baguette de 28 nm dont chaque extrémité peut interagir avec celles de trois autres Sec13/31 [
10]. Soixante d’entre eux vont s’assembler en une cage icosidodécaédrique, dont chaque sommet est positionné au-dessus de quatre hétérodimères Sec23/24 qui servent donc de piliers à cet assemblage. La formation de la cage va unifier les points de courbure générés par les complexes Sar1-Sec23/24 [
11] et donc induire une déformation globale de la membrane en un bourgeon (Figure 2).  | Figure 2.
Formation des vésicules COPII. Sar1 activée induit une courbure positive (1) et recrute le complexe Sec23/24 qui se lie aux protéines passagères (2). Les complexes sont rassemblés par l’assemblage de Sec13/31 en une cage (3) qui induit le bourgeonnement de la membrane en vésicule. En détail : induction d’une courbure membranaire par l’insertion de l’hélice de Sar1 (losange jaune : résidu hydrophobe) et structure de Sec23/24 et Sec13/31. |
|
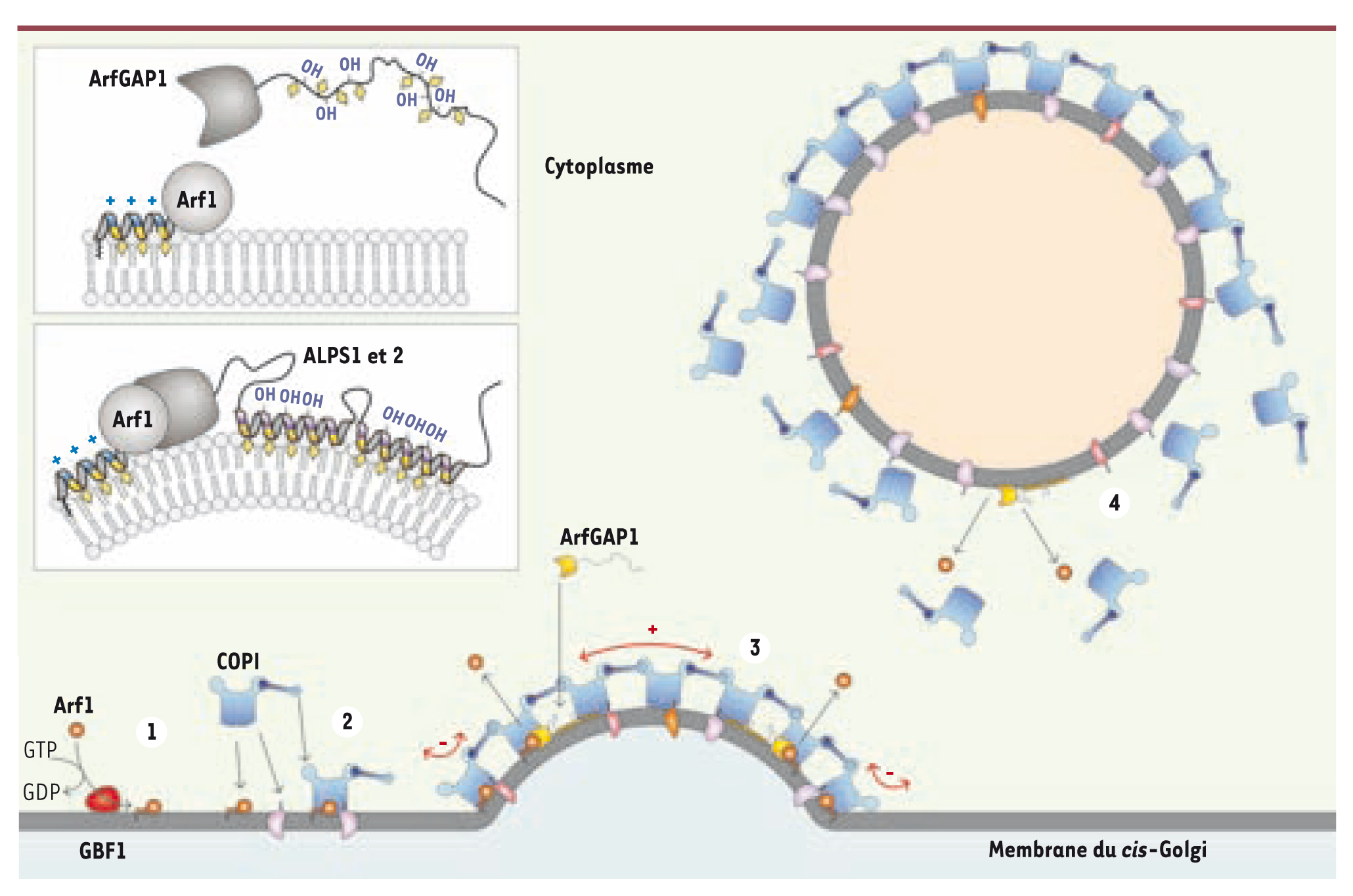
Régulation du manteau COPI par la courbure membranaire S’il existe des protéines qui génèrent des vésicules en courbant les membranes, nous avons montré en étudiant la genèse des vésicules COPI qu’il existait aussi des protéines qui savaient reconnaître cette courbure. La formation des vésicules COPI débute aussi par l’activation d’une petite protéine G, cette fois-ci Arf1 (ADP-ribosylation factor 1), par son facteur d’échange (GBF1) localisé au cis-Golgi. Arf1 recrute sur la membrane un complexe soluble constitué de sept sous-unités, appelé coatomer. Comme le manteau COPII, le coatomer polymérise pour induire le bourgeonnement d’une membrane et interagit spécifiquement avec certaines protéines pour les concentrer dans ce bourgeon. La microscopie électronique montre qu’un manteau COPI déforme aussi bien les membranes qu’un manteau COPII mais la structure du coatomer reste encore à déterminer [
12]. Revenons sur un fait important : durant la vie d’une vésicule, l’existence d’un manteau doit être transitoire. La vésicule une fois formée doit se débarrasser de son manteau qui représente un obstacle à la fusion de sa membrane avec celle du compartiment cible. Comment initier ce désassemblage ? Le recrutement des manteaux dépend de l’activation d’Arf1 ou de Sar1 : les désactiver apparaît donc essentiel pour déstabiliser les manteaux, et pour cela des GAP spécifiques (GTPase activating protein) vont stimuler l’hydrolyse du GTP en GDP. Dans les vésicules COPI, la désactivation d’Arf1 fait intervenir ArfGAP1 (Arf GTPase activating protein). In vitro, en utilisant des protéines purifiées et des liposomes dont nous maîtrisons la composition et la taille, nous avons observé qu’ArfGAP1 déclenche la dépolymérisation très rapide du manteau lorsque celui-ci recouvre des liposomes d’un diamètre proche de celui d’une vésicule (~ 60 nm) et une réaction beaucoup plus lente lorsque les liposomes sont plus grands (~ 180 nm) [
13]. En d’autres termes, l’efficacité d’ArfGAP1 s’accroît avec la courbure de la membrane. Le modèle original qui dérive de cette observation est le suivant : sous le manteau, au centre du bourgeon où la courbure est positive, ArfGAP1 désactive rapidement Arf1 ; au bord du manteau, où le bourgeon est attaché à son compartiment par un cou de courbure négative, Arf1 n’est pas désactivée et stabilise la liaison à la membrane d’un anneau de coatomer. Retenus par cet anneau, les coatomers du centre du bourgeon, malgré la perte d’Arf1, restent attachés à la membrane dans un état métastable via leurs interactions latérales et le lien avec les protéines passagères. Lors de la fission de la vésicule, la courbure devient positive en tout point : ArfGAP1 désactive alors les derniers complexes Arf1/coatomer pour entraîner une dissociation immédiate du manteau. Ainsi, le manteau, en induisant une courbure positive lors du bourgeonnement, programmerait rétroactivement, via ArfGAP1, son propre désassemblage (Figure 3).
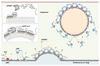 | Figure 3.
Régulation du désassemblage de COPI par ArfGAP1. L’activation d’Arf1 (1) entraîne le recrutement du coatomer
(2) et des protéines passagères. ArfGAP1 inactive Arf1 lors du bourgeonnement (3) dans la zone de courbure positive. Après fission membranaire (4), ArfGAP1 provoque la dépolymérisation immédiate du manteau. En détail : les hélices ALPS se structurent et s’insèrent entre les lipides uniquement lorsque la courbure induit un écartement des lipides suffisant (losange jaune : résidu hydrophobe ; OH : sérine et thréonine). |
Comment ArfGAP1 reconnaît-il la courbure membranaire ? Nous avons identifié dans ArfGAP1 deux motifs d’une trentaine d’acides aminés que nous avons appelés ALPS (amphipathic lipid packing sensor) qui se structurent en hélice amphipathique et interagissent avec une membrane courbée [
14,
15]. À l’inverse de celles d’Arf1 et de Sar1, ces hélices n’induisent pas de courbure positive, mais la détectent. La plupart des hélices amphipathiques interagissent avec les membranes cellulaires à la fois par leur face hydrophobe et par leur face polaire qui, contenant des acides aminés basiques, peut interagir de manière électrostatique avec les lipides chargés négativement contenus dans ces membranes. Le motif ALPS est différent : sa face polaire comprend une majorité de sérines et de thréonines et très peu de résidus basiques. Lorsque l’on introduit des résidus basiques dans le motif ALPS, ArfGAP1 devient insensible à la courbure [
16] ! L’incapacité d’interagir de façon électrostatique avec une membrane est donc un atout pour la fonction d’ArfGAP1. Pourquoi ? Parce que l’interaction des motifs ALPS avec la membrane dépend alors exclusivement de l’insertion de la face hydrophobe entre les lipides et que cette interaction ne devient forte que lorsque la courbure induit un écartement suffisant des lipides. |
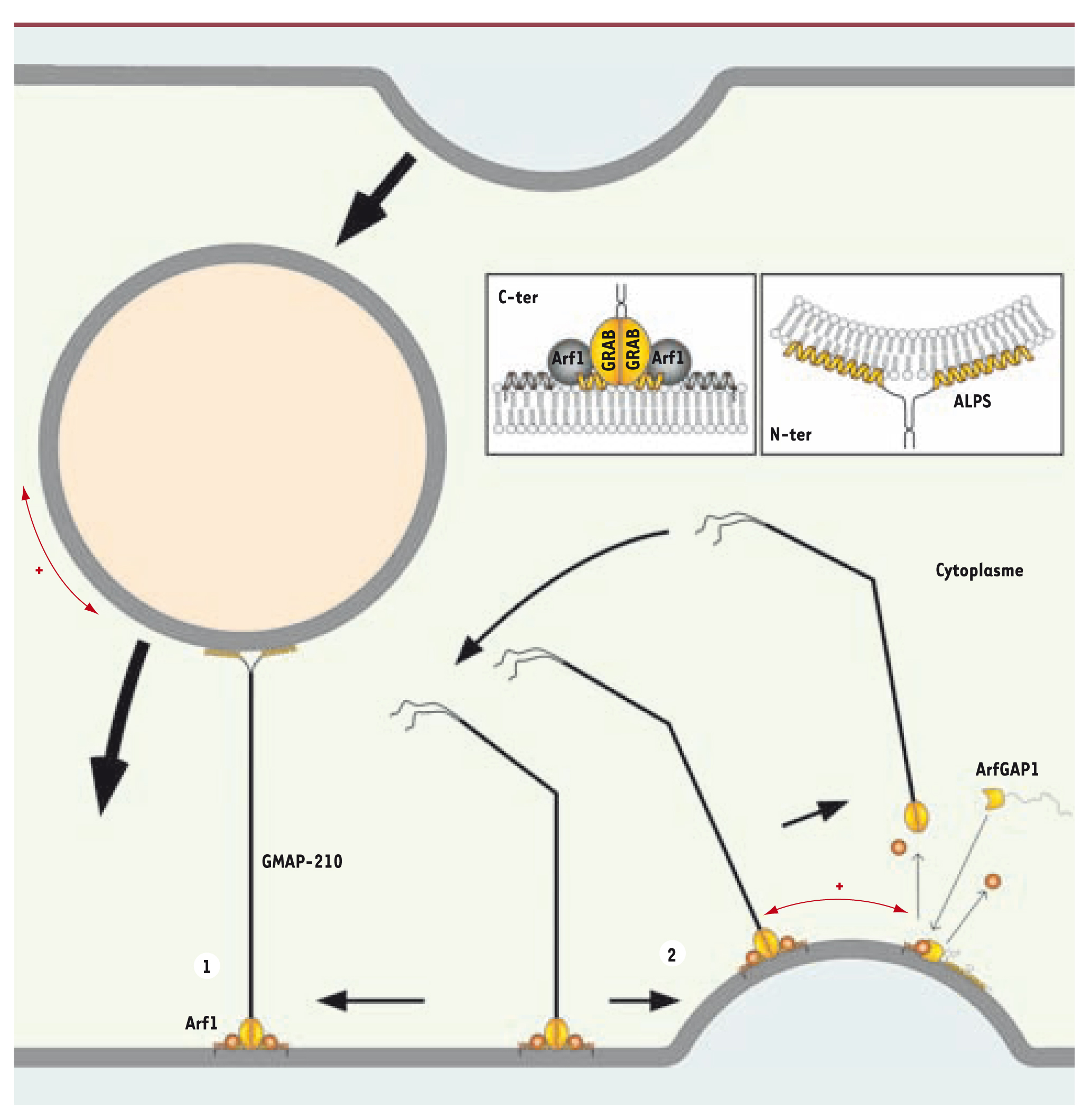
Courbure membranaire et attachement des vésicules Nous avons identifié par un criblage informatique d’autres protéines disposant d’un motif ALPS dont GMAP-210 (Golgi microtubule associated protein), une protéine affiliée aux golgines [
17]. Certaines golgines sont connues pour attacher transitoirement des vésicules COPI et COPII à leur compartiment cible afin de les astreindre à fusionner avec lui. GMAP-210 est assimilable à une corde moléculaire longue de 200 nm, une structure idéale pour connecter deux membranes. De manière curieuse, le motif ALPS identifié correspond à l’une des extrémités de GMAP-210 et nous avons pu prouver in vitro que celle-ci liait uniquement des membranes très courbées. L’autre extrémité contient un domaine GRAB (GRIP-related Arf-binding) recruté à la membrane par … Arf1. Il n’est pas surprenant de retrouver Arf1 car c’est une protéine clé qui recrute de multiples effecteurs sur le Golgi. Grâce à ces deux extrémités, GMAP-210 connecte des petits liposomes très courbés avec des liposomes recouverts d’Arf1. Mais d’après nos résultats sur les vésicules COPI, nous avons postulé et vérifié qu’Arf1, sous le contrôle permanent d’ArfGAP1, était incapable de recruter de manière stable le domaine GRAB sur des petits liposomes très courbés. La seule connexion que GMAP-210 peut établir, c’est donc une connexion entre une membrane courbée par son hélice ALPS et une membrane plane par son domaine GRAB [
18]. Nous envisageons que, dans une cellule, GMAP-210 ancrée par son domaine GRAB sur la membrane plane d’une citerne golgienne puisse capturer avec son extrémité ALPS une vésicule de transport caractérisée elle par une forte courbure. GMAP-210 interagirait transitoirement avec cette vésicule pour éviter sa dispersion lors de son transit vers son compartiment cible et lui permettre de le rejoindre plus efficacement. Dans un contexte où bourgeonnent sans cesse des vésicules, ArfGAP1 permet de restreindre la localisation du domaine GRAB à la surface plane d’une citerne alors que l’autre extrémité de GMAP-210 pointe en direction des vésicules à capturer (Figure 4). Nous comprenons ainsi pourquoi la surexpression de GMAP-210 dans une cellule bloque le transport vésiculaire entre appareil de Golgi et RE et induit l’accumulation de vésicules COPI et COPII dans le cytoplasme [
19] : multiplier les possibilités d’attachement entre vésicule et compartiment conduit à ralentir le transit des vésicules jusqu’à l’arrêter. 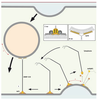 | Figure 4.
Modèle sur la golgine GMAP-210. GMAP-210 ancrée via son domaine GRAB par Arf1 sur la surface plane d’une citerne golgienne reconnaît la surface courbée d’une vésicule de transport par ses hélices ALPS (1). L’ancrage de GMAP-210 via le domaine GRAB est rendu impossible par la présence d’ArfGAP1 sur des zones de bourgeonnement (2). Ainsi, GMAP-210 assure à tout instant un attachement asymétrique entre membranes planes et vésicules de transport. |
|
D’autres membranes, d’autres manières de détecter la courbure Nous proposons donc que pour des phénomènes très dynamiques comme le transport vésiculaire où la membrane est constamment déformée, la sensibilité de reconnaissance par les protéines telles qu’ArfGAP1 ou GMAP-210 de la courbure membranaire soit un moyen simple et efficace d’introduire des processus de régulation. Cependant, si la forme d’une membrane joue un rôle crucial pour recruter certaines protéines, il en est de même pour sa composition lipidique [
20]. Par ailleurs, forme et composition de la membrane sont intrinsèquement liées car les lipides ont individuellement une forme et ensemble influencent celle de la membrane. Les membranes, par exemple celles du cis-Golgi, contiennent majoritairement des lipides de forme cylindrique (phosphatidylcholine, phosphatidylinositol, phosphatidylsérine) et peu de lipides de forme conique (comme la phosphatidyléthanolamine ou le diacylglycérol) et de ce fait possèdent une structure plane. Une modification transitoire et locale de cette composition pourrait déclencher des déformations extrêmes de la membrane (comme lors de la fission d’un bourgeon en vésicule) [
21]. Inversement, déformer localement une membrane peut enrichir cette déformation avec certains types de lipides [
22]. Nous observons que la sensibilité d’ArfGAP1 à la courbure est réglée par la composition lipidique et que cette sensibilité est maximale pour des compositions mimant celle d’une membrane golgienne. Il est d’ailleurs très probable que le motif ALPS ne sache pas fonctionner sur, par exemple, des membranes plasmiques qui contiennent des lipides absents du RE ou du cis-Golgi comme la sphingomyéline et le cholestérol qui la rendent plus rigide. Nous comprenons alors qu’il puisse exister d’autres stratégies pour reconnaître une courbure. Plusieurs protéines, impliquées par exemple dans la genèse des vésicules à clathrine émergeant de la membrane plasmique, contiennent un domaine dimérique BAR en forme de croissant qui possède une surface concave et rigide pour interagir électrostatiquement avec les phosphatidylsérines enrichies dans ces membranes [
23,
24]. Il ne s’agit pas ici comme le motif ALPS de détecter des espacements entre lipides provoqués par la courbure mais de reconnaître directement la forme de cette membrane. Il existe différentes sous-familles de domaine BAR dont la structure semble adaptée à des courbures différentes [
25]. De plus, le domaine BAR est parfois flanqué d’hélices amphipathiques inductrices de courbure et/ou de domaines reconnaissant des lipides particuliers et qui possèdent quelquefois une capacité de polymérisation. Il semble que ces protéines ne soient pas simplement des senseurs de courbure mais surtout des protéines capables d’accentuer et de stabiliser une courbure membranaire préexistante. En comparaison, les protéines ArfGAP1 et GMAP-210 semblent, grâce à leurs motifs ALPS, définir une nouvelle famille de protéines qui sont clairement et uniquement des senseurs de courbure. À l’avenir, l’étude d’autres protéines contenant un motif ALPS permettra de voir si la courbure membranaire influence d’autres processus comme par exemple la régulation de la composition des membranes via le transporteur de stérol Kes1p [16]. Mais ceci est une autre histoire. |
1. Losev E, Reinke CA, Jellen J, et al. Golgi maturation visualized in living yeast. Nature 2006; 441 : 1002–6. 2. Rabouille C, Klumperman J. Opinion: the maturing role of COPI vesicles in intra-Golgi transport. Nat Rev Mol Cell Biol 2005; 6 : 812–7. 3. Bonifacino JS, Glick BS. The mechanisms of vesicle budding and fusion. Cell 2004; 116 : 153–66. 4. Galli T, Martinez-Arca S, Paumet F. Mécanisme de la fusion membranaire. Med Sci (Paris) 2002; 18 : 1113–9. 5. Fromme JC, Orci L, Schekman R. Coordination of COPII vesicle trafficking by Sec23. Trends Cell Biol 2008; 18 : 330–6. 6. Antonny B. Contrôle de l’assemblage des manteaux protéiques COP par les petites protéines G Arf et Sar. Med Sci (Paris) 2002; 18 : 1012–6. 7. Bhattacharyya D, Glick BS. Two mammalian Sec16 homologues have nonredundant functions in endoplasmic reticulum (ER) export and transitional ER organization. Mol Biol Cell 2007; 18 : 839–49. 8. Lee MC, Orci L, Hamamoto S, et al. Sar1p N-terminal helix initiates membrane curvature and completes the fission of a COPII vesicle. Cell 2005; 122 : 605–17. 9. Bi X, Corpina RA, Goldberg J. Structure of the Sec23/24-Sar1 pre-budding complex of the COPII vesicle coat. Nature 2002; 419 : 271–7. 10. Fath S, Mancias JD, Bi X, Goldberg J. Structure and organization of coat proteins in the COPII cage. Cell 2007; 129 : 1325–36. 11. Stagg SM, LaPointe P, Razvi A, et al. Structural basis for cargo regulation of COPII coat assembly. Cell 2008; 134 : 474–84. 12. McMahon HT, Mills IG. COP and clathrin-coated vesicle budding: different pathways, common approaches. Curr Opin Cell Biol 2004; 16 : 379–91. 13. Bigay J, Gounon P, Robineau S, Antonny B. Lipid packing sensed by ArfGAP1 couples COPI coat disassembly to membrane bilayer curvature. Nature 2003; 426 : 563–6. 14. Bigay J, Casella JF, Drin G, et al. ArfGAP1 responds to membrane curvature through the folding of a lipid packing sensor motif. EMBOJ 2005; 24 : 2244–53. 15. Mesmin B, Drin G, Levi S, et al. Two lipid-packing sensor motifs contribute to the sensitivity of ArfGAP1 to membrane curvature. Biochemistry 2007; 46 : 1779–90. 16. Drin G, Casella JF, Gautier R, et al. A general amphipathic alpha-helical motif for sensing membrane curvature. Nat Struct Mol Biol 2007; 14 : 138–46. 17. Short B, Haas A, Barr FA. Golgins and GTPases, giving identity and structure to the Golgi apparatus. Biochim Biophys Acta 2005; 1744 : 383–95. 18. Drin G, Morello V, Casella JF, et al. Asymmetric tethering of flat and curved lipid membranes by a golgin. Science 2008; 320 : 670–3. 19. Pernet-Gallay K, Antony C, Johannes L, et al. The overexpression of GMAP-210 blocks anterograde and retrograde transport between the ER and the Golgi apparatus. Traffic 2002; 3 : 822–32. 20. Lemmon MA. Membrane recognition by phospholipid-binding domains. Nat Rev Mol Cell Biol 2008; 9 : 99–111. 21. Schmidt A. Rôle de la modification des lipides dans la biogénèse de vésicules et la fission. Med Sci (Paris) 2002; 18 : 1137–45. 22. Roux A, Cuvelier D, Nassoy P, et al. Role of curvature and phase transition in lipid sorting and fission of membrane tubules. EMBO J 2005; 24 : 1537–45. 23. Peter BJ, Kent HM, Mills IG, et al. BAR domains as sensors of membrane curvature: the amphiphysin BAR structure. Science 2004; 303 : 495–9. 24. Gallop JL, McMahon HT. BAR domains and membrane curvature: bringing your curves to the BAR. Biochem Soc Symp 2005; 72 : 223–31. 25. Wang Q, Kaan HY, Hooda RN, et al. Structure and plasticity of Endophilin and Sorting Nexin 9. Structure 2008; 16 : 1574–87. |