| |
| Med Sci (Paris). 2009 May; 25(5): 454–456. Published online 2009 May 15. doi: 10.1051/medsci/2009255454.CK1α participle à l’immunité adaptive et à la lymphomagenèse Nicolas Bidère* Inserm U542, Université Paris-Sud, Hôpital Paul Brousse, 94800 Villejuif, France MeSH keywords: Protéines adaptatrices de la transduction du signal, Antigènes, Protéines adaptatrices de signalisation CARD, Casein Kinase Ialpha, Caspases, Transformation cellulaire néoplasique, Guanylate cyclase, Humains, Immunité cellulaire, Cellules Jurkat, Lymphocytes, Lymphome B diffus à grandes cellules, Facteur de transcription NF-kappa B, Protéines tumorales, Protéines de type Wingless |
Le facteur de transcription NF-κB joue un rôle vital dans le développement, la survie et le maintien de l’homéostasie du système immunitaire [
1]. Présent de manière constitutive dans le cytosol, l’hétérodimère NF-κB (le plus souvent p65/p50) est séquestré par son inhibiteur IκBα qui masque sa séquence de localisation nucléaire [
2,
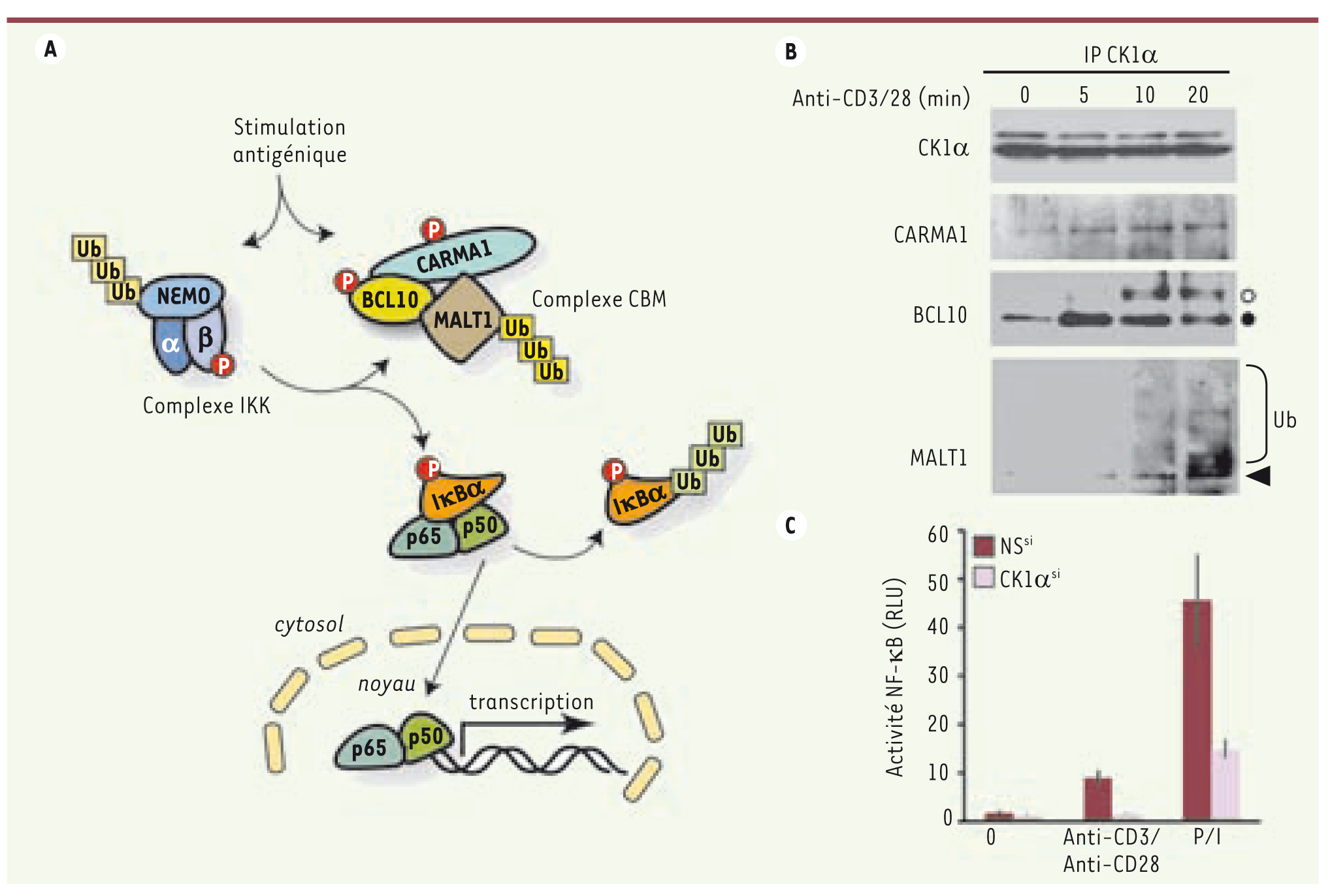
3]. L’activation de NF-κB repose sur la mise en place de plates-formes multiprotéiques spécifiques d’un stimulus dont la fonction est de recruter et rendre compétent le complexe IKK (inhibitor of NF-κB kinase). IKK phosphoryle alors IβBα, ce qui permet sa dégradation par le protéasome. Libéré d’IκBα, NF-κB migre vers le noyau où il déclenche la transcription de ses gènes cibles (Figure 1).  | Figure 1.
CK1α et NF-κB dans les lymphocytes. A. La stimulation antigénique assemble un large complexe multiprotéique activateur de NF-κB. Parallèlement, le complexe IKK (IKKa/IKKb/NEMO) est modifié par phosphorylation et ubiquitinylation (sans dégradation) tandis que CARMA1 lie l’hétérodimère BCL10/MALT1 (complexe CBM). Le CBM recrute ensuite IKK et lui permet de phosphoryler l’inhibiteur de NF-κB, IkBa qui est alors secondairement ubiquitinylé et dégradé par le protéasome. NF-κB se relocalise alors dans le noyau et y active la transcription de ses gènes cibles. Ub, ubiquitine. B. La stimulation de lymphocytes T Jurkat par 1 µg ml-1 d’anti-CD3 et d’anti-CD28 entraîne l’association de CK1α avec le CBM, évalué après immunoprécipitation (IP) de CK1α. Les cercles pleins et ouverts indiquent respectivement BCL10 et ses formes phosphorylées. Ub, ubiquitine. C. L’activité d’un gène rapporteur NF-κB a été évaluée dans des cellules Jurkat transfectées par des siARN contrôles (NSsi) ou dirigés contre CK1α (CK1αsi). Les cellules ont été stimulées pendant 6 heures avec 0,5 µg ml-1 d’anti-CD3 et d’anti-CD28, ou par 10 ng ml-1 de phorbol 12-myristate 13-acétate et 300 ng ml-1 de ionomycine (P/I). Les résultats représentent la moyenne + s.d. de résultats en triplicate. RLU : relative light unit. |
|
CARMA 1 et le complexe CBM Dans les lymphocytes, la stimulation antigénique assemble un « signalosome » dont la composition demeure mal caractérisée [
4]. En particulier, la protéine d’échafaudage CARMA1 (caspase recruitment domain-containing membrane-associated guanylate kinase protein-1), et l’hétérodimère BCL10/MALT1 (mucosa-associated lymphoid tissue) (complexe CBM) émergent comme des acteurs essentiels de la machinerie NF-κB (Figure 1A) [
5–
7]. La protéine kinase C (PKC) θ ou β, dans les cellules T et B, respectivement, recrute et phosphoryle CARMA1 dans les microdomaines des radeaux lipidiques. CARMA1 change alors de conformation et autorise l’association de BCL10/MALT1 nécessaire à la formation du signalosome [
8]. Le CBM participe également à la propagation des lymphomes B de type ABC-DLBCL (activated B cell-like diffuse large B-cell lymphoma), dont la survie repose sur une activité aberrante de NF-κB [
9]. Comprendre les modes de régulation du CBM en conditions physiologiques comme pathologiques se révèle donc être un enjeu majeur. |
Le double jeu de la caséine kinase 1α Afin de caractériser de nouveaux régulateurs du CBM, deux cribles furent menés parallèlement : une recherche protéomique par spectrométrie de masse de partenaires de CARMA1, et le criblage génétique d’une banque de 1854 vecteurs shARN ciblant 683 gènes afin d’identifier lesquels parmi ceux-ci sont requis pour la croissance des ABC-DLBCL. Dans les deux cas, nous avons identifié la caséine kinase 1a (CK1α) comme un modulateur important de NF-κB et du processus de développement de lymphomes [
10]. CK1α appartient à une famille de sept sérine thréonine kinases codées par autant de gènes, qui régulent l’homéostasie et diverses voies ou fonctions importantes au cours du développement telles que la voie WNT/β-caténine, ou le rythme circadien [
11]. Contre toute attente, la stimulation de lymphocytes T Jurkat via leur récepteur T (TCR) recrute CK1α de façon dynamique dans le complexe CBM actif, qui se caractérise par la présence de formes phosphorylées de BCL10 et ubiquitinylées de MALT1 [4] (Figure 1B). L’absence des protéines qui composent le CBM compromet la prolifération lymphocytaire en supprimant l’activation de NF-κB [5]. Afin d’évaluer l’impact fonctionnel de CK1α, ses niveaux d’expression furent réduits par interférence de l’ARN (ARNi). Dans des lymphocytes T primaires humains, diminuer l’expression de CK1α réduit significativement leur capacité à s’activer, à produire de l’interleukine-2, et, in fine, à proliférer. Ces modifications s’accompagnent d’une diminution de la phosphorylation et de la dégradation d’IκBα, et donc d’une réduction de la translocation de NF-κB du cytosol vers le noyau et d’une baisse sévère de son activité transcriptionnelle (Figure 1C). Aucune des trois protéines BCL10, CARMA1 [
12] ou CK1α ne participe cependant à la phosphorylation initiale de IKK ; elles ne font qu’autoriser ce dernier à exercer son rôle au niveau du CBM. Ainsi, CK1α est un nouveau modulateur de l’activation de NF-κB dans les lymphocytes. Curieusement, l’abrogation de l’activité kinase de CK1α par l’introduction de mutations dans le site ATPase exacerbe l’activation de NF-κB induite par la fixation de l’antigène au TCR. CK1α exerce donc des fonctions contradictoires au sein du CBM, d’une part en permettant la transmission du signal NF-κB, et d’autre part en le réduisant via une boucle de rétrocontrôle négatif. Cette apparente dichotomie n’est pas sans rappeler le rôle exercé par IKKβ qui phosphoryle BCL10 pour entraîner sa dégradation en plus de sa fonction positive sur l’activation de NF-κB [
6, 7]. D’ailleurs, CK1α peut phosphoryler CARMA1 sur le site phospho-accepteur sérine 608 et sa substitution en une alanine amplifie l’activation de NF-κB induite par l’activation du TCR. L’ensemble de ces données suggèrent que CK1α participe à la régulation négative du CBM en phosphorylant et inactivant CARMA1. L’introduction de shARN spécifiques de CK1α dans différentes lignées ABC-DLBCL réduit l’activation aberrante de NF-κB et supprime leur croissance. En revanche, ces mêmes shARN ne sont pas toxiques pour des lignées myéloïdes ou des lymphocytes B de GCB-DLCBL (germinal centre B-cell like diffuse large B-cell lymphoma), dont la prolifération est indépendante de NF-κB. Enfin, la réintroduction d’une forme sauvage de CK1α, mais pas celle d’un mutant incapable de lier CARMA1, restaure la croissance de lignées ABC-DLCBL traitées avec des shARN CK1α, soulignant l’importance de la coopération physique de ces deux protéines. |
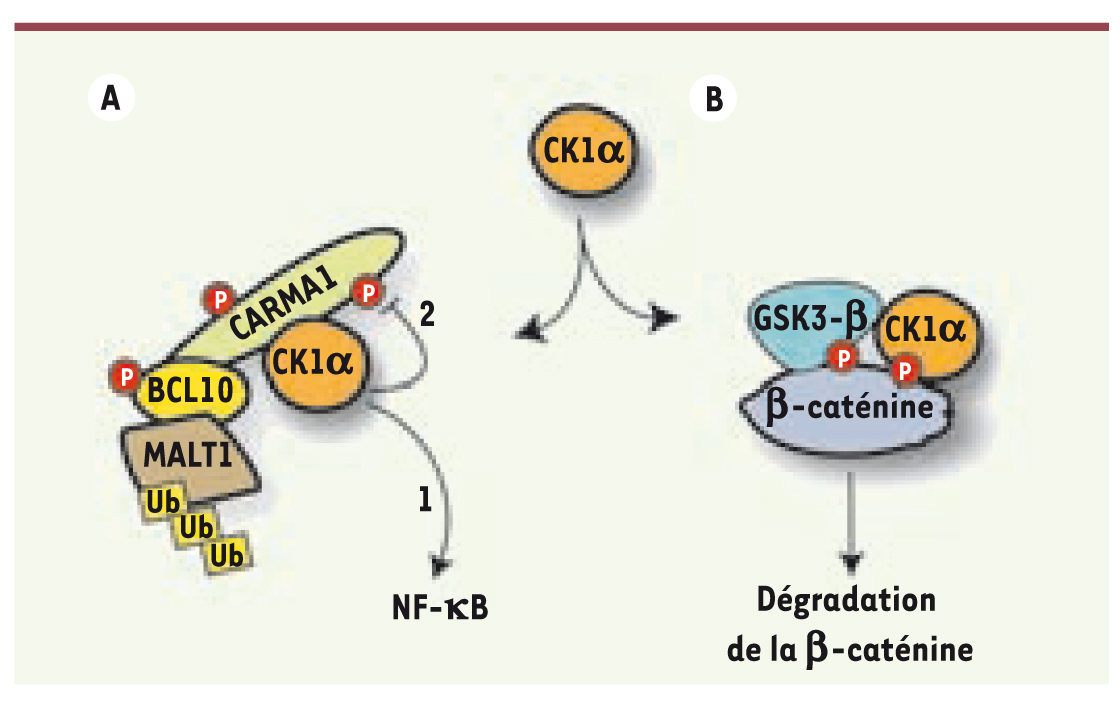
CK1α, un gène impliqué dans la propagation du phénotype transformé Ces travaux révèlent donc une connexion inattendue entre les voies WNT et NF-κB par l’intermédiaire de CK1α. Classiquement, l’action de CK1α est inextricablement liée à GSK3β(glycogen synthase kinase 3) avec lequel il coopère pour éliminer la β-caténine dans un complexe de dégradation (Figure 2) [
13]. Tel ne semble toutefois pas être le cas durant la stimulation par le TCR puisque dans ces conditions, GSK3β ne semble participer ni au CBM, ni à l’activation de NF-κB (N.B., résultats non publiés). Il nous appartient donc de déterminer, dans le futur, les mécanismes moléculaires qui contrôlent la redistribution de CK1α dans le CBM, ainsi que ses partenaires spécifiques. Enfin, la dépendance des lignées ABC-DLCBL vis-à-vis de CK1α est analogue au phénomène d’addiction non oncogénique observé dans certains cancers. CK1α peut donc être classé parmi les gènes dits CeMal, conditionally essential malignancy, une nouvelle catégorie de gènes impliqués non pas dans l’initiation, mais dans la propagation du phénotype transformé.  | Figure 2.
CK1α dans les voies NF-κB et WNT. CK1α régule les voies NF-κB et WNT. A. L’activation antigénique redistribue CK1α dans le CBM et permet l’activation du facteur de transcription NF-κB (1). Dans cette situation, CK1α inactive secondairement CARMA1 par phosphorylation (2). B. CK1α est également essentielle pour la voie des WNT. CK1α coopère avec GSK3β dans un complexe nommé « degradation box » pour phosphoryler et dégrader la β-caténine en l’absence de ligand WNT. |
|
Cette étude a été financée par le National Institutes of Health (NIH), l’Institut National de la Santé et de la Recherche médicale (Inserm), l’Agence nationale pour la recherche (ANR) et par la Ligue Nationale contre le Cancer. N.B. tient à remercier ses collègues des laboratoires de M.J. Lenardo et L.M. Staudt.
|
1. Hacker H, Karin M. Regulation and function of IKK and IKK-related kinases. Sci STKE 2006; 2006 : re13. 2. Lobry C, Weil R. Mécanismes régulateurs de la voie NF-kappaB dans les lymphocytes T.Med Sci (Paris) 2007; 23 : 857–61. 3. Baud V, Jacque E. Voie alternative d’activation de NF-κB et cancer : amis ou ennemis ? Med Sci (Paris) 2008; 24 : 1083–8. 4. Oeckinghaus A, Wegener E, Welteke V, et al. Malt1 ubiquitination triggers NF-kappaB signaling upon T-cell activation. EMBO J 2007; 26 : 4634–45. 5. Rawlings DJ, Sommer K, Moreno-Garcia ME. The CARMA1 signalosome links the signalling machinery of adaptive and innate immunity in lymphocytes. Nat Rev Immunol 2006; 6 : 799–812. 6. Lobry C, Weil R. Nouveaux mécanismes régulateurs de Bcl10 : Une avancée dans la compréhension de la survenue des lymphomes du MALT ? Med Sci (Paris) 2007; 23 : 353–5. 7. Lobry C, Lopez T, Israel A, Weil R. Negative feedback loop in T cell activation through IkappaB kinase-induced phosphorylation and degradation of Bcl10. Proc Natl Acad Sci USA 2007; 104 : 908–13. 8. Matsumoto R, Wang D, Blonska M, et al. Phosphorylation of CARMA1 plays a critical role in T Cell receptor-mediated NF-kappaB activation. Immunity 2005; 23 : 575–85. 9. Ngo VN, Davis RE, Lamy L, et al. A loss-of-function RNA interference screen for molecular targets in cancer. Nature 2006; 441 : 106–10. 10. Bidere N, Ngo VN, Lee J, et al. Casein kinase 1alpha governs antigen-receptor-induced NF-kappaB activation and human lymphoma cell survival. Nature 2009; 458 : 92–6. 11. Price MA. CKI, there’s more than one: casein kinase I family members in Wnt and Hedgehog signaling. Genes Dev 2006; 20 : 399–410. 12. Shambharkar PB, Blonska M, Pappu BP, et al. Phosphorylation and ubiquitination of the IkappaB kinase complex by two distinct signaling pathways. EMBO J 2007; 26 : 1794–805. 13. Liu C, Li Y, Semenov M, et al. Control of beta-catenin phosphorylation/degradation by a dual-kinase mechanism. Cell 2002; 108 : 837–47. |