| |
| Med Sci (Paris). 2009 May; 25(5): 449–450. Published online 2009 May 15. doi: 10.1051/medsci/2009255449.EpCAM, une protéine versatile impliquée dans l’oncogenèse Olivier Gires* Clinical Cooperation Group Molecular Oncology, Ludwig-Maximilians-University, Head and neck Research, et Helmholtz Center Munich, Marchioninistrasse 15, D-81377 Munich, Allemagne MeSH keywords: Protéines ADAM, Antigènes néoplasiques, Antinéoplasiques, Cadhérines, Molécules d'adhérence cellulaire, Membrane cellulaire, Systèmes de délivrance de médicaments, Conception de médicament, Régulation de l'expression des gènes tumoraux, Humains, Facteur de transcription LEF-1, Protéines tumorales, Tumeurs, Oncogènes, Présénilines, Maturation post-traductionnelle des protéines, Transduction du signal, bêta-Caténine |
La protéine EpCAM (epithelial cell adhesion molecule) a été découverte il y a à présent 30 ans et décrite comme un antigène dominant dans les cancers du côlon ; l’expression d’EpCAM déclenche une réaction immunitaire aboutissant à la production d’anticorps chez la souris [
1]. À la suite de cette découverte, de nombreux groupes de recherche décriront EpCAM sous de multiples noms différents correspondant généralement à ceux des anticorps utilisés lors de la purification de cet antigène. La nomenclature a été depuis unifiée, et il est convenu de nommer la protéine EpCAM et le gène EpCAM [
2]. Du point de vue structurel, EpCAM est une protéine transmembranaire composée d’une partie extracellulaire (265 acides aminés), d’un seul domaine transmembranaire, et d’une très courte région cytoplasmique contenant 26 acides aminés n’ayant aucune ressemblance avec les séquences consensus habituellement exprimées dans le groupe des récepteurs membranaires tels que HER-2, EGF-R (epidermal growth factor receptor) et autres. La partie extracellulaire, quant à elle, comporte deux séquences riches en cystéine et comparables à celles qui ont été décrites dans l’EGF-R. Elles seraient nécessaires lors du contact homophile des molécules EpCAM sur la même cellule et sur les cellules opposées [
3]. |
EpCAM : une cible thérapeutique attractive La fréquente et forte surexpression de cette protéine explique que d’innombrables approches thérapeutiques utilisent EpCAM comme molécule cible d’anticorps, de vaccins composés de protéines ou d’ADN, ou de cellules immunitaires spécifiques [2]. Trois types d’anticorps thérapeutiques se sont imposés au cours d’études cliniques : les anticorps monoclonaux, les anticorps bispécifiques reconnaissant EpCAM et la protéine CD3 exprimée sur les cellules lymphocytaires T, ainsi que les fragments d’anticorps synthétisés de manière recombinante. Ces anticorps et leurs dérivés agissent en opsonisant les cellules tumorales exprimant EpCAM, en induisant une réaction immunitaire avec comme conséquence un effet cytotoxique (AICC, antibody-induced cell cytotoxicity). Removab®, un anticorps thérapeutique bispécifique, exerce une triple fonction : il recrute les cellules lymphocytaires T ainsi que toutes les cellules immunitaires exprimant à leur surface un récepteur pour le fragment Fcg des immunoglobulines, et les dirige vers les cellules cibles, c’est-à-dire les cellules de tumeur exprimant EpCAM. Removab® reçut récemment l’autorisation d’être utilisé en thérapeutique chez les patients ayant une ascite secondaire à des métastases péritonéales de carcinomes de l’ovaire, du sein, et de l’utérus (http://www.trionpharma.de/index.php ?id=49). D’autres anticorps, par exemple Adecatumumab® (MT201) de la compagnie Micromet Inc. sont actuellement testés dans des essais cliniques de phases I et II, et seront probablement disponibles sur le marché dans les 2 à 5 ans à venir. |
EpCAM, un signal de prolifération Si nous considérons les trois décennies passées depuis la découverte d’EpCAM en 1979, il est surprenant de réaliser que la grande majorité du travail scientifique a été consacrée à élucider la localisation, le degré d’expression, ainsi que la valeur pronostique de la molécule EpCAM [2,
4]. Rares sont les résultats concernant la fonction d’EpCAM dans les cellules épithéliales normales et dans les carcinomes, alors même qu’EpCAM est l’un des antigènes de tumeurs les plus fréquemment surexprimés. Les premiers éléments furent publiés par le groupe de Sergey Litvinov et dévoilèrent la fonction d’adhésion d’EpCAM dans les cellules épithéliales, d’où son nom [
5,
6]. Mais la restriction de la fonction d’EpCAM à ce seul rôle dans l’adhésion était difficilement compatible avec la fréquente surexpression de la molécule dans les tumeurs d’origine épithéliale et dans les cellules souches embryonnaires et adultes. En 2004, Osta et al. [
7] et notre groupe [
8] décrivirent EpCAM comme un intermédiaire dans la transduction du signal de la membrane au noyau. Une surexpression d’EpCAM dans les cellules épithéliales humaines ainsi que dans des fibroblastes de souris induit une prolifération supérieure à celle des cellules recevant un vecteur contrôle. La surexpression d’EpCAM stimule également la transcription du gène c-myc, luimême un régulateur du cycle cellulaire [8]. Réciproquement, une diminution de l’expression d’EpCAM dans les cellules de carcinomes, grâce à l’utilisation d’ADN antisens ou bien d’oligonucléotides inhibiteurs (silencing RNA), entraîne une décroissance de la prolifération des cellules cibles [7, 8]. Ces résultats furent les premiers à témoigner d’une fonction de la protéine EpCAM dans la régulation de la prolifération et du cycle cellulaires. |
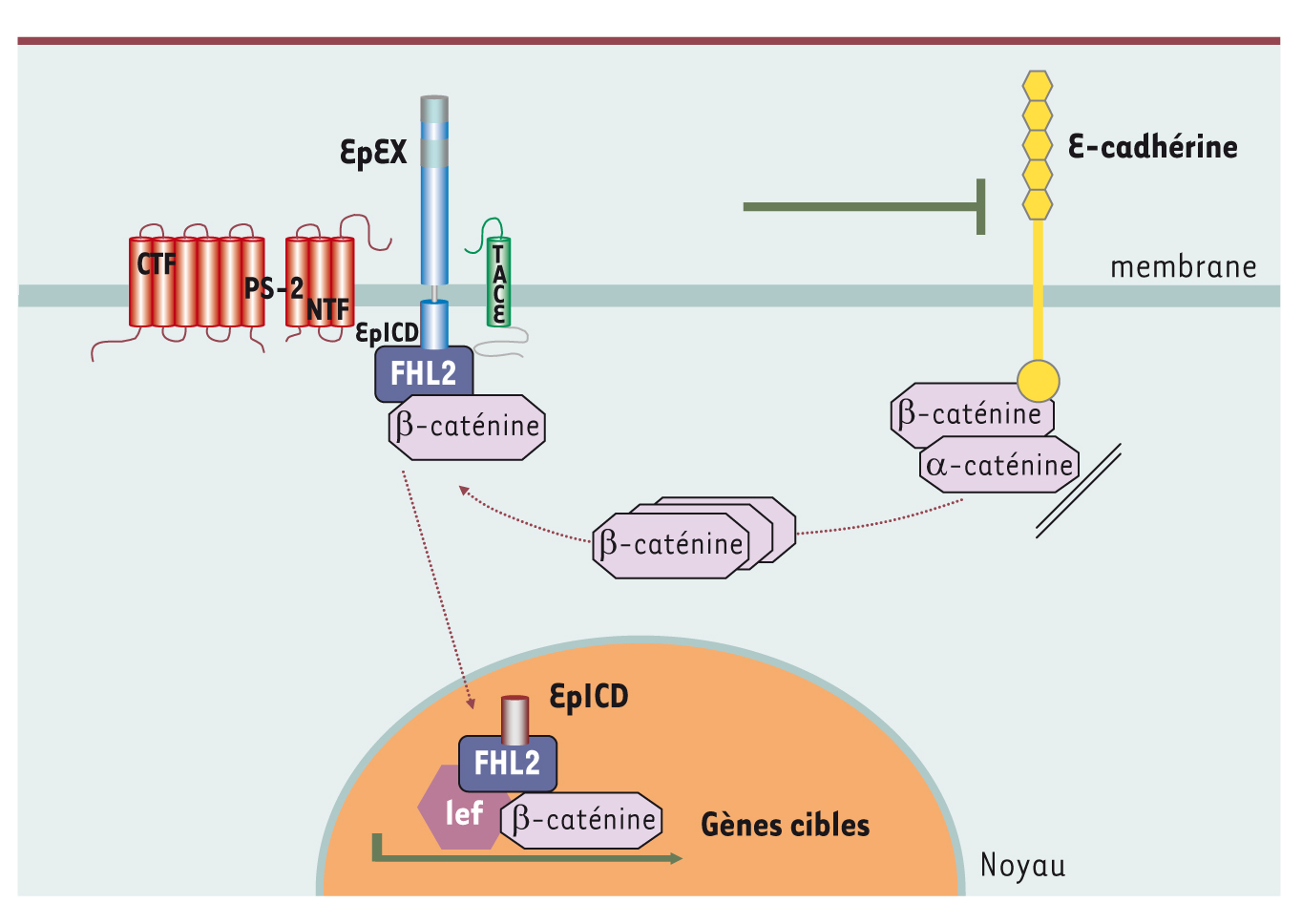
Le fin mot de l’histoire : clivage protéolytique membranaire d’EpCAM et libération d’un domaine intracytoplasmique actif À la suite de ces découvertes, cinq années de recherches intenses furent nécessaires pour élucider les mécanismes à la base de la transmission du signal mitogène relayé par EpCAM (Figure 1). EpCAM est clivée à la membrane par deux protéases, TACE (TNF-alpha converting enzyme) et un complexe γ-sécrétase contenant la préséniline-2, ce qui libère sa partie intracytoplasmique, désormais nommée EpICD (EpCAM intracellular domain). Celle-ci forme un complexe avec FHL2 (four and a half LIM domains 2) et la β-caténine, qui se localise dans le noyau, se lie aux facteurs de transcription de la famille TCF/Lef, s’attache à l’ADN sur des séquences spécifiques de Lef-1 et finalement active la transcription de différents gènes dont c-myc [
9]. Il est important de noter que EpICD tout seul est apte à induire la transcription de gènes, l’excès de prolifération cellulaire, et la formation de tumeurs lorsque les cellules sont greffées dans un modèle de souris immunodéficientes (SCID, severe combined immunodeficient). De plus, les inhibiteurs de TACE et des présénilines bloquent le clivage d’EpCAM et de ce fait empêchent la fonction proliférative de cet oncogène ; cela pourrait représenter une nouvelle option thérapeutique [9]. Dorénavant, EpCAM doit être reconnu comme un membre de la famille des récepteurs oncogéniques clivés, et dont la partie intracellulaire dicte la transcription de gènes dans le noyau (ce qui est le cas du récepteur Notch1 par exemple [
13]). Ces observations firent décrire EpCAM comme « another surface-to-nucleus missile » [
10]. Une nouvelle forme de stratégie thérapeutique dirigée contre les cellules cancérigènes exprimant la molécule EpCAM peut désormais être envisagée. L’utilisation de molécules inhibitrices de TACE et des présénilines, combinées avec des anticorps thérapeutiques dirigés contre EpCAM, si ces molécules s’avèrent efficaces in vivo chez la souris, devrait pouvoir être couronnée de succès.  | Figure 1.
Mécanisme d’action de EpCAM. La molécule transmembranaire EpCAM (associant EpEx, domaine extracellulaire, et EpICD, domaine intracytoplasmique) est clivée par les deux protéases TACE et Préséniline (PS-2). Cette protéolyse libère le domaine intracytoplasmique qui s’associe à FHL2 et la β-caténine, le complexe migrant dans le noyau où il va se fixer sur son gène cible, TCF/lef-1, et l’activer, induisant à son tour l’expression de ses gènes cibles. Dans les cellules, EpCAM module l’adhésion intercellulaire contrôlée par les cadhérines, et lorsqu’elle est surexprimée, elle inhibe les liaisons homophiliques entre cellules impliquant la cadhérine E. |
En résumé, EpCAM est une protéine oncogénique exprimée par une multitude de tumeurs. EpCAM est impliquée dans la régulation du cycle cellulaire via sa partie intracellulaire clivée à la membrane puis libérée dans le noyau où elle induit la transcription de gènes. Le fait qu’EpCAM est souvent exprimée sur les cellules souches cancéreuses ne fait qu’augmenter l’intérêt et la nécessité de comprendre la biologie moléculaire de cette protéine qui apparaît comme une excellente cible thérapeutique [
11,
12]. |
1. Herlyn D, Herlyn M, Steplewski Z, Koprowski H. Monoclonal antibodies in cell-mediated cytotoxicity against human melanoma and colorectal carcinoma. Eur J Immunol 1979; 9 : 657–9. 2. Baeuerle PA, Gires O. EpCAM (CD326) finding its role in cancer. Br J Cancer 2007; 96 : 417–23. 3. Balzar M, Briaire-de Bruijn IH, Rees-Bakker HA, et al. Epidermal growth factor-like repeats mediate lateral and reciprocal interactions of Ep-CAM molecules in homophilic adhesions. Mol Cell Biol 2001; 21 : 2570–80. 4. Balzar M, Winter MJ, de Boer CJ, Litvinov SV. The biology of the 17-1A antigen (Ep-CAM). J Mol Med 1999; 77 : 699–712. 5. Litvinov SV, Bakker HA, Gourevitch MM, Velders MP, Warnaar SO. Evidence for a role of the epithelial glycoprotein 40 (Ep-CAM) in epithelial cell-cell 8. adhesion. Cell Adhes Commun 2001; 2 : 417–28. 6. Litvinov SV, Balzar M, Winter MJ, et al. Epithelial cell adhesion molecule (Ep-CAM) modulates cell-cell interactions mediated by classic cadherins. J Cell Biol 1997; 139 : 1337–48. 7. Osta WA, Chen Y, Mikhitarian K, et al. EpCAM is overexpressed in breast cancer and is a potential target for breast cancer gene therapy. Cancer Res 2004; 64 : 5818–24. 8. Munz M, Kieu C, Mack B, et al. The carcinoma-associated antigen EpCAM upregulates c-myc and induces cell proliferation. Oncogene 2004; 23 : 5748–58. 9. Maetzel D, Denzel S, Mack B, et al. Nuclear signalling by tumour-associated antigen EpCAM. Nat Cell Biol 2009; 11 : 162–71. 10. Carpenter G, Red Brewer M. EpCAM: another surface-to-nucleus missile. Cancer Cell 2009; 15 : 165–6. 11. Gires O, Klein CA, Baeuerle PA. On the abundance of EpCAM on cancer stem cells. Nat Rev Cancer 2009; 9 : 143 ; 143. 12. Visvader JE, Lindeman GJ. Cancer stem cells in solid tumours: accumulating evidence and unresolved questions. Nat Rev Cancer 2008; 8 : 755–68. 13. Kastner P, Chan S. La voie Notch au centre du mécanisme de leucémogenèse dans un modèle murin de leucémies T. Med Sci (Paris) 2006; 22 : 708–10. |