| |
| Med Sci (Paris). 2009 May; 25(5): 445–446. Published online 2009 May 15. doi: 10.1051/medsci/2009255445.La sérotonine d’origine intestinale Une nouvelle hormone régulant le remodelage osseux Franck Oury and Gérard Karsenty* Columbia University, Department of Genetics and Development, HHSC 701 W 168th Street, New York, NY 10032, États-Unis MeSH keywords: Animaux, Densité osseuse, Résorption osseuse, Enfant, Duodénum, Cellules entérochromaffines, Humains, Protéines apparentées au récepteur LDL, Protéine-5 apparentée au récepteur des LDL, Souris, Souris knockout, Ostéoblastes, Ostéoporose, Ovariectomie, Sérotonine, Tryptophane 5-monooxygenase |
Le tissu osseux est en perpétuel renouvellement grâce à un processus complexe et dynamique appelé « le remodelage osseux » [
1,
2]. Cette fonction physiologique, indispensable à la survie des vertébrés, permet un contrôle de l’homéostasie calcique, mais aussi et surtout une formation osseuse adaptée à la croissance et au maintien de l’intégrité osseuse. Le remodelage osseux repose sur un équilibre précis entre deux mécanismes cellulaires, la résorption et la formation osseuses [
3]. La résorption osseuse est le fait des ostéoclastes qui détruisent la matrice osseuse minéralisée préexistante [
6]. La formation osseuse repose sur un autre type cellulaire : les ostéoblastes qui forment la nouvelle matrice collagénique. Le contrôle de la balance entre ces deux mécanismes physiologiques fait intervenir un grand nombre de molécules, qui peuvent agir soit localement (par un contrôle autocrine et paracrine) soit de manière systémique (par un contrôle hormonal endocrine). Il y a une dizaine d’années, une nouvelle voie de régulation de la masse osseuse définie par une molécule LRP5 a été découverte. Chez l’homme et la souris, LRP5 (LDL receptor-related protein 5) est présente à la surface de très nombreuses cellules (y compris les ostéoblastes) et affecte le remodelage osseux en favorisant la prolifération et l’activité des ostéoblastes [
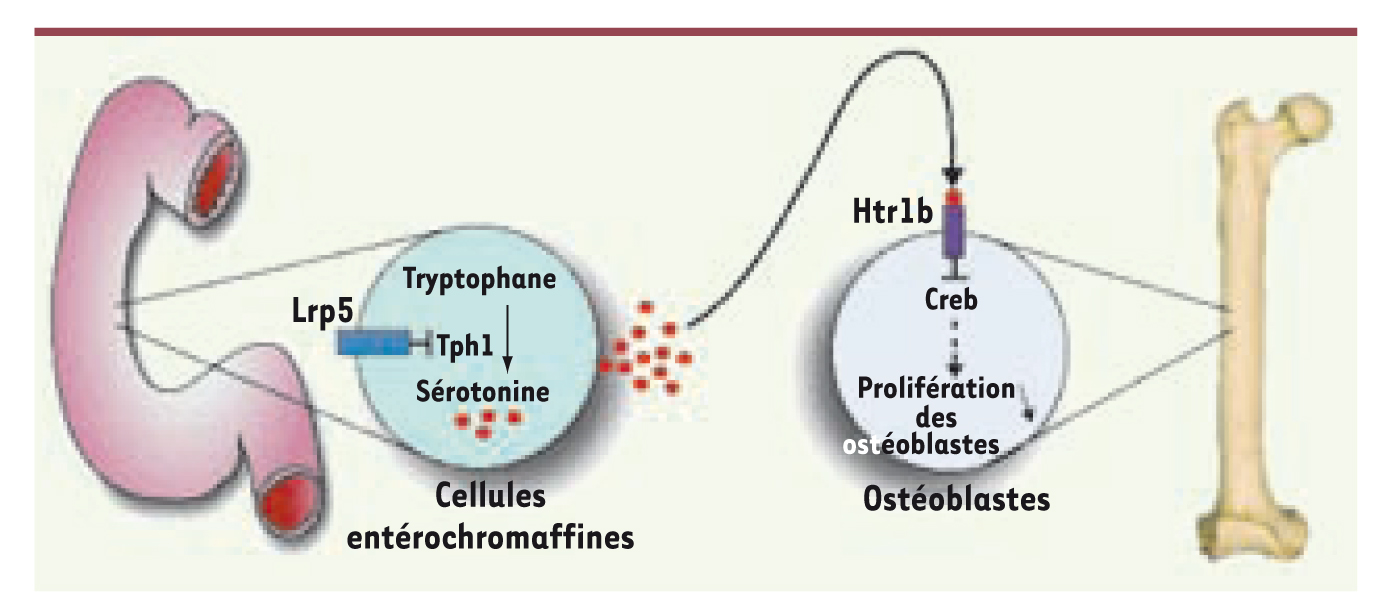
4]. Cependant, les mécanismes cellulaires et moléculaires en aval de cette molécule, tout comme son potentiel ligand, restent inconnus. Une récente étude réalisée par l’équipe de G. Karsenty a démontré que LRP5 n’agit pas de manière locale sur l’os mais qu’elle régule la masse osseuse en déterminant la synthèse d’une nouvelle hormone du remodelage osseux : la sérotonine. Cette hormone relarguée par le duodénum s’avère être un puissant inhibiteur de la prolifération des ostéoblastes après s’être liée à son récepteur Htr1b (Figure 1).  | Figure 1.
Représentation schématique du contrôle de la masse osseuse par le gène LRP5. Le récepteur LRP5 inhibe l’expression de Tph1, enzyme limitante de la biosynthèse de sérotonine dans le duodénum par hydroxylation du tryptophane. La sérotonine est véhiculée dans le sang et interagit avec son récepteur Htr1b localisé au niveau des ostéoblastes. L’activation du récepteur Htr1b inhibe l’action de CREB, un facteur de transcription majeur favorisant la prolifération des ostéoblastes. |
|
Un même gène, deux syndromes osseux opposés LRP5 est un membre de la famille des récepteurs des lipoprotéines LDL. L’intérêt de cette molécule provient de ce qu’elle est mutée dans deux maladies humaines sévères. Une mutation inactivatrice du gène LRP5 provoque une maladie de l’enfant caractérisée par une diminution très importante de la masse osseuse et une perte de la fonction visuelle : le syndrome d’ostéoporose avec pseudogliome (OPPG). À l’inverse, une mutation activatrice de LRP5 entraîne une augmentation de la masse osseuse chez les patients affectés qui ne développent donc jamais d’ostéoporose. Le fait que ces deux maladies génétiques de nature strictement opposée relèvent d’une mutation dans le même gène souligne évidemment l’importance de la voie de régulation contrôlée par LRP5. La fonction de LRP5 dans le remodelage osseux a été vérifiée dans un modèle murin. Les souris chez lesquelles le gène LRP5 a été inactivé présentent un défaut sévère de prolifération des ostéoblastes conduisant à une faible masse osseuse. |
LRP5 inhibe la synthèse de la sérotonine dans l’intestin Afin d’identifier la cascade moléculaire par laquelle LRP5 régule la prolifération des ostéoblastes, une analyse du profil d’expression génique des souris LRP5−/−
a été réalisée. De façon totalement inattendue, cette étude a montré que Tph1, le gène codant pour une enzyme indispensable à la biosynthèse de la sérotonine duodénale, est le gène le plus fortement surexprimé chez ces souris ayant un déficit en LRP5. La sérotonine est synthétisée à partir d’un acide aminé, le tryptophane, dans deux sites distincts : le cerveau postérieur, où elle a obtenu ses titres de noblesse, mais aussi le duodénum. Dans le cerveau, la sérotonine est un neurotransmetteur impliqué dans de très nombreuses fonctions cognitives. Cette forme de sérotonine est synthétisée grâce à l’action de l’enzyme tryptophane hydroxylase 2 (Tph2), exprimée uniquement dans les neurones du Raphé. La biosynthèse de la sérotonine duodénale, cette dernière représentant 95 % de la quantité totale de sérotonine dans l’organisme, est le fait de l’action de l’enzyme tryptophane hydroxylase 1 (Tph1), dont l’expression est essentiellement confinée aux cellules entérochromaffines. Entre les deux formes de sérotonine, il existe une barrière totalement hermétique (la barrière hémato-méningée) de sorte que la sérotonine produite en périphérie ne peut entrer dans le cerveau et vice-versa. Chez les souris LRP5−/−
, seule Tph1 est surexprimée. La surexpression de ce gène chez des souris entraîne de fait une augmentation massive de la concentration de sérotonine présente dans le sang, semblable à celle observée chez les souris LRP5
−/− et chez les patients souffrant d’une OPPG. À l’inverse, les patients atteints d’une mutation activatrice de LRP5 et dont la masse osseuse est élevée présentent quant à eux une diminution de plus de 50 % du taux circulant de sérotonine. |
LRP5 régule la masse osseuse via son expression dans le duodénum Afin d’identifier le site d’action de LRP5, le laboratoire du Dr Karsenty a généré deux souris différentes porteuses d’une mutation conditionnelle pour ce gène. La première permet d’inactiver spécifiquement ce gène dans les cellules du duodénum, la seconde exprime dans ces mêmes cellules la mutation activatrice de LRP5. Les phénotypes observés chez ces deux souris reproduisent les défauts présents dans les deux types de maladies humaines précédemment décrites, à l’exception de la cécité chez les patients affectés d’OPPG. Les souris chez lesquelles LRP5 est inactivé ont une augmentation de la concentration de sérotonine circulante et une masse osseuse basse. À l’inverse, la concentration de sérotonine circulante est basse chez les souris exprimant la mutation activatrice présentent et leur masse osseuse est élevée, conséquence de l’augmentation de la prolifération des ostéoblastes. L’ensemble de ces données démontre que chez la souris comme chez l’homme, LRP5 régule l’expression de Tph1 et donc la synthèse de la sérotonine circulante ainsi que la prolifération des ostéoblastes via son expression dans les cellules du duodénum. Le mécanisme par lequel LRP5 affecte la vision est quant à lui différent [
5]. |
La sérotonine synthétisée dans l’intestin régule la formation osseuse Le défaut de prolifération des ostéoblastes observé chez les souris LRP5−/−
est directement lié à la sérotonine. En effet, la mise en culture ex vivo des ostéoblastes en présence de sérotonine diminue de manière drastique leur propension à proliférer. À l’opposé, une alimentation faible en tryptophane normalise le phénotype osseux des souris LRP5−/−
. Comme toute hormone, la sérotonine agit via ses récepteurs localisés sur ses différentes cellules cibles. Ils sont au nombre de 14, mais seulement 3 (Htr2a, Htr2b et Htr1b) sont exprimés dans les ostéoblastes. L’analyse des souris chez lesquelles chacun de ces trois récepteurs a été inactivé spécifiquement dans les ostéoblastes a montré que le principal récepteur impliqué dans la prolifération des ostéoblastes est Htr1b. Ce récepteur inhibe la voie de signalisation contrôlée par CREB (cyclic AMP responding element binding protein), un facteur transcriptionnel important dans le contrôle de la prolifération des ostéoblastes. |
La diminution de la synthèse de sérotonine dans l’intestin protége les souris de l’ostéoporose La régulation de la masse osseuse par la sérotonine a un important intérêt thérapeutique. En effet, les souris mutantes présentant une inactivation sélective du gène Tph1 dans les cellules de l’intestin sont protégées de la perte osseuse induite par l’ovariectomie. Cela démontre non seulement que la sérotonine est une hormone inhibant la formation osseuse, mais aussi et surtout que la manipulation pharmacologique de cette voie peut être bénéfique dans le traitement de l’ostéoporose de la femme ménopausée. En résumé, cette étude a mis en évidence une nouvelle et importante voie endocrine contrôlant le remodelage osseux. Au-delà de la biologie osseuse, elle met en évidence un important aspect de la physiologie intégrative démontrant un lien direct entre l’intestin qui synthétise la sérotonine et la régulation de la masse osseuse. Enfin, d’un point de vue clinique, ce nouvel axe endocrinien met en évidence de nouvelle cibles thérapeutiques potentielles pour les maladies dégénératives touchant le processus du remodelage osseux, comme l’ostéoporose. |
1. Rodan GA, Martin TJ. Therapeutic approaches to bone diseases. Science 2000; 289 : 1508–14. 2. Karsenty G. Convergence between bone and energy homeostases: leptin regulation of bone mass. Cell Metab 2006; 4 : 341–8. 3. Clément K, Karsenty G.Contrôle neural du remodelage osseux : le rôle crucial de la leptine. Med Sci (Paris) 2005; 21 : 681–2. 4. Yadav VK, Ryu JH, Suda N, et al. LRP5 controls bone formation by inhibiting serotonin synthesis in the duodenum. Cell 2008; 135 : 825–37. 5. Lobov IB, Roa S, Carroll TJ, et al. WNT7b mediates macrophage-induced programmed cell death in patterning of the vasculature. Cell 2005; 437 : 417–21. 6. Gallois A, Mazzoranan M, Vacher J, Jurdic P. Ostéo-immunologie : une vision globale et intégrée du tissu squelettique et du système immunitaire : implications pour la recherche en rhumatologie. Med Sci (Paris) 2009; 25 : 259–66. |