| |
| Med Sci (Paris). 2009 April; 25(4): 405–411. Published online 2009 April 15. doi: 10.1051/medsci/2009254405.Arche de Noé immunologique Le système immunitaire des poissons téléostéens Jean-Pierre Levraud1* and Pierre Boudinot2 1Unité Macrophages et Développement de l’Immunité, Institut Pasteur, CNRS URA2578, 25, rue du Docteur Roux, 75015 Paris, France 2Unité Virologie et Immunologie Moléculaires, INRA, Domaine de Vilvert, Jouy-en-Josas, France |
L’étude du système immunitaire des poissons possède une longue histoire, motivée par son intérêt économique lorsqu’elle s’applique à l’aquaculture et par l’éclairage qu’elle apporte sur l’évolution de nos mécanismes de défenses. Nous ferons dans cette revue un point sur les connaissances actuelles sur l’immunité des poissons et sur les similitudes et divergences de ce processus chez les poissons et les mammifères. Nous nous limiterons au groupe des poissons « modernes », les téléostéens, qui inclut la presque totalité des poissons osseux. |
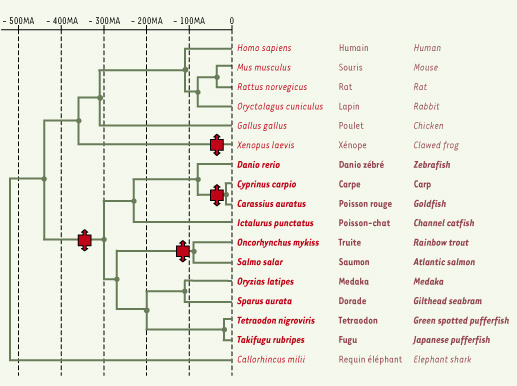
Relations phylogénétiques Nos connaissances de l’immunité des poissons proviennent de l’étude d’espèces assez diverses. Un certain nombre fait l’objet d’études immunologiques depuis plusieurs décennies, dont la truite et le saumon, la dorade, la carpe, le poisson-chat, le poisson rouge… (les noms scientifiques correspondants ainsi que les dénominations anglo-saxonnes sont listés sur la Figure 1). Plus récemment, deux espèces « modèles » en biologie du développement se sont ajoutées à cette liste : le danio zébré et le medaka. Par ailleurs, le séquençage du génome d’autres poissons comme le tétraodon, le fugu ou l’épinoche a contribué à l’identification de gènes du système immunitaire. Mais il serait imprudent de mettre tous ces poissons dans un même filet, en généralisant sans précaution les connaissances immunologiques acquises à partir de l’étude d’un seul d’entre eux. En effet, la classe des téléostéens, qui regroupe à elle seule la moitié des espèces de vertébrés décrites, est hautement diversifiée et au moins aussi ancienne que celle des mammifères. Une truite et une carpe sont bien plus éloignées, en termes de temps évolutif, que ne le sont un être humain et une souris. De plus, l’apparence morphologique est souvent mal corrélée avec les relations phylogénétiques : ainsi, un observateur naïf comparant un danio, un medaka et un fugu ne risque pas de deviner leur relation de parenté. La Figure 1 résume le consensus actuel sur les relations phylogénétiques de quelques espèces considérées dans cette revue.  | Figure 1.
Relations phylogénétiques et distances évolutives des principales espèces de poissons téléostéens considérées ici, en relation avec les autres groupes de vertébrés. Les téléostéens sont indiqués en gras. Les temps de divergence ont été tirés de www.timetree.net pour les tétrapodes, et représentent une moyenne des valeurs de la littérature pour les téléostéens, souvent assez divergentes (le lecteur intéressé par la question pourra se référer aux articles suivants: PMID: 9582070, 12832638, 15575976, 16476526, 16752215, 16919973, 17476768). Le carré avec double flèche représente un événement de duplication du génome (ref: PMID: 12832638, 14757817, 19014685). |
|
Particularités anatomiques L’anatomie du système lymphoïde des téléostéens présente quelques différences notables avec celle des mammifères (revue dans [
1]) (Figure 2). Les poissons ne possèdent pas de moelle osseuse ; c’est dans les reins, entre les tubules, que se loge le tissu hématopoïétique des adultes. Les poissons possèdent deux reins non symétriques : un rein pronéphrique antérieur situé derrière la tête, et un rein métanéphrique moyen accolé à la face ventrale de la colonne vertébrale. La présence de cellules souches hématopoïétiques définitives dans les deux reins (et leur absence dans la rate) a été démontrée sans ambiguïté par des expériences de reconstitution à long terme [
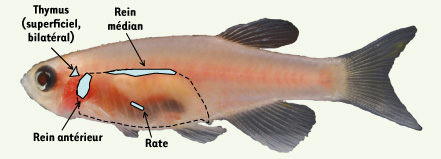
2]. Comme la moelle osseuse des mammifères, les reins des poissons produisent tous les types de leucocytes, à l’exception des lymphocytes T, produits dans le thymus. Toutefois, à l’inverse de ce qui se produit chez les tétrapodes, les ébauches bilatérales formées à partir du 3è arc branchial ne convergent pas et les adultes conservent donc deux thymus situés sur les côtés de la tête, sous la partie haute des opercules.  | Figure 2.
Emplacement des principaux organes lymphoïdes d’un téléostéen. La courbe en pointillé délimite la cavité abdominale qui renferme également les gonades, l’intestin, le foie, le pancréas, la vessie natatoire et le coeur. La photo représente un danio zébré mutant, dépourvu de pigments noirs et argentés. |
Le système lymphoïde secondaire est plus sommaire que celui des mammifères. Les poissons possèdent bien un système élaboré de canaux lymphatiques drainant les tissus superficiels [
3], mais ils n’ont pas de ganglions lymphatiques. Ils possèdent une rate, d’organisation interne simple, qui filtre le sang et dans laquelle se déroulent les différentes étapes des réponses immunitaires contre les antigènes circulants. Les reins jouent également le rôle d’organes lymphoïdes secondaires ; avec la rate, ce sont les sites principaux de production d’anticorps circulants et de localisation de lymphocytes T spécifiques. Ces organes ne contiennent pas de centres germinatifs (sites de prolifération lymphoïde B chez les mammifères, où se déroulent la commutation isotypique et l’hypermutation somatique des Ig). Les tissus lymphoïdes associés aux muqueuses sont bien développés mais moins organisés que ceux des mammifères ; ainsi, il n’y a pas l’équivalent des plaques de Peyer intestinales chez les poissons. Il faut également noter l’abondance des leucocytes présents dans l’épithélium intestinal, la peau et les branchies. Le compartiment immunitaire muqueux des poissons est souvent présenté comme indépendant du compartiment central, mais ce point reste controversé [
4]. Le mode de vie aquatique des poissons impose bien sûr certaines spécialisations anatomiques, concernant notamment la peau, les branchies, et les organes sensoriels. La forte exposition de ces organes au milieu ambiant et à ses nombreux microbes implique des barrières renforcées, au premier rang desquelles on peut citer l’abondante production par la peau des poissons d’un mucus riche en molécules antimicrobiennes [
5]. |
Populations de leucocytes Les grandes catégories de cellules immunitaires des poissons sont proches de celles que l’on décrit chez les mammifères, au niveau morphologique comme fonctionnel (revue dans [
6]). On trouve l’équivalent des monocytes/macrophages, des polynucléaires neutrophiles, des polynucléaires éosinophiles, des mastocytes, des lymphocytes T, des lymphocytes B, des cellules natural killer (NK). La présence de cellules dendritiques spécialisées dans la présentation de l’antigène reste encore à établir, de même que celle de cellules spécialisées dans la sécrétion d’interféron (IFN). Les lymphocytes T et B sont présents chez tous les vertébrés (à l’exception des agnathes) [
38]. La présence de ces lymphocytes va de pair avec l’apparition des enzymes RAG1 (recombination activating gene) et RAG2 [
7], indispensables à la recombinaison des gènes V(D)J chez les mammifères. L’absence de réarrangement des gènes du TCR (T cell receptor) ou de ceux codant les immunoglobulines (Ig) chez des danios zébrés dont le gène rag1 est muté a d’ailleurs été démontrée récemment [
8]. Ces danios mutants s’élèvent relativement aisément en animalerie de laboratoire, corroborant l’opinion commune que l’immunité adaptative joue un rôle moins important chez les poissons que chez les mammifères. Le bras inné de l’immunité des poissons est de plus beaucoup moins sensible aux écarts de température chez ces animaux à sang froid. Les sous-populations de lymphocytes T restent mal caractérisées, mais une distinction entre cellules « auxiliaires » et « cytotoxiques » est présumée, en accord avec l’existence de gènes codant pour des molécules du CMH (complexe majeur d’histocompatibilité) de classe I et II, et de gènes correspondant à ceux qui codent pour CD4 et CD8 (voir ci-après). Par ailleurs, la présence de 4 types de chaînes de TCR implique la présence de lymphocytes Tαβ et Tγδ. Il existe au moins deux sous-populations de lymphocytes B : l’une majoritaire, coexprimant IgM et IgD, et l’autre, une minoritaire, exprimant un autre isotype, désigné comme IgT ou IgZ suivant les espèces [
9,
10]. La commutation isotypique (passage de la synthèse d’une Ig d’un isotype à un autre, sans affecter la spécificité de reconnaissance) n’a jamais été observée chez les poissons. Bien que les gènes d’Ig subissent une hypermutation somatique1, la maturation d’affinité des Ig reste très modeste, et semble surtout due à la sélection progressive des clones du répertoire initial ayant une meilleure affinité [
11] ; ces mutations joueraient plutôt un rôle de diversification du répertoire initial [
12]. Une autre propriété remarquable des lymphocytes B des poissons est leur capacité de phagocyter et dégrader des bactéries [
13]. Le macrophage est le type de cellule myéloïde le plus ancien et sa présence chez les téléostéens n’est pas une surprise. Ce sont les principaux phagocytes des poissons, jouant un rôle dans l’élimination des débris cellulaires aussi bien que des pathogènes ; ces deux rôles sont acquis de façon extrêmement précoce au cours du développement embryonnaire [
14]. Chez l’adulte, ces cellules dérivent de monocytes circulants. Les poissons possèdent aussi plusieurs types de granulocytes, avec, au moins, l’équivalent des neutrophiles et des éosinophiles. Ce sont également des phagocytes efficaces, qui s’accumulent rapidement aux sites d’inflammation. Le comportement de certains granulocytes est cependant particulier : une sous-population tissulaire circule en permanence entre les cellules de la plupart des organes en l’absence d’inflammation [
15]. On peut présumer qu’ils remplissent une partie des rôles dévolus aux macrophages résidents ; cela s’accorderait bien avec l’expression de molécules du CMH de classe II par des granulocytes acidophiles [
16]. Les poissons possèdent également l’équivalent des lymphocytes NK ; leurs relations exactes avec les cellules qualifiées de NCC (non-specific cytotoxic cells) ne sont pas encore parfaitement claires. De nombreux récepteurs potentiels ont été identifiés ; la superfamille des NITR (novel immune-type receptors) en constitue l’exemple le plus convaincant [
17]. |
Gènes du système immunitaire L’explosion récente des données de séquençage a permis l’identification chez les poissons de nombreux homologues de gènes impliqués dans l’immunité des mammifères, mais deux points doivent être gardés à l’esprit. Premièrement, la plupart de ces séquences évoluent beaucoup plus rapidement que les autres gènes de l’organisme, et les relations sont donc souvent entachées d’incertitude. Deuxièmement, le nombre de gènes est souvent différent, en particulier du fait de la duplication du génome survenue à la base de l’arbre des téléostéens [
18] et de nouveau, plus récemment, dans certaines branches (Figure 1). Cela explique la présence fréquente chez un téléostéen de plusieurs paralogues d’un gène humain - ce qui n’est pas une règle pour autant, les duplications étant suivies de pertes de gènes. CMH Comme indiqué plus haut, les téléostéens possèdent des molécules classiques du CMH de classe I et de classe II, polymorphes. Contrairement à ce qui est connu chez les tétrapodes ou les poissons cartilagineux, les loci de classe I et de classe II sont situés sur des chromosomes différents et il serait donc plus juste de nommer ces récepteurs « protéines majeures d’histocompatibilité » (MH) plutôt que CMH. Les poissons possèdent de plus de nombreuses protéines MH non classiques, dont la fonction est inconnue, mais dont certaines sont polymorphes. Ce polymorphisme concerne d’autres gènes impliqués dans la présentation de l’antigène, comme le transporteur de peptides TAP2 ; le mécanisme de la présentation antigénique chez les téléostéens pourrait offrir une complexité inattendue [
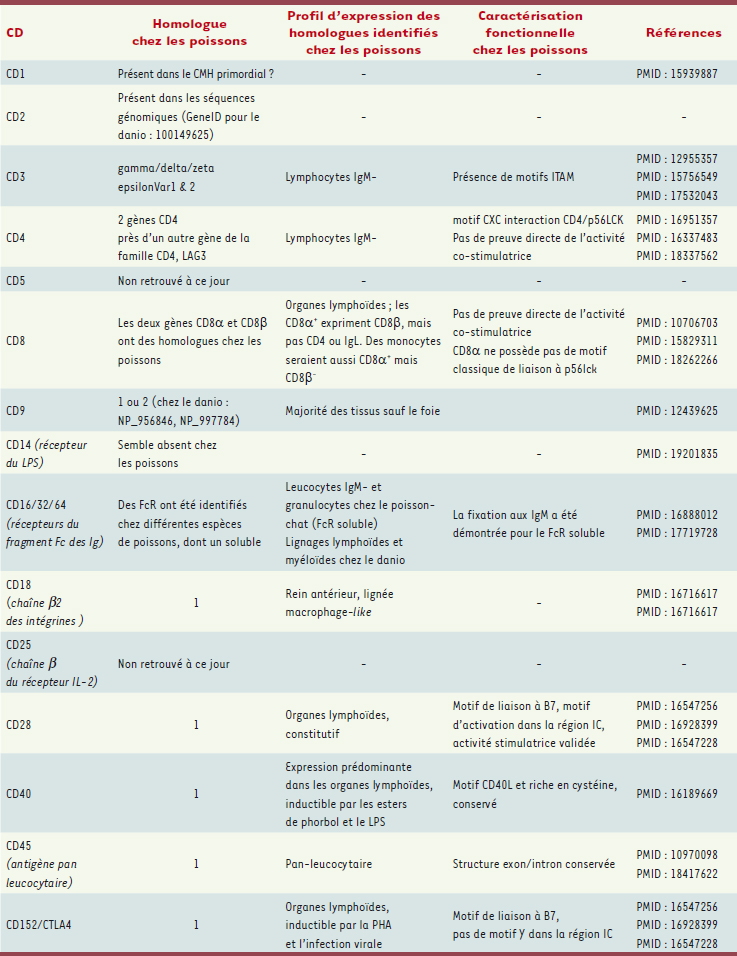
19]. Complément Le système du complément des poissons est particulièrement développé. L’ensemble des facteurs sont retrouvés, très féquemment en tant que paralogues multiples, avec des variations structurales significatives et des profils d’expression divergents [
20]. Cela suggère que le répertoire des pathogènes reconnus par le complément des poissons est plus large que celui des mammifères. Marqueurs de surface Les marqueurs de surface qui régissent les interactions entre cellules et servent de récepteurs pour de multiples composés sont des acteurs clés d’un système immunitaire. Les CD (pour cluster of differentiation) définis chez l’homme et la souris regroupent les plus importants de ces marqueurs. De nombreux CD existent aussi chez les poissons (Tableau I), mais souvent avec des caractéristiques assez différentes qui suggèrent que leurs fonctions ne sont pas strictement équivalentes. Ainsi, deux gènes homologues du cd4 des mammifères sont généralement présents chez les téléostéens. Les différences peuvent aussi concerner les motifs clés des récepteurs : un gène cd8α identifié chez la truite ne comporte pas de site classique d’attachement de la kinase p56lck. De même, les régions intracellulaires des molécules CD28 et CTLA4 des poissons ne présentent pas tous les motifs de signalisation de leurs homologues mammaliens. Ces protéines constituent sans doute néanmoins d’excellents marqueurs de populations cellulaires, mais peu d’anticorps monoclonaux sont disponibles à ce jour.  | Tableau I.
Ce que l’on connaît des homologues d’une sélection de protéines classées en CD (cluster de différenciation) chez les poissons. PHA phytohémagglutinine ; LPS : lipopolysaccharide ; LAG3 : lymphocyte activation gene-3. |
Parmi les récepteurs de surface impliqués dans la reconnaissance innée des pathogènes, les TLR (toll-like receptors) jouent un rôle essentiel. Les différentes classes de TLR sont retrouvées chez les poissons et leur fonction est probablement très conservée [
21] ; quelques TLR semblent cependant spécifiques des poissons [
22]. Cytokines Toutes les familles de cytokines sont présentes chez les téléostéens. Les séquences primaires sont souvent peu conservées, mais la conservation de l’organisation exon-intron, ainsi que d’éventuelles synténies, renforcent les prédictions [
23]. Il y a cependant peu de données fonctionnelles. Parmi les cytokines hélicales de classe I, on trouve chez les poissons des homologues des IL (interleukines)−2,−3, −6, −11 (deux membres chez plusieurs poissons), −12 (deux IL12 p35 ont été retrouvées chez le tétraodon, et au moins trois IL-12 p40 chez la carpe), −15, −21, et du G-CSF (granulocyte colony-stimulating factor) [
24]. La famille des cytokines hélicales de classe II comprend les IFN (discutés ci-après), mais aussi les IL-10, −19, −20, −22, −24 et −26 ; un orthologue clair de l’IL-10 est présent chez tous les poissons, ainsi que plusieurs autres membres de la famille dont l’orthologie reste à clarifier [
25]. Les principaux membres de la famille de l’IL-1 (IL-1α, −1β, −18) existent également [
26]. Une très grande diversité de chimiokines a été identifiée [
27]. Enfin, plusieurs homologues du TNFα (tumor necrosis factor) et du TGFβ (transforming growth factor) sont également présents. Des homologues des récepteurs (dont l’orthologie est la plupart de temps difficile à établir, en l’absence de test fonctionnel) et des molécules de signalisation en aval de ceux-ci sont aussi retrouvés [24, 25]. Interférons et réponse antivirale Les maladies virales ont un impact important en aquaculture et ont motivé très tôt l’étude des mécanismes de défense antivirale chez les poissons d’élevage. L’induction d’un médiateur présentant les propriétés d’un IFN est connue chez la truite depuis les années 1970 [
28] mais les premières séquences d’IFN viro-induites ne furent publiées qu’en 2003 [
29]. La plupart des poissons possèdent plusieurs gènes d’IFN (jusqu’à onze chez le saumon [
30]), rappelant la diversité des IFN-α des mammifères. Ces interférons viro-induits possèdent l’activité typique des IFN de type I des mammifères, des profils d’induction semblables et une certaine similitude de séquence. Cependant, alors que les IFN de type I des mammifères sont codés par un seul exon, les gènes codant ces IFN de poisson possèdent 5 exons. Cela, et la structure de leur récepteur, identifié fonctionnellement [
31], les rapprochent des IFN de type III. Les affinités des IFN de type II sont plus évidentes. Un orthologue clair de l’IFN-γ des mammifères a été identifié d’abord chez le fugu [
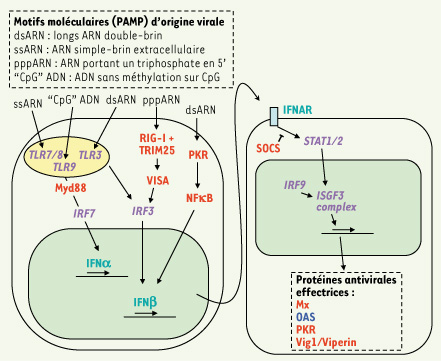
32] puis chez d’autres espèces. Avant même l’identification des IFN de poissons, différentes approches avaient établi que le système de défense antiviral inné était conservé et actif chez les poissons. L’état actuel de nos connaissances est schématisé sur la Figure 3 (modifiée d’après [
33]). Le premier gène Mx a été identifié dès 1989 chez la truite [
34], bientôt suivi par deux autres membres ; toutefois, leur activité antivirale n’est pas aussi significative qu’elle l’est chez les mammifères. Des séquences ISRE (IFN stimulating response element) typiques des promoteurs des gènes induits par l’IFN chez les mammifères sont retrouvées aussi chez les poissons [
35]. Différents IRF ont été identifiés, de même que la protéine kinase R (PKR), mais pas l’oligoadénylate 2’-5’ synthétase (OAS) [
39]. La recherche systématique de gènes induits par les rhabdovirus chez la truite a également conduit à l’identification de nouveaux gènes, tels que vig-1 (ou viperin/cig-5/rsad2) [
36], très conservé des poissons aux mammifères, dont le produit présente une activité antivirale. Parmi les nouveaux gènes induits par l’infection virale et l’IFN, nous avons aussi identifié une famille considérable de protéines TRIM (tripartite motif), spécifique des téléostéens, et qui a subi des épisodes d’expansion et de diversification indépendants chez différentes espèces, suggérant une reconnaissance et une sélection par des pathogènes [
37]. 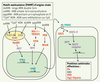 | Figure 3.
Représentation schématique des voies d’induction de défense antivirale. Les protéines possédant un orthologue équivalent fonctionnel chez les poissons sont en rouge ; celles qui ont des homologues multiples dont les fonctions sont potentiellement équivalentes sont en italique et violet ; celles dont l’équivalent fonctionnel est identifié et n’est pas l’orthologue sont en vert souligné ; celles enfin qui n’ont pas d’équivalent connu chez les poissons sont en bleu. Abréviations non indiquées dans le texte : RIG : retinoic acid inducible gene ; PKR : double-stranded RNA-dependent protein kinase ; VISA : virus-induced signalling adapter ; IRF : interferon regulatory factor ; SOCS : suppressor of cytokine signaling ; STAT : signal transducer and activator of transcription ; ISGF : interferon-stimulated gene factor ; TLR : Toll-like receptor ; PAMP : pathogen-associated molecular patterns (modifié d’après Haller et al. [ 33]). |
En conclusion, le fonctionnement d’ensemble du sytème immunitaire des poissons est très semblable à celui des mammifères, au point que l’étude des pathologies infectieuses des poissons peut présenter un réel interêt pour la compréhension de certaines maladies humaines. Toutefois, lorsque l’on analyse les gènes, les affinités évolutives sont souvent complexes.

|
Footnotes |
1. Manning, MJ. Fishes, in Immunology. A comparative approach, R. Turner, Editor. 1994, John Wiley & Sons: Chichester. p. 69–100. 2. Kobayashi I, Kuniyoshi S, Saito K, et al. Long-term hematopoietic reconstitution by transplantation of kidney hematopoietic stem cells in lethally irradiated clonal gibuna crucian carp (Carassius auratus langsdorfii). Dev Comp Immunol 2008; 32 : 957–65. 3. Yaniv K, Isogai S, Castranova D, et al. Live imaging of lymphatic development in the zebrafish. Nat Med 2006; 12 : 711–6. 4. Bernard D, Riteau B, Hansen JD, et al. Phenotypic and functional similarity of gut intraepithelial and systemic T cells in a teleost fish. J Immunol 2006; 176 : 3942–9. 5. Subramanian S, MacKinnon SL, Ross NW. A comparative study on innate immune parameters in the epidermal mucus of various fish species. Comparative Biochemistry and Physiology Part B: Biochem Mol Biol 2007; 148 : 256–63. 6. Miller N, Wilson M, Bengtén E, et al. Functional and molecular characterization of teleost leukocytes. Immunol Rev 1998; 166 :187–97. 7. Bleyzac P, Exbrayat JM, Fellah JS. Emergence dy système immunitaire adaptatif. Med Sci (Paris) 2005; 21 : 210–5. 8. Wienholds E, Schulte-Merker S, Walderich B, Plasterk RH. Target-selected inactivation of the zebrafish rag1 gene. Science 2002; 297 : 99–102. 9. Danilova N, Bussmann J, Jekosch K, Steiner LA. The immunoglobulin heavy-chain locus in zebrafish: identification and expression of a previously unknown isotype, immunoglobulin Z. Nat Immunol 2005; 6 : 295–302. 10. Hansen JD, Landis ED, Phillips RB. Discovery of a unique Ig heavy-chain isotype (IgT) in rainbow trout: Implications for a distinctive B cell developmental pathway in teleost fish. Proc Natl Acad Sci U S A 2005; 102 : 6919–24. 11. Kaattari SL, Zhang HL, Khor IW, Kaattari IM, Shapiro DA. Affinity maturation in trout: clonal dominance of high affinity antibodies late in the immune response. Dev Comp Immunol 2002; 26 : 191–200. 12. Yang F, Waldbieser GC, Lobb CJ. The nucleotide targets of somatic mutation and the role of selection in immunoglobulin heavy chains of a teleost fish. J Immunol 2006; 176 : 1655–67. 13. Li J, Barreda DR, Zhang YA, et al. B lymphocytes from early vertebrates have potent phagocytic and microbicidal activities. Nat Immunol 2006; 7 : 1116–24. 14. Herbomel, P., B. Thisse, and C. Thisse, Ontogeny and behaviour of early macrophages in the zebrafish embryo. Development 1999; 126 : 3735–45. 15. Le Guyader D, Redd MJ, Colucci-Guyon E, et al. Origins and unconventional behavior of neutrophils in developing zebrafish. Blood 2008; 111. 16. Cuesta A, Angeles Esteban M, Meseguer J. Cloning, distribution and up-regulation of the teleost fish MHC class II alpha suggests a role for granulocytes as antigen-presenting cells. Mol Immunol 2006; 43 : 1275–85. 17. Yoder JA. Investigating the morphology, function and genetics of cytotoxic cells in bony fish. Comp Biochem Physiol C Toxicol Pharmacol 2004; 138 : 271–80. 18. Vandepoele K, De Vos W, Taylor JS, et al. Major events in the genome evolution of vertebrates: paranome age and size differ considerably between ray-finned fishes and land vertebrates. Proc Natl Acad Sci USA 2004; 101 :1638–43. 19. Hansen JD, Strassburger P, Thorgaard GH, Young WP, Du Pasquier L. Expression, linkage, and polymorphism of MHC-related genes in rainbow trout, Oncorhynchus mykiss. J Immunol 1999; 163 : 774–86. 20. Nakao M, Mutsuro J, Nakahara M, Kato Y, Yano T. Expansion of genes encoding complement components in bony fish: biological implications of the complement diversity. Dev Comp Immunol 2003; 27 : 749–62. 21. Roach JC, Glusman G, Rowen L, et al. The evolution of vertebrate Toll-like receptors. Proc Natl Acad Sci USA 2005; 102 : 9577–82. 22. Matsuo A, Oshiumi H, Tsujita T, et al. Teleost TLR22 recognizes RNA duplex to induce IFN and protect cells from birnaviruses. J Immunol 200; 181 : 3474–85. 23. Lutfalla G, Roest Crollius H, Stange-Thomann N, et al. Comparative genomic analysis reveals independent expansion of a lineage-specific gene family in vertebrates: the class II cytokine receptors and their ligands in mammals and fish. BMC Genomics 2003; 4 : 29. 24. Huising MO, Kruiswijk CP, Flik G. Phylogeny and evolution of class-I helical cytokines. J Endocrinol 2006; 189 : 1–25. 25. Stein C, Caccamo M, Laird G, Leptin M. Conservation and divergence of gene families encoding components of innate immune response systems in zebrafish. Genome Biol 2007; 8 : R251. 26. Huising MO, Stet RJ, Savelkoul HF, et al. The molecular evolution of the interleukin-1 family of cytokines ; IL-18 in teleost fish. Dev Comp Immunol 2004; 28 : 395–413. 27. Nomiyama H, Hieshima K, Osada N, et al. Extensive expansion and diversification of the chemokine genefamily in zebrafish: Identification of a novel chemokine subfamily CX. BMC Genomics 2008; 9 : 222. 28. de Kinkelin P, Dorson M. Interferon production in rainbow trout (Salmo gairdneri) experimentally infected with Egtved virus. J Gen Virol 1973; 19 : 125–7. 29. Robertsen B, Bergan V, Røkenes T, Larsen R, Albuquerque A. Atlantic salmon interferon genes: cloning, sequence analysis, expression, and biological activity. J Interferon Cytokine Res 2003; 23 : 601–12. 30. Sun B, Robertsen B, Wang Z, Liu B. Identification of an Atlantic salmon IFN multigene cluster encoding three IFN subtypes with very different expression properties. Dev Comp Immunol 2009; 33 : 547–58. 31. Levraud JP, Boudinot P, Colin I, et al. Identification of the zebrafish IFN receptor: implications for the origin of the vertebrate IFN system. J Immunol 2007; 178 : 4385–94. 32. Zou J, Yoshiura Y, Dijkstra JM, et al. Identification of an interferon gamma homologue in Fugu, Takifugu rubripes. Fish Shellfish Immunol 2004; 17 : 403–9. 33. Haller O, Kochs G, Weber F. The interferon response circuit: induction and suppression by pathogenic viruses. Virology 2006; 344 : 119–30. 34. Staeheli P, Yu YX, Grob R, Haller O. A double-stranded RNA-inducible fish gene homologous to the murine influenza virus resistance gene Mx. Mol Cell Biol 1989; 9 : 3117–21. 35. Boudinot P, Salhi S, Blanco M, Benmansour A. Viral haemorrhagic septicaemia virus induces vig-2, a new interferon-responsive gene in rainbow trout. Fish Shellfish Immunol 2001; 11 : 383–97. 36. Boudinot P, Massin P, Blanco M, Riffault S, Benmansour A. vig-1, a new fish gene induced by the rhabdovirus glycoprotein, has a virus-induced homologue in humans and shares motifs with the MoaA family. J Virol 1999; 73 : 1846–52. 37. van der Aa LM, Levraud JP, Yahmi M, et al. A large new subset of TRIM genes highly diversified by duplication and positive selection in teleost fish. BMC Biology, 2009. 7: p. 7. 38. DuPasquier L. Diversification des immuno-récepteurs au cours de l’évolution des Métazoaires. Med Sci 2009 sous presse. 39. Bisbal C, Salehzada T. RNase L, a crucial mediator of innate immunity and other cell functions. Med Sci (Paris) 2008; 24 : 859–64. |