| |
| Med Sci (Paris). 2009 April; 25(4): 361–369. Published online 2009 April 15. doi: 10.1051/medsci/2009254361.La lactoferrine : une protéine multifonctionnelle Annick Pierce,* Dominique Legrand, and Joël Mazurier Unité de Glycobiologie Structurale et Fonctionnelle, CNRS UMR 8576, Université des Sciences et des Technologies de Lille, IFR 147, 59655 Villeneuve d’Ascq Cedex, France |
Cet article est dédié à la mémoire de madame le Professeur Geneviève Spik
Isolée en 1960 [
1], la lactoferrine appartient à la famille des transferrines : lactoferrines (Lf) et transferrines (Tf) fixent réversiblement deux ions ferriques et possèdent non seulement une structure primaire (59 % homologie) mais également une conformation spatiale très proches avec des sites de liaison du fer identiques. Elles diffèrent par leur charge de surface (pHi de 8,4-9 pour la Lf et de 5,4-5,9 pour la Tf) et la stabilité de la liaison protéine-fer [
2]. En effet, la stabilité de fixation du fer ferrique en fonction du pH de la Lf est supérieure à celle de la Tf. Il faut en effet un pH inférieur à 2 pour dissocier le fer de la Lf, alors qu’un pH inférieur à 6 suffit à le dissocier de la Tf. Cette caractéristique, associée à une affinité pour le fer sensiblement supérieure à celle de la Tf à pH neutre, attribue un rôle de chélateur du fer à la Lf, plutôt que celui de transporteur du fer, propre à la Tf. Ces caractéristiques vont conférer à la Lf des fonctions qui lui sont propres (Figure 1) et, contrairement à la Tf, elle ne sera pas impliquée dans l’homéostasie martiale [
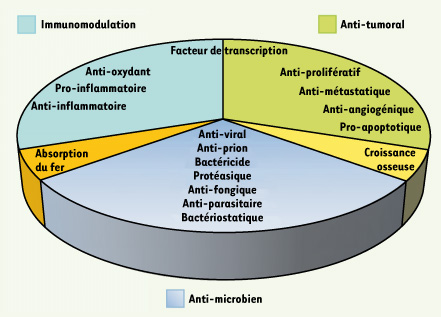
3].  | Figure 1.
La lactoferrine : une protéine multifonctionnelle. Les rôles multiples de la lactoferrine sont regroupés en secteurs : rôles anti-microbiens, immunomodulateurs, anti-tumoraux, dans l’absorption du fer et dans la croissance osseuse. |
Synthétisée en continu par les épithéliums glandulaires, la Lf est présente dans le lait, les larmes, la bile, la salive et les sécrétions des organes reproducteurs et des tractus respiratoire et gastro-intestinal [
4]. Elle est également synthétisée au cours de la différenciation des polynucléaires neutrophiles dans lesquels elle est stockée, ou par les cellules microgliales [
5,
6]. La concentration sérique de Lf est faible, mais ce taux est augmenté lors de la dégranulation des neutrophiles qui conduit à une très forte accumulation de Lf sur le lieu de l’inflammation. La Lf humaine (hLf) est une glycoprotéine qui a pour caractéristique d’être hautement basique avec une distribution concentrée de ses charges positives dans le domaine aminoterminal et dans la région inter-lobe. La structure tridimensionnelle montre que ce polypeptide est structuré en deux lobes globulaires correspondant aux moitiés amino- et carboxy-terminales liées par une courte hélice a. Chaque lobe est structuré en deux domaines qui délimitent une crevasse profonde à l’intérieur de laquelle est situé le site de fixation du fer (Figure 2) [
7,
8]. Le domaine amino-terminal est le siège des interactions de la Lf avec ses nombreux partenaires : glycosaminoglycanes (GAG), lipopolysaccharides (LPS), ADN et récepteurs, et par-là même, il intervient dans la majorité de ses activités biologiques [
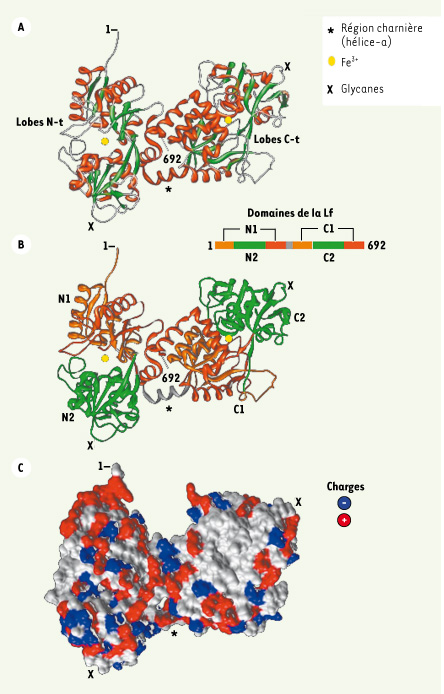
9]. Ces caractéristiques sont partagées par d’autres Lf, notamment par la Lf bovine (bLf), molécule la plus utilisée dans les essais in vitro et in vivo.  | Figure 2.
Structure tridimensionnelle de la lactoferrine. La structure tridimensionnelle présentée est celle d’une hLf saturée en fer montrant l’extrémité amino-terminale correspondant aux résidus 1GRRRR5 (données de diffraction aux rayons-X ; référence pdb 2BJJ) [17, 18]. A. La structure montre l’organisation bilobée de la molécule avec, en orange, les hélices α et, en vert, les feuillets β. Les acides aminés N-t et C-t sont indiqués. B. La structure montre l’organisation en 4 domaines de la Lf : N1 et N2, et C1 et C2 pour les lobes N-t et C-t, respectivement. Les sites de fixation du fer sont localisés aux interfaces entre chaque paire de domaines. C. La photo montre la surface accessible aux solvants de la molécule avec la distribution des charges positives (bleu) et négatives (rouge). La modélisation moléculaire a été réalisée en utilisant le programme Chimera (http://www.cgl.ucsf.edu/chimera/). |
|
Activité anti-microbienne La Lf est un élément clef du système de défense inné de l’hôte et possède un large spectre antimicrobien qui s’étend des bactéries Gram- et Gram+, levures, champignons, à certains virus et protozoaires (Tableau I). Récemment, le groupe de Teng a fait une découverte primordiale en montrant que l’expression de la Lf pouvait être directement induite par un stimulus proinflammatoire : LPS ou ARN double brin, mimant une attaque virale [
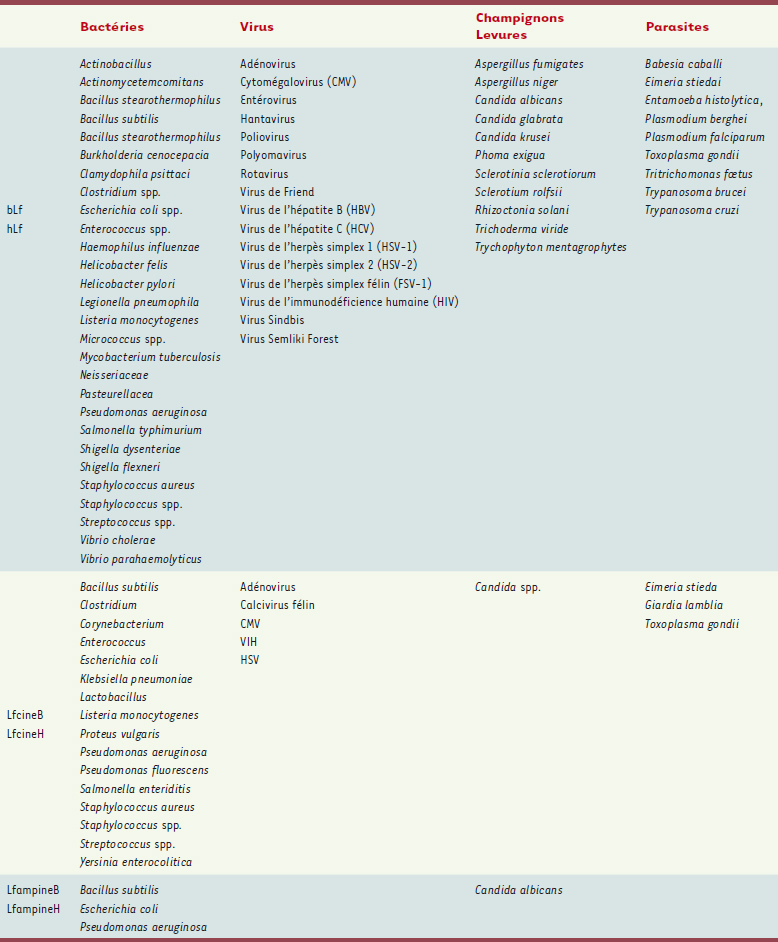
10].  | Tableau I.
Micro-organismes contre lesquels s’exerce l’activité anti-infectieuse des lactoferrines humaine et bovine ou des peptides naturels (Lfcine) ou synthétiques (Lfampine) issus de ces lactoferrines [ 9,
11,
12,
14,
15]. |
Activité anti-bactérienne La Lf est à la fois bactériostatique et bactéricide (pour revues voir [ 9, 11, 12]). Le principal mécanisme par lequel elle exerce son action bactériostatique est la privation en fer. Sécrétée dans les fluides biologiques sous une forme non saturée (apo-Lf), elle inhibe la croissance des bactéries par compétition avec les sidérophores bactériens pour la séquestration du fer libre. À côté de cette activité bactériostatique, la Lf exerce aussi une activité bactéricide indépendante de sa fonction de chélateur du fer. Par sa capacité à se fixer directement aux LPS, aux acides lipoteichoïques (molécules de la paroi bactérienne) ou aux porines, la Lf déstabilise la membrane des bactéries, provoque leur fragilisation et augmente leur perméabilité. L’activité bactéricide de la Lf passe également par l’inhibition de l’attachement des bactéries aux cellules hôtes. Ainsi, en se fixant aux GAG et intégrines de l’hôte, la Lf neutralise ces pathogènes dès les premiers stades de l’infection. La résistance aux antibiotiques de certaines bactéries peut être due au fait qu’elles sont capables de s’organiser en biofilm. Des études in vitro montrent que l’apo-Lf, en interagissant avec ces différentes molécules de surface, peut prévenir la formation de ces biofilms. L’activité bactéricide de la Lf est concentrée dans la région aminoterminale fortement basique. Cette portion de la protéine peut être libérée sous l’action de la pepsine lors de la digestion. Le peptide antimicrobien produit est appelé lactoferricine (Lfcine) (Figure 3) [
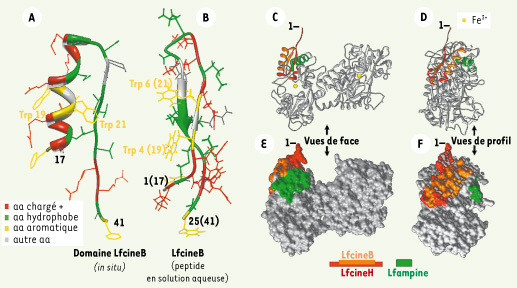
13]. Son activité bactériolytique à spectre large (Tableau I) est supérieure à celle de la Lf native, la Lfcine d’origine bovine (LfcineB) étant la plus active [14]. Ainsi, la Lf, en sacrifiant la majeure partie de sa chaîne polypeptidique, produit une arme antibactérienne beaucoup plus puissante qu’elle-même. L’efficacité des Lfcines fait que de nouveaux peptides antimicrobiens ont été élaborés et testés, notamment la lactoferrampine (Lfampine) [15].  | Figure 3.
Structure de la lactoferricine (Lfcine) et localisation du domaine Lfcine et de la séquence de la lactoferrampine (Lfampine) sur la Lf. La figure montre (A) le domaine LfcineB tel qu’il est conformé dans la bLf (résidus 17-41 ; référence pdb 1BLF) [25], et (B) le peptide de 25 résidus d’acides aminés de la LfcineB en solution aqueuse déterminé par spectroscopie RMN (référence pdb 1LFC) [26]. Les positions des acides aminés chargés positivement, hydrophobes et aromatiques, sont indiquées, ainsi que la position des résidus de Trp 19 et 21 dans la bLf. Les positions de la LfcineH (orange et rouge), de la LfcineB (orange) et de la LfampineB ou LfampineH (vert) sont montrées sur les vues de face (C, E) et de profil gauche (D, F) de la hLf. La représentation en ruban est montrée en C et D et celle de la surface de la molécule accessible aux solvants en E et F. La modélisation moléculaire a été réalisée en utilisant le programme Chimera (http://www.cgl.ucsf.edu/chimera/). |
Les données fournies par des études expérimentales et épidémiologiques montrent que les facteurs génétiques jouent un rôle primordial dans la susceptibilité aux infections. L’étude du polymorphisme du gène de la Lf montre effectivement l’existence de variants possédant des propriétés physicochimiques et biologiques spécifiques. Une analyse, réalisée chez des sujets atteints ou non de parodontite juvénile agressive, montre que les sujets non affectés possèdent un résidu lysine en position 29, alors que les sujets atteints possèdent en lieu et place un résidu arginine [
16]. Le fait que le mutant LfK29R possède une plus grande activité bactéricide que la protéine native confirme qu’il existe bien une susceptibilité génétique à certains pathogènes. Activité antivirale La Lf exerce cette activité contre des virus à ADN et à ARN, en particulier ceux de l’hépatite, de l’herpès et du VIH (virus de l’immunodéficience humaine) (revues dans [ 8, 10, 11]). Le mécanisme de l’action antivirale de la Lf n’est pas complètement élucidé. Néanmoins, dans la plupart des études réalisées in vitro, la Lf inhibe l’attachement et l’entrée des virus en interagissant avec les GAG et les intégrines utilisés par les virus pour pénétrer leurs cellules hôtes. La Lf semble également pouvoir inhiber la réplication virale du virus VIH-1, du virus de l’hépatite chronique C et des rotavirus in vitro. Les premiers essais cliniques ont montré que l’administration orale de Lf augmentait la réduction de la charge virale chez des patients infectés par le virus de l’Herpès traités par l’acyclovir. Activités anti-fongique, anti-parasitaire et anti-prion La prise orale de bLf réduit significativement la candidose buccale [ 9, 11, 12], allant jusqu’à la guérison totale de certains des animaux affectés. Cette activité antifongique est en relation avec la capacité qu’a la Lf de s’adsorber sur les levures, de déstabiliser leur paroi mais aussi d’induire l’apoptose chez ces organismes. L’activité antiparasitaire semble complexe et fait appel aux différentes stratégies mises en place par la Lf : fixation à la membrane de l’amibe Entamoeba histolytica causant ainsi des dommages importants, inhibition de la croissance de Toxoplasma gondii dans ses cellules hôtes et interaction avec des récepteurs spécifiques présents à la surface de Trichomonas vaginalis et Trypanosoma cruzi [ 9, 11, 12]. La bLf pourrait également diminuer l’infectiosité par le prion en inhibant l’accumulation de la forme infectieuse dans des cellules infectées [
19]. |
Modulation de la réponse inflammatoire La Lf est un puissant modulateur de la réponse inflammatoire protégeant l’organisme des agressions de pathogènes mais jouant également un rôle clef dans les pathologies inflammatoires [9,
20,
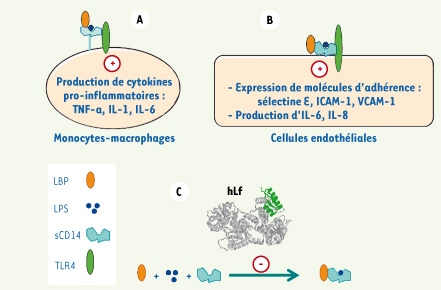
21]. Activité anti-inflammatoire En interagissant avec les LPS et de nombreux récepteurs à la surface des cellules épithéliales et immunes, la Lf module la production de cytokines et le recrutement de cellules immunes au site de l’inflammation et protège ainsi du choc septique [ 9, 20, 21]. De nombreuses études chez l’animal montrent qu’une prise orale de bLf protège efficacement contre des doses létales de LPS. Le mécanisme d’action de cette protection est illustré par la Figure 4. La Lf, en diminuant l’environnement proinflammatoire, protège également contre certaines maladies : arthrite rhumatoïde, inflammation chronique de l’intestin, maladies neurodégénératives et allergie cutanée. De nombreuses études utilisant des modèles animaux d’inflammation expérimentale des différents tissus touchés montrent que l’administration orale de bLf réduit l’inflammation. Dans la plupart des cas, cette protection est également due à une diminution de la production de TNF-α ( tumor necrosis factor) et l’IL(interleukine)-1β et une augmentation de l’IL-10. Cette modulation du processus inflammatoire passe également par une diminution du recrutement de cellules immunes, notamment des leucocytes.  | Figure 4.
La neutralisation des LPS par la lactoferrine protège du choc septique. Les LPS libérés dans la circulation sanguine s’associent à la LBP (LPS-binding protein) et au récepteur membranaire CD14 présent sur les monocytes et les macrophages. A. L’activation de ces cellules nécessitera l’interaction du complexe ternaire avec le récepteur TLR4 (cell-signalling Toll-like receptor 4). B. Les cellules endothéliales dépourvues de CD14 seront activées par la présentation au TLR4 du complexe LPS-LBP-CD14 soluble. Le CD14 soluble est produit soit par les cellules activées, soit par clivage enzymatique du CD14 membranaire. L’activation des monocytes/macrophages et des cellules endothéliales conduit à la production de cytokines proinflammatoires. Produites en quantités modérées, ces molécules ont un effet bénéfique mais, lorsque leur production est excessive, il en résulte des altérations tissulaires pouvant conduire au choc septique. L’action de ces cytokines sur les cellules endothéliales conduit également à une augmentation de l’expression des molécules d’adhérence dont les ligands sont portés par les neutrophiles et les monocytes. L’adhésion des neutrophiles, suivie de leur dissémination dans les tissus, joue un rôle majeur dans le processus inflammatoire. C. La Lf, en piégeant le LPS, inhibe la formation des différents complexes et s’oppose aux effets délétères du LPS, offrant ainsi une protection contre le choc septique [9, 20]. |
Activité anti-oxydante L’activation des monocytes/macrophages par les LPS ou le TNF-α déclenche l’activité phagocytaire et conduit à une production accrue d’espèces oxygénées réactives qui peut être amplifiée en présence de fer libre. La Lf libérée au site de l’inflammation, en piégeant le fer, limite ce processus et le dommage causé aux membranes cellulaires en prévenant la peroxydation des lipides. Récemment, une étude clinique sur une cohorte de 90 patients atteints d’hépatite C chronique montre que les sujets qui ont ingéré de la bLf présentent une amélioration de leur statut oxydant hépatique [
22]. Activité pro-inflammatoire La Lf influence non seulement l’immunité innée, mais aussi l’immunité acquise, en stimulant les réponses de l’hôte [ 9, 20, 21]. Des expériences réalisées chez l’animal montrent que la bLf stimule la maturation et la différenciation des cellules T, ainsi que l’activité phagocytaire des cellules immunes. La prise orale de bLf augmente en effet le nombre de lymphocytes T CD4 + dans les tissus lymphoïdes, et entraîne l’induction de la production d’IL-18 et la polarisation des lymphocytes en cellules T auxiliaires de type 1 (Th-1). Ces dernières conduisent ensuite à l’élimination du virus de l’hépatite C lors d’une thérapie par l’interféron, favorisent la phagocytose de Staphylococcus aureus et de certains champignons et augmentent l’efficacité d’une vaccination par le BCG. Par ailleurs, l’ingestion de Lf augmente la production de splénocytes, d’IFN (interféron)-γ et d’IL-12 en réponse à une infection par le virus de l’herpès. |
La Lf : une arme contre le cancer ? La Lf se place également au carrefour de la régulation de processus cellulaires cruciaux que sont le cycle et la mort cellulaires. En exerçant un rôle de surveillance de la croissance des cellules, la Lf lutte contre la tumorigenèse et le développement de métastases, ce qui suggère que cette molécule pourrait jouer le rôle d’un suppresseur de tumeur. Les Lf native et recombinante, les Lfcines et la delta-lactoferrine (ΔLf), isoforme intracellulaire de la hLf, possèdent toutes une activité antitumorale [9, 14, 21,
23,
24]. Activation de cellules immunes Les activités antitumorales de la Lf ont d’abord été attribuées à son potentiel immuno-modulateur, et notamment à sa capacité à favoriser la cytotoxicité des cellules NK ( natural killer). De nombreux modèles animaux de carcinogenèse chimique ciblant spécifiquement différents organes ont été mis en place. À chaque fois, les animaux traités oralement avec de la bLf ont mieux résisté aux cancérigènes. Leur protection semble être corrélée à un nombre élevé de cellules NK et de lymphocytes T exprimant CD8, CD4 et l’IFNγ dans la circulation et la muqueuse intestinale. Inhibition de l’angiogenèse
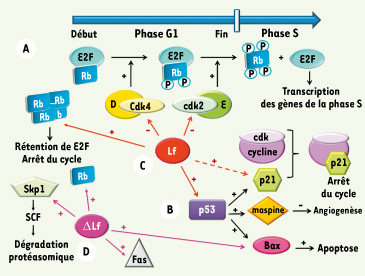
In vivo, la bLf inhibe également l’angiogenèse, mécanisme qui favorise la néovascularisation indispensable à la croissance des tumeurs et au développement des métastases. Cette activité implique l’activité anti-angiogénique de la cytokine IL-18. La prise orale de bLf conduit en effet à l’activation de la caspase-1 et, par conséquent, à la maturation de l’IL-18. Cet effet anti-angiogénique semble spécifique à la bLf, la hLf exerçant, quant à elle, un effet pro-angiogénique in vitro via la surexpression du récepteur du VEGF ( vascular endothelial growth factor) (KDR/Flk-1) et la migration de cellules endothéliales. Régulation de la croissance cellulaire La Lf limite la croissance des cellules tumorales en induisant un arrêt du cycle cellulaire en G1/S. Cet arrêt est provoqué par un ensemble de processus qui gère la valse des cyclines et leur dégradation, la régulation par phosphorylation de kinases et la disponibilité des facteurs d’initiation de la transcription (Figure 5). La Lf est au cœur de cette régulation mais il est difficile de proposer une vue d’ensemble, les événements qu’elle contrôle ayant été étudiés dans des modèles cellulaires différents. Ainsi, la Lf inhibe la voie des MAP kinases dans les cellules MDAMB-231 (issues d’un adénocarcinome du sein humain) via une diminution des activités cdk2 ( cyclin dependent kinase) et cdk4, et à une augmentation de l’expression de l’inhibiteur p21. Dans les cellules de carcinome du cou et de la tête, elle agit en activant la voie dépendante de p27/cycline E via la phosphorylation de AKT. Dans les cellules de carcinome du col de l’utérus, la Lf entraîne une surexpression du suppresseur de tumeur p53 via la voie NF-κB. La progression du cycle et la traduction d’acteurs cellulaires de la transition G1/S nécessitent la dissociation du complexe Rb-E2F par phosphorylation de Rb (protéine du rétinoblastome). La Lf, en induisant la surexpression de Rb, maintient une concentration élevée en Rb non phosphorylée et conduit donc à la rétention de E2F. La ΔLf provoque également un arrêt du cycle cellulaire via la surexpression des gènes Rb et Skp1. Skp1 appartient au complexe SCF (Skp1/Cullin/F-box) ubiquitine ligase responsable de la dégradation par le protéasome d’acteurs du cycle cellulaire de la transition G1/S. 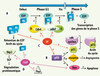 | Figure 5.
La lactoferrine au carrefour entre prolifération et apoptose. Les protéines Rb et p53 jouent un rôle déterminant dans la régulation du cycle cellulaire. A. La progression du cycle repose sur l’activation du facteur de transcription E2F qui active les gènes dont l’expression est nécessaire à la phase S. Rb inhibe l’interaction de E2F avec le complexe d’initiation de la transcription, en se fixant sur son domaine d’activation. Le blocage de la progression du cycle cellulaire est réalisé par Rb sous forme non ou hypophosphorylée. Au cours de la phase G1, Rb est phosphorylée par la cycline D/cdk4 mais continue d’interagir avec E2F. Le changement de conformation du à cette phosphorylation favorise la seconde vague de phosphorylation par le complexe cycline E/cdk2, ce qui aura pour conséquence d’inactiver Rb, de libérer E2F et de déclencher la phase S. B. Le contrôle de l’intégrité cellulaire est aussi assuré par le facteur de transcription p53 qui active la transcription de nombreux acteurs du cycle cellulaire, dont l’inhibiteur p21 qui bloque la progression du cycle en se fixant sur n’importe quel complexe cycline/cdk, inhibant ainsi leur activité. Il y aura alors réparation ou apoptose. P53 activera également la transcription d’un facteur anti-angiogénique, la maspine et du facteur pro-apoptotique Bax. La Lf et la ΔLf vont toutes deux participer au contrôle du cycle et de la mort cellulaire. C. La Lf induit une surexpression de Rb qui s’accumule majoritairement sous forme hypophosphorylée conduisant à la rétention de E2F. La Lf peut également inhiber l’activité kinase de cdk4 et cdk2, activer l’expression de p53 et augmenter indirectement, mais spécifiquement, le niveau de l’inhibiteur de la kinase dépendante des cyclines p21. D. La ΔLf transactive les gènes Bax, Fas, Rb et Skp1. La protéine Skp1 appartient au complexe SCF à activité ubiquitine ligase responsable de la dégradation protéasomale de nombreux acteurs du cycle cellulaire de la transition G1/S. |
Promotion de l’apoptose En équilibre constant avec la prolifération, l’apoptose est nécessaire à la survie des organismes cellulaires. De nombreux travaux montrent que la Lf est capable de déclencher le processus apoptotique via l’activation des caspases 3 et 8 et de la voie Fas. Les peptides naturels ou synthétiques de la Lf sont également cytotoxiques pour les cellules tumorales in vitro et in vivo et la Lfcine provoque l’apoptose dans différents types cellulaires. L’expression de la ΔLf conduit également à la mort cellulaire via la transactivation des gènes Bax et Fas. Les Lf : des suppresseurs de tumeurs ? Puisque la Lf et laΔ Lf possèdent toutes deux des activités antitumorales, elles pourraient se comporter en suppresseurs de tumeur. Les gènes suppresseurs de tumeur perdent leur fonction dans les cancers humains, et il a été montré que l’expression de ces deux isoformes est fortement diminuée, voire éteinte dans certains cancers. Des altérations génétiques et épigénétiques inactivent le gène de la Lf fournissant aux cellules cancéreuses un réel avantage prolifératif [
27]. Il est intéressant de noter que le taux élevé de ces deux transcrits dans des biopsies de glandes mammaires cancéreuses est corrélé à un bon pronostic [
28]. Les activités immunomodulatrice, anti-oxydante et anti-tumorale de la Lf suggèrent qu’elle puisse être un candidat très prometteur dans la lutte contre la tumorigenèse ou, en tout cas, dans sa prévention. |
Les Lf : des facteurs de transcription ? Cette question n’a toujours pas trouvé de réponse claire. La hLf possède la capacité de se fixer à des séquences spécifiques d’ADN dont l’une d’entre elles s’est révélée être un élément de réponse fonctionnel. Elle possède, en plus de la séquence NLS (séquence de localisation nucléaire) conservée parmi les Lf de différentes espèces et fonctionnelle dans la ΔLf, une séquence NLS qui lui est propre et qui correspond aux résidus 1-5 amino-terminaux [
29,
30]. Ces deux Lf ont été observées dans le noyau où elles exercent une activité de facteur de transcription activant pour la Lf le gène de l’IL-1β et pour la ΔLf les gènes Skp1, Rb, Bax, Fas et DcpS (decapping enzyme scavenger) [29,
31,
32]. La polémique tourne donc autour d’un problème d’adressage. Si la ΔLf cytoplasmique peut transiter aisément jusqu’au noyau, la Lf de sécrétion doit, après endocytose et avant son transfert au lysosome, emprunter une voie qu’il reste à découvrir pour accéder au noyau. |
Régulation de la croissance osseuse Le remodelage osseux est le fait d’une coopération étroite et précise entre les ostéoclastes qui détruisent le tissu osseux, et les ostéoblastes qui le reconstruisent [
33]. La bLf stimule la prolifération des ostéoblastes in vitro en favorisant la croissance osseuse. Elle limite également la résorption osseuse en inhibant l’ostéoclastogenèse. Ces résultats sont encourageants, mais le mécanisme d’action reste encore à être élucidé. Néanmoins, la Lf semble jouer un rôle physiologique clef dans la formation osseuse et pourrait être un agent thérapeutique potentiel de la lutte contre l’ostéoporose [
34]. |
Régulation de l’hémostasie martiale Le rôle de la Lf dans l’absorption intestinale du fer est toujours un grand sujet de controverse. Si les nourrissons alimentés au lait maternel présentent moins de problèmes d’anémie que ceux qui sont nourris avec des laits maternisés, les nombreuses expériences de supplémentation des laits par la bLf tendent à démontrer que la Lf n’est pas impliquée dans ce processus [
35]. Ces données ont été confirmées sur la base de modèles animaux et notamment les souris lf−/−. En effet, les souriceaux issus d’un croisement de souris lf−/−
et de souris sauvages ne souffrent pas de l’absence de Lf dans le lait de leur mère [
36]. Des travaux récents relancent la polémique puisqu’un récepteur de la Lf (intelectine) a été caractérisé à la surface de la muqueuse intestinale fœtale [
37] et qu’une étude menée en parallèle sur 300 femmes enceintes ayant une anémie ferriprive montre qu’une prise orale de bLf entraîne une amélioration, voire la guérison de ces patientes [
38]. |
La découverte de la Lf dans le lait maternel il y a soixante ans ne permettait pas d’imaginer qu’elle puisse posséder un tel potentiel thérapeutique. Ses nombreuses activités biologiques, dont la spécificité a parfois été mise en doute mais dont les effets ont souvent été clairement démontrés in vivo, et le fait qu’elle soit dépourvue de toxicité, font qu’elle suscite un intérêt industriel important dans les domaines agroalimentaire et pharmaceutique, et la classent parmi les alicaments. Cent tonnes de bLf sont purifiées et mises sur le marché chaque année. La hLf recombinante est produite dans différents micro-organismes et plantes, mais également directement dans le lait d’animaux transgéniques. Les applications sont nombreuses et de plus en plus d’essais cliniques sont réalisés afin de tester in vivo son efficacité en tant qu’agent anti-microbien, immunomodulateur et/ou anti-cancéreux.
|
1. Montreuil J, Tonnelat J, Mullet S. Preparation and properties of lactosiderophilin (lactotransferrin) of human milk. Biochim Biophys Acta 1960; 45 : 413–21. 2. Baker EN, Baker HM, Kidd RD. Lactoferrin and transferrin : functional variations on a common structural framework. Biochem Cell Biol 2002; 80 : 27–34. 3. Beaumont C. Mécanismes moléculaires de l’homéostasie du fer. Med Sci (Paris) 2004; 20 : 68–72. 4. Masson PL, Heremans JF, Dive C. An ironbinding protein common to many external secretions. Clinica Chimica Acta 1966; 14 : 735–9. 5. Masson PL, Heremans JF, Schonne E. Lactoferrin, an iron-binding protein in neutrophilic leukocytes. J Exp Med 1969; 130 : 643–58. 6. Fillebeen C, Ruchoux MM, Mitchell V, et al. Lactoferrin is synthesized by activated microglia in the human substantia nigra and its synthesis by the human microglial CHME cell line is upregulated by tumor necrosis factor alpha or 1-methyl-4-phenylpyridinium treatment. Brain Res Mol Brain Res 2001; 96 : 103–13. 7. Anderson BF, Baker HM, Norris GE, et al. Structure of human lactoferrin : crystallographic structure analysis and refinement at 2.8 Å resolution. J Mol Biol 1989; 209 : 711–34. 8. Baker EN, Baker HM. A structural framework for understanding the multifunctional character of lactoferrin. Biochimie 2009; 91 : 3–10. 9. Legrand D, Pierce A, Elass E, et al. Lactoferrin structure and functions. Adv Exp Med Biol 2008; 606 : 163–94. 10. Li Y, Limmon GV, Imani F, et al. Induction of lactoferrin gene expression by innate immune stimuli in mouse mammary epithelial HC-11 cells. Biochimie 2009; 91 : 58–67. 11. Valenti P, Antonini G. Lactoferrin : an important host defence against microbial and viral attack. Cell Mol Life Sci 2005; 62 : 2576–87. 12. Jenssen H, Hancock RE. Antimicrobial properties of lactoferrin. Biochimie 2009; 91 : 19–29. 13. Tomita M, Bellamy W, Takase M, et al. Potent antibacterial peptides generated by pepsin digestion of bovine lactoferrin. J Dairy Sci 1991; 74 : 4137–42. 14. Gifford JL, Hunter HN, Vogel HJ. Lactoferricin : a lactoferrin-derived peptide with antimicrobial, antiviral, antitumor and immunological properties. Cell Mol Life Sci 2005; 62 : 2588–98. 15. Haney EF, Nazmi K, Lau F, et al. Novel lactoferrampin antimicrobial peptides derived from human lactoferrin. Biochimie 2009; 91 : 141–54. 16. Wu YM, Juo SH, Ho YP, et al. Association between lactoferrin gene polymorphisms and aggressive periodontitis among Taiwanese patients. J Periodontal Res 2008; 7 octobre (online). 17. Thomassen EA, van Veen HA, van Berkel PH, et al. The protein structure of recombinant human lactoferrin produced in the milk of transgenic cows closely matches the structure of human milk-derived lactoferrin. Transgenic Res 2005; 14 : 397–405. 18. Haridas M, Anderson BF, Baker EN. Structure of human diferric lactoferrin refined at 2.2 A resolution. Acta Crystallogr D Biol Crystallogr 1995; 51 : 629–46. 19. Iwamaru Y, Shimizu Y, Imamura M, et al. Lactoferrin induces cell surface retention of prion protein and inhibits prion accumulation. J Neurochem 2008; 107 : 636–46. 20. Legrand D, Elass E, Carpentier M, et al. Lactoferrin : a modulator of immune and inflammatory responses. Cell Mol Life Sci 2005; 62 : 2549–59. 21. Ward PP, Paz E, Conneely OM. Multifunctional roles of lactoferrin : a critical overview. Cell Mol Life Sci 2005; 62 : 2540–8. 22. Konishi M, Iwasa M, Yamauchi K, et al. Lactoferrin inhibits lipid peroxidation in patients with chronic hepatitis C. Hepatol Res 2006; 36 : 27–32. 23. Tsuda H, Sekine K, Fujita K, et al. Cancer prevention by bovine lactoferrin and underlying mechanisms--a review of experimental and clinical studies. Biochem Cell Biol 2002; 80 : 131–6. 24. Bezault J, Bhimani R, Wiprovnick J, et al. Human lactoferrin inhibits growth of solid tumors and development of experimental metastases in mice. Cancer Res 1994; 54 : 2310–2. 25. Moore SA, Anderson BF, Groom CR, et al. Three-dimensional structure of diferric bovine lactoferrin at 2.8 Å resolution. J Mol Biol 1997; 274 : 222–36. 26. Hwang PM, Zhou N, Shan X, et al. Three-dimensional solution structure of lactoferricin B, an antimicrobial peptide derived from bovine lactoferrin. Biochemistry 1998; 37 : 4288–98. 27. Teng C, Gladwell W, Raphiou I, et al. Methylation and expression of the lactoferrin gene in human tissues and cancer cells. Biometals 2004; 17 : 317–23. 28. Benaïssa M, Peyrat JP, Hornez L, et al. Expression and prognostic value of lactoferrin mRNA isoforms in human breast cancer. Int J Cancer 2005; 114 : 299–306. 29. Mariller C, Benaïssa M, Hardiville S, et al. Human delta-lactoferrin is a transcription factor that enhances Skp1 (S-phase kinase-associated protein) gene expression. FEBS J 2007; 274 : 2038–53. 30. Penco S, Scarfi S, Giovine M, et al. Identification of an import signal for, and the nuclear localization of, human lactoferrin. Biotechnol Appl Biochem 2001; 34 : 151–9. 31. Son KN, Park J, Chung CK, et al. Human lactoferrin activates transcription of IL-1beta gene in mammalian cells. Biochem Biophys Res Commun 2002; 290 : 236–41. 32. Mariller C, Hardiville S, Hoedt E, et al. Proteomic approach to the identification of novel delta-lactoferrin target genes : Characterization of DcpS, an mRNA scavenger decapping enzyme. Biochimie 2009; 91 : 109–22. 33. Gallois A, Jurdic P. Ostéo-immunologie : une vision globale et intégrée du tissu squelettique et du système immunitaire. Med Sci
(Paris) 2009; 25 : 259–65. 34. Cornish J, Palmano K, Callon KE, et al. Lactoferrin and bone ; structure-activity relationships. Biochem Cell Biol 2006; 84 : 297–302. 35. Sanchez L, Calvo M, Brock J. Biological role of lactoferrin. Arch Dis Child 1992; 67 : 657–61. 36. Ward PP, Mendoza-Meneses M, Cunningham GA, et al. Iron status in mice carrying a targeted disruption of Lactoferrin, Mol Cell Biol 2003; 23 : 178–85. 37. Suzuki YA, Lopez V, Lonnerdal B. Mammalian lactoferrin receptors : structure and function. Cell Mol Life Sci 2005; 62 : 2560–75. 38. Paesano R, Pietropaoli M, Gessani S, et al. The influence of lactoferrin, orally administered, on systemic iron homeostasis in pregnant women suffering of iron deficiency and iron deficiency anaemia. Biochimie 2009; 91 : 44–51. |