| |
| Med Sci (Paris). 2009 April; 25(4): 327–329. Published online 2009 April 15. doi: 10.1051/medsci/2009254327.Cancer : lorsque recycler devient une faiblesse Pierre Sonveaux,* Frédérique Végran, Julien Verrax, Christophe J. De Saedeleer, Caroline Diepart, Bénédicte F. Jordan, Bernard Gallez, and Olivier Feron Unité de Pharmacologie et de Thérapeutique, Université catholique de Louvain (UCL), 52, avenue E. Mounier, 1200 Bruxelles, Belgique MeSH keywords: Animaux, Antinéoplasiques antimétabolites, Mort cellulaire, Division cellulaire, Hypoxie cellulaire, Transformation cellulaire néoplasique, Association thérapeutique, Acides coumariques, Altération de l'ADN, Évolution de la maladie, Métabolisme énergétique, Glycolyse, Humains, Lactates, Souris, Transporteurs d'acides monocarboxyliques, Protéines tumorales, Tumeurs, Tumeurs expérimentales, Petit ARN d'interférence, Sélection génétique, Symporteurs |
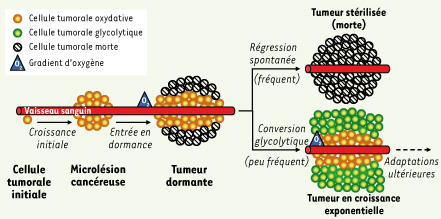
À l’origine du processus cancéreux, les descendants d’une cellule capable de proliférer de manière débridée envahissent le tissu d’origine pour former une masse tumorale de volume croissant (Figure 1). Or, à distance du vaisseau sanguin le plus proche, l’oxygène nécessaire à la chaîne respiratoire cellulaire (phosphorylations oxydatives) s’amenuise [
1]. Un équilibre dynamique s’installe donc entre la prolifération des cellules recevant suffisamment d’oxygène et la mort des cellules hypoxiques, ce qui favorise l’élimination naturelle des microlésions tumorales. Toutefois, l’hypoxie favorise aussi l’émergence de cellules cancéreuses capables de produire la majorité de leur énergie par la glycolyse plutôt que par la chaîne respiratoire [
2,
3]. Cette adaptation et sa pérennisation permettent à la tumeur d’entrer en phase de croissance exponentielle.  | Figure 1.
Agenda évolutif d’une tumeur. À l’origine du cancer, une cellule a acquis la capacité de proliférer de manière débridée. Lors d’une première phase de croissance, les cellules tumorales colonisent le tissu sain environnant pour former une microlésion cancéreuse. Lorsque la masse tumorale s’étend au-delà de la distance de diffusion de l’oxygène depuis le vaisseau sanguin le plus proche, la tumeur entre en dormance, un état caractérisé par un équilibre dynamique entre la multiplication des cellules tumorales suffisamment oxygénées et la mort des cellules tumorales hypoxiques. Dans la plupart des cas, ces tumeurs régressent spontanément, notamment en réponse aux attaques du système immunitaire. Toutefois, dans de rares cas, la pression de sélection qu’exerce l’hypoxie favorise l’émergence de cellules tumorales capables de produire l’énergie dont elles ont besoin par la glycolyse anaérobie. Cette conversion glycolytique marque l’entrée de la tumeur en phase de croissance exponentielle. Des adaptations ultérieures, telles que l’activation du processus angiogénique, favorisent le développement de la tumeur jusqu’à un stade symptomatique correspondant généralement à sa détection clinique. |
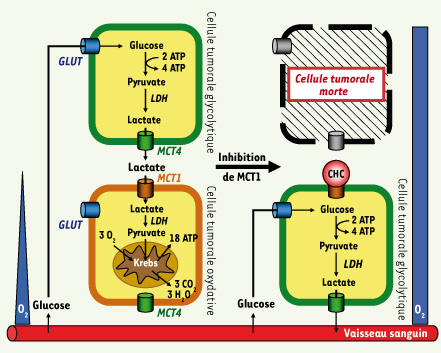
Le rendement énergétique de la glycolyse est faible, si bien que pour une même production d’énergie, une cellule tumorale hypoxique a besoin de 19 fois plus de glucose qu’une cellule tumorale en conditions normoxiques (Figure 2). Puisque le glucose est véhiculé par le sang, une question se pose : comment les cellules hypoxiques éloignées des vaisseaux sanguins ont-elles accès aux quantités énormes de glucose dont elles ont besoin ?  | Figure 2.
Les tumeurs sont des symbiontes métaboliques qu’il est possible d’attaquer. Nos recherches ont permis de découvrir que les cellules tumorales qui se développent dans un environnement normoxique ou hypoxique régulent mutuellement leur accès aux métabolites énergétiques. Les cellules qui ont accès à l’oxygène préfèrent en effet le lactate au glucose comme substrat pour la production d’ATP par la respiration. Cette voie métabolique implique l’entrée du lactate dans la cellule par le monocarboxylate transporter 1 (MCT1), son oxydation en pyruvate catalysée par la lactate déshydrogénase (LDH), et l’oxydation finale du pyruvate par le cycle de Krebs dans les mitochondries. Le glucose, puisqu’il est épargné par les cellules tumorales oxydatives, est donc libre de diffuser jusqu’aux cellules tumorales glycolytiques où il est requis en abondance pour la production d’ATP par la glycolyse anaérobie. Il entre dans ces cellules par un glucose transporter (GLUT). Le lactate, produit final de la glycolyse, est ensuite exporté des cellules hypoxiques par le monocarboxylate transporter 4 (MCT4) et peut donc diffuser le long de son gradient de concentration jusqu’aux cellules tumorales oxygénées qu’il nourrit. Il est possible d’enrayer la symbiose métabolique en utilisant un bloqueur de MCT1 tel que l’α-cyano-4-hydroxycinnamate (CHC). Par un réarrangement métabolique complexe, l’inhibition de MCT1 convertit les cellules tumorales auparavant oxydatives en cellules tumorales glycolytiques, utilisant donc le glucose abondamment sans plus avoir besoin d’oxygène. En conséquence, les cellules tumorales hypoxiques meurent par privation de glucose et les cellules tumorales restantes, complètement oxygénées, peuvent être éradiquées à leur tour par un traitement de chimio- ou de radiothérapie. |
|
Les tumeurs recyclent le lactate La réponse à cette question, curieusement, nous l’avons trouvée en nous intéressant au lactate, le produit final de la glycolyse. Notre approche [
4] a été d’analyser le comportement métabolique de cellules tumorales en culture caractérisées les unes par un métabolisme respiratoire/oxydatif et les autres par un métabolisme entièrement glycolytique (glycolyse aérobie ou phénotype Warburg1 [
5]). La mesure enzymatique des concentrations de glucose et de lactate dans les milieux de culture des cellules et des mesures de la respiration cellulaire par résonance paramagnétique électronique (RPE) [
6] a révélé une conclusion inattendue : lorsqu’elles ont le choix, les cellules tumorales oxydatives préfèrent alimenter leur respiration avec du lactate plutôt qu’avec du glucose (Figure 2) [4]. Au contraire, les cellules tumorales glycolytiques sont incapables d’utiliser le lactate comme substrat alternatif : en l’absence de glucose, elles meurent. Le recyclage de l’énergie résiduelle contenue dans le lactate permet donc aux populations de cellules cancéreuses d’entrer en symbiose pour s’assurer un apport optimal en substrats énergétiques. En effet, l’utilisation préférentielle du lactate par les cellules oxydatives permet au glucose, qui reste disponible, de diffuser librement depuis les vaisseaux sanguins vers le compartiment tumoral hypoxique où les cellules, via la glycolyse, produisent du lactate ; celui-ci diffuse à son tour en sens inverse et nourrit les cellules oxydatives (Figure 2). Puisque l’hypoxie persiste au cours du développement d’une tumeur [
7], il est fort probable qu’il en aille de même du recyclage du lactate. Le lactate est un anion qui requiert une protéine de transport adéquate pour traverser la membrane plasmique. Dans le muscle, il existe des transporteurs du lactate de type monocarboxylate transporter (MCT) : MCT4 permet l’export du lactate produit par les fibres musculaires glycolytiques (celles qui exécutent l’exercice) et MCT1 permet l’entrée du lactate dans les fibres musculaires oxydatives [
8,
9]. Nous avons découvert que ce système, à l’instar d’autres systèmes physiologiques tels que l’angiogenèse, est usurpé par les cellules cancéreuses. Alors que les cellules tumorales glycolytiques expriment MCT4, les cellules tumorales oxydatives expriment MCT1 (Figure 2) [4]. |
Inhiber le recyclage du lactate affame les cellules tumorales hypoxiques jusqu’à la mort Compte tenu de l’importance du mécanisme de recyclage du lactate pour la croissance des tumeurs, nous avons développé une stratégie thérapeutique destinée à le corrompre. Notre approche a consisté à bloquer MCT1 au moyen soit d’un inhibiteur pharmacologique sélectif, l’α-cyano-4-hydroxycinnamate (CHC), soit de petits ARN interférents (siARN) ciblant spécifiquement l’ARNm de MCT1 [4]. Les deux approches ont eu pour effet d’empêcher l’import de lactate par les cellules tumorales oxydatives ; celles-ci, via un processus métabolique complexe, modifient leur comportement et utilisent alors la glycolyse aérobie comme nouveau mode de production d’énergie (Figure 2). En termes moléculaires, les cellules qui auparavant consommaient du lactate pour alimenter la voie oxydative deviennent donc particulièrement avides de glucose et n’utilisent plus d’oxygène. Ce « switch » a deux conséquences majeures : premièrement, les cellules tumorales hypoxiques n’ont plus accès à suffisamment de glucose et meurent affamées, provoquant ainsi une régression tumorale chez l’animal ; deuxièmement, l’arrêt de toute « respiration » cellulaire tumorale induit une augmentation de l’oxygène disponible. Cette réoxygénation tumorale favorise l’efficacité de la radiothérapie puisque l’oxygène stabilise les dommages à l’ADN induits par les radiations ionisantes. Ainsi, la combinaison de l’inhibition de MCT1 (qui détruit les cellules hypoxiques résistantes à la radiothérapie) et de la radiothérapie (qui détruit les cellules oxygénées résistantes à l’inhibition de MCT1) permet d’inhiber la progression du processus cancéreux chez la souris. Une synergie équivalente peut être anticipée pour l’association inhibition de MCT1 et chimiothérapie. L’inhibition de MCT1 est une stratégie particulièrement fiable d’élimination des cellules tumorales hypoxiques. Elle répond à un véritable besoin clinique puisque ces cellules sont à l’origine de la dissémination métastatique et responsables de la rechute de certains cancers après un traitement conventionnel. L’existence d’isoformes alternatives de MCT dans les tissus périphériques laisse anticiper une faible toxicité de cette nouvelle stratégie anticancéreuse [8–
10]. |
Olivier Feron est Maître de Recherches et Pierre Sonveaux et Bénédicte Jordan sont Chercheurs Qualifiés du Fonds National de la Recherche Scientifique (F.R.S.-FNRS). Financement : F.R.S.-FNRS, Communauté française de Belgique (ARC 04/09-317), Région Wallonne de Belgique (programme NEOANGIO), Fondations J. Maisin et St Luc. Les recherches résumées ici ont été effectuées en collaboration avec l’équipe du Professeur Mark W. Dewhirst (Duke University, Caroline du Nord, USA).
|
Footnotes |
1. Harris AL. Hypoxia: a key regulatory factor in tumour growth. Nat Rev Cancer 2002; 2 : 38–47. 2. Dang CV, Semenza GL. Oncogenic alterations of metabolism. Trends Biochem Sci 1999; 24 : 68–72. 3. Semenza GL, Artemov D, Bedi A, et al. ‘The metabolism of tumours’: 70 years later. Novartis Found Symp 2001; 240 : 251–60. 4. Sonveaux P, Vegran F, Schroeder T, et al. Targeting lactate-fueled respiration selectively kills hypoxic tumor cells in mice. J Clin Invest 2008; 118 : 3930–42. 5. Warburg O. The metabolism of tumors. London : Constable, 1930 : 328 p. 6. Gallez B, Baudelet C, Jordan BF. Assessment of tumor oxygenation by electron paramagnetic resonance: principles and applications. NMR Biomed 2004; 17 : 240–62. 7. Hanahan D, Weinberg RA. The hallmarks of cancer. Cell 2000; 100 : 57–70. 8. Halestrap AP, Price NT. The proton-linked monocarboxylate transporter (MCT) family: structure, function and regulation. Biochem J 1999; 343 : 281–99. 9. Halestrap AP, Meredith D. The SLC16 gene family-from monocarboxylate transporters (MCTs) to aromatic amino acid transporters and beyond. Pflug Arch 2004; 447 : 619–28. 10. Merezhinskaya N, Fishbein WN, Davis JI, et al. Mutations in MCT1 cDNA in patients with symptomatic deficiency in lactate transport. Muscle Nerve 2000; 23 : 90–7. |