| |
| Med Sci (Paris). 2009 February; 25(2): 161–167. Published online 2009 February 15. doi: 10.1051/medsci/2009252161.Interactions entre la Fibrilline-1 et le TGF-β Conséquences en pathologie humaine Julien Wipff,1,2* Yannick Allanore,1,2 and Catherine Boileau1,3 1Inserm U781, Université Paris Descartes, Hôpital Necker, 149, rue de Sèvres, 75015 Paris, France. 1Service de Rhumatologie A, Université Paris Descartes, Hôpital Cochin, AP-HP, 27, rue du Faubourg Saint Jacques, 75014 Paris, France 2Laboratoire de Biochimie, d’Hormonologie et de Génétique Moléculaire, UVSQ, Hôpital Ambroise Paré, 92100 Boulogne-Billancourt, France |
Les protagonistes : Fibrilline-1 et TGF-β La Fibrilline-1 Le syndrome de Marfan (MFS) est une maladie orpheline (OMIM n° 154700) définie par les critères de Berlin révisés par De Paepe ; les principales caractéristiques sont la dolichosténomélie (membres disproportionnés par rapport au tronc), l’arachnodactylie, l’hypermobilité articulaire, la dilatation de l’aorte, les anomalies valvulaires et les ectopies cristalliniennes. Dès 1986, Sakaï et al. se sont intéressés à la zonule ciliaire de l’œil, attache du cristallin aux procès ciliaires (comprenant les muscles ciliaires, et dont la partie antérieure forme l’iris), dont les anomalies sont responsables des troubles de l’accommodation dans le syndrome de Marfan. Cette équipe a montré que cette zonule était constituée exclusivement de fibrilline 1 (FBN-1), ce qui faisait de cette protéine une candidate dans cette maladie [
1]. Quatre ans plus tard, une altération quantitative du réseau microfibrillaire était identifiée [
2]. Parallèlement, des études de liaison avaient permis de situer un locus d’intérêt dans le syndrome de Marfan sur le chromosome 15, en 15q15-q21.3, locus comprenant le gène FBN1 [
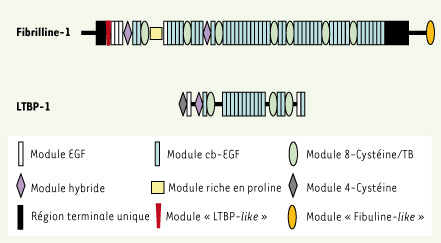
3]. La fibrilline-1 est une glycoprotéine qui appartient à une famille de protéines comprenant 3 membres : la fibrilline-1, la fibrilline-2 et la fibrilline-3. La protéine FBN-1 est codée par un gène situé dans la région 15q21.1 ; il s’étend sur 230 kb et comporte 65 exons, dont 4 exons non transcrits dans la région 5’ du gène (exons A, B, C et M). La première caractérisation de la protéine FBN-1, en 1986, montre sa large distribution tissulaire et fait suspecter son rôle clé dans la composition des microfibrilles [1]. La FBN-1 est une glycoprotéine de 330 kDa comprenant 2 871 acides aminés formant 59 domaines : 47 sont de type « EGF-like » (epidermal growth factor-like) dont 43 domaines cb-EGF (calcium binding-epidermal growth factor domains), 8 de type TB (TGF-β-binding) participant aux interactions protéine-protéine notamment avec la LTBP-1 (latent TGF-β-binding protein 1) ; 2 domaines hybrides combinent un domaine « EGF-like » et un domaine TB et enfin les domaines uniques amino- et carboxy-terminaux (Figure 1). La FBN-1 est une protéine ubiquitaire, mais principalement exprimée dans le muscle lisse et le placenta, sous une forme monomérique qui polymérise pour former les microfibrilles de 10 à 12 nm de diamètre. Les microfibrilles en microscopie électronique ont un aspect particulier dit en « collier de perle ». La régulation de la synthèse de FBN-1 reste mal connue. Récemment, un rôle direct du TGF-β, activant l’incorporation de FBN-1 dans le réseau matriciel sans augmenter sa synthèse par les fibroblastes, a été montré [
4]. Dans les microfibrilles, la FBN-1 est associée à de nombreuses autres protéines comme MAGP-1, MAGP-2, les fibulines 2 et 5, l’élastine, le versicane ou la LTBP-1. Ces microfibrilles participent à la constitution du tissu conjonctif divisé en tissu élastique et tissu non élastique (Figure 2).  | Figure 1.
La fibrilline-1 (FBN-1) est une protéine de 330 kDa comprenant 2 871 acides aminés formant 59 domaines. La LTBP-1 est une protéine matricielle liant le SLC (small latent complex) associant le TGF-β dimérique et le LAP (latency-associated protein) pour former le LLC (large latent complex). Il existe une homologie de séquence entre la FBN-1 et LTBP-1 plaidant pour un rôle du réseau microfibrillaire et en particulier de la FBN-1 dans l’homéostasie du TGF-β. |
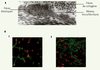 | Figure 2.
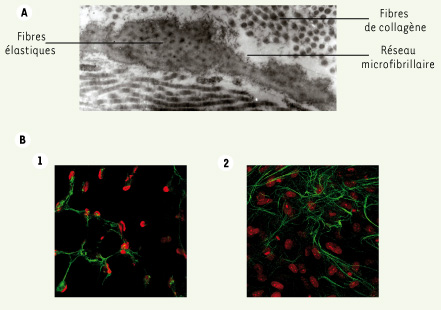
Le réseau fibrillaire. A. Visualisation par microscopie électronique du réseau microfibrillaire à partir d’une biopsie cutanée. Ce réseau forme une gangue autour des fibres élastiques pour former, ensemble, la matrice du tissu conjonctif élastique. B. Visualisation par immunofluorescence du réseau microfibrillaire au microscope confocal (x40).(1) Sans activation. (2) Après 5 jours d’exposition au TGF-β (10 ng/ml). |
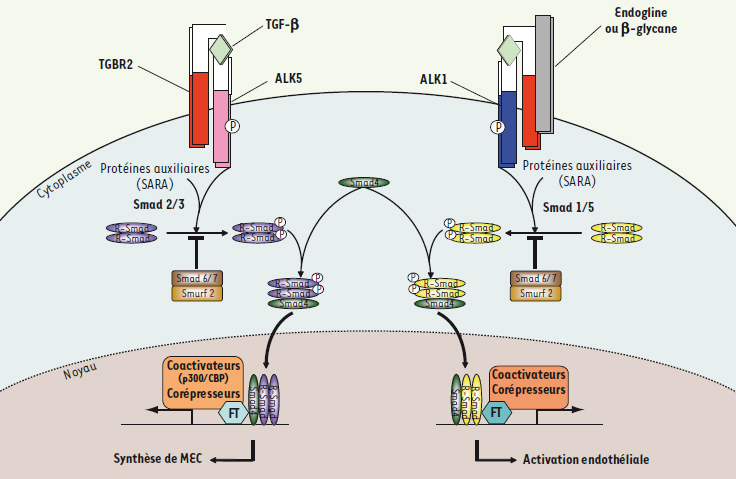
Le transforming growth factor-β Le TGF-β1 est le prototype des polypeptides appartenant à la superfamille qui porte le même nom. Celle-ci comporte de nombreux ligands classés en 3 groupes, les TGFβ, les BMP ( bone morphogenic protein) et les activines, et leurs récepteurs respectifs (TGBR, BMPR et ActR) (Figure 2). Chaque classe de récepteurs est subdivisée en deux sous-types : les récepteurs de type I (ALK1 à 7, ALK pour activin receptor-like kinase) et II (TGBRII, BMPRII, ActRII). Cette voie de signalisation se caractérise par une polyvalence entre ligands et récepteurs ; toutefois la séquence événementielle permettant la transduction du signal reste invariable nécessitant l’hétérodimérisation du récepteur de type II au récepteur de type I qui acquiert alors son pouvoir phosphorylant. Par ailleurs, il existe un troisième type de récepteurs, dits accessoires, qui favorisent le recrutement d’ALK1 ; ces récepteurs incluent l’endogline (ENG, ou CD105) et le β-glycane. En aval, la voie de signalisation du TGF-β implique essentiellement les Smad : la phosphorylation des R-Smad (Smad 1, 2, 3, 5 ou 8), préalablement recrutées par différentes protéines auxiliaires dont SARA (smad anchor for receptor activation), permet leur hétérodimérisation puis la formation d’un complexe transcriptionnel avec Smad4 qui migre dans le noyau. Le rétrocontrôle de cette voie est principalement assuré par la dégradation des R-Smad par le système ubiquitine/protéasome via l’action des Smad 6 et 7 ou de Smurf 2 (Smad ubiquitin regulatory factor) [
5]. Les R-Smad établissent schématiquement deux grandes voies : la voie Smad2/3 et la voie Smad1/5/8 (Figure 3). D’autres voies de signalisation comme celles faisant intervenir Erk, JNK, p38MAPK, Rho-like GTPase peuvent jouer un rôle dans la réponse au TGF-β. 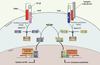 | Figure 3.
Schéma simplifié de la voie des Smad. Après la liaison du TGF-β avec son récepteur de type II, celui-ci s’hétérodimérise avec un récepteur de type I (ALK1 ou ALK5). Les R-Smad, recrutées par des protéines auxiliaires, vont alors être phosphorylées : Smad2/3 par ALK5 et Smad1/5 par ALK1. Ces R-Smad complexent Smad 4 puis migrent dans le noyau pour jouer leur rôle de facteur de transcription contrôlant l’expression des gènes matriciels pour la voie ALK5 et endothéliaux pour ALK1. |
Le TGF-β est une protéine comprenant 390 acides aminés, sécrétée sous deux formes : une forme dimérique inactive appelée SLC (small latent complex) comprenant une partie LAP (latency-associated propeptide) inactive et une partie TGF-β active, et une forme LLC (large latent complex) composée du SLC et de LTBP-1 (latent TGF-b-binding protein 1) liés de façon covalente. La libération du TGF-β actif est secondaire à un processus protéolytique complexe. Le TGF-β intervient chez l’adulte dans la prolifération cellulaire, l’angiogenèse et l’activation de la synthèse de la matrice extracellulaire (dont les constituants majeurs le collagène et la fibronectine sont synthétisés par les fibroblastes) [
6]. Interactions entre FBN-1, LTBP-1 et TGF-β La FBN-1 et le TGF-β interagissent par l’intermédiaire de la protéine LTBP-1. Cette dernière a été localisée dans la MEC au contact des microfibrilles et plus particulièrement de la FBN-1 [
7]. Il a, de plus, été démontré que l’interaction LTBP-1/FBN-1 se faisait par la région carboxy-terminale de la FBN-1 [ 7]. Cette liaison participerait à l’activation du TGF-β car des anticorps anti-LTBP-1 peuvent l’inhiber. L’hypothèse est donc que le LLC ne deviendrait sensible à la protéolyse, et donc à la libération de TGF-β actif, qu’après sa liaison à la MEC [
8]. |
Fibrilline-1, TGF-β et fibrillinopathies Les fibrillines sont impliquées dans plusieurs pathologies génétiques humaines à hérédité mendélienne : les fibrillinopathies. Les fibrillinopathies de type I sont principalement liées aux mutations hétérozygotes du gène FBN1 (le syndrome de Marfan, le syndrome de Shprintzen-Goldberg et le syndrome de Weill-Marchesani), mais également aux mutations de TGFBR1 et 2 dans le syndrome de Loeys-Dietz et aux mutations de FBN2 dans l’arachnodactylie congénitale contracturante (voir Glossaire). Fibrilline-1, TGF-β et syndrome de Marfan Depuis 1991 et la découverte des premières mutations de FBN1, plus de 1 300 mutations ont été décrites et sont répertoriées dans une base de données : Universal Mutations Database (UMD.be) [
9]. Ces mutations sont quasiment toujours spécifiques d’une famille. Les anomalies de la FBN-1 ne permettent pas d’expliquer certains traits caractéristiques (grande taille, grande envergure) ni la variabilité phénotypique observés dans le MFS, faisant suspecter l’intervention d’un autre facteur. Les premiers éléments évoquant un rôle du TGF-β sont issus de l’analyse d’un modèle murin (fbn1−/−
) [
10] présentant des anomalies vasculaires (anévrismes) et pulmonaires proches de celles rencontrées dans le MFS. Les anomalies de formation des septa alvéolaires distaux au stade postnatal précoce, sont, dans ce modèle, directement dépendantes du TGFβ car réversibles après l’administration d’anticorps anti-TGF-β [
11]. Par ailleurs, en 2004, un locus majeur appelé MFS2 a été localisé en 3p25-p24.2, permettant d’identifier le gène TGFBR2 (récepteur de type II du TGF-β) comme le deuxième gène impliqué dans la pathogénie du MFS [
12]. Un phénotype semblable résulte donc de mutations des gènes FBN1 et TGFBR2. Enfin, le syndrome de Loeys-Dietz, caractérisé par des habitus marfanoïdes, dont l’anévrisme de l’aorte ascendante, est lié à des mutations inactivatrices des gènes TGFBR2 et TGFBR1 [
13]. Ces mutations ont un retentissement fonctionnel paradoxal inexpliqué avec une activation de la voie du TGF-β dans les parois aortiques de ces patients [13]. Fibrilline-1, TGF-β et sclérodermie systémique La sclérodermie systémique (ScS) se caractérise essentiellement par une fibrose généralisée vasculaire et tissulaire touchant la peau et différents organes. L’association d’évènements environnementaux sur un fond génétique particulier apparaît nécessaire pour le développement de la ScS. Dans les maladies multifactorielles comme la ScS, chaque facteur génétique impliqué a un impact mineur, insuffisant pour provoquer à lui seul l’apparition de la pathologie. C’est l’addition de plusieurs facteurs génétiques ainsi que d’éléments environnementaux extérieurs, qui conditionnent l’expression du phénotype de la maladie, et font de la ScS une maladie génétique complexe [
16]. Dans ce contexte, un haplotype de la région 5’ UTR du gène FBN1 est lié à la ScS dans des études d’association réalisées chez des patients Choctaws (tribu amérindienne vivant dans le sud-est des États-Unis) et Japonais. Cependant, notre étude d’une large une cohorte de patients caucasiens n’a pas permis de confirmer cette association [
17]. Modèles animaux Le modèle animal de ScS le plus étudié est la souris « Tight skin 1 ». Le phénotype des souris hétérozygotes Tsk1+/−
(fibrose, dysimmunité mais sans atteinte vasculaire) est dû à une duplication partielle en phase des exons 17 à 40 du gène Fbn1, aboutissant à la synthèse d’une protéine dont le poids moléculaire est augmenté. McGaha et al., en créant des souris double transgéniques Tsk1+/−
x TGFb1
+/− dont la fibrose cutanée est réduite [
14], soulignent le rôle du TGF-β dans la fibrose de la souris Tsk1. Récemment, la surexpression de TGFBRI dans une souris transgénique entraînant une fibrose cutanée et des anomalies vasculaires proches de celles qui caractérisent la ScS, confirme l’implication de cette voie [
15]. Peu de travaux ont porté sur l’analyse protéique mais une instabilité de la protéine FBN-1 et des microfibrilles chez les patients ScS ainsi que chez leurs apparentés au premier degré a été suggérée [
18]. Par ailleurs, des auto-anticorps dirigés contre la fibrilline-1 ont été décrits chez les patients ScS ; ceux-ci auraient la capacité d’induire un phénotype profibrotique dans des fibroblastes [
19]. Dans la ScS, plusieurs arguments plaident pour une activation de la voie du TGF-β. Les taux sériques et tissulaires de TGFβ1 sont augmentés [
20,
21]. De plus, dans les fibroblastes de patients, l’expression de TGFBRI (ALK5) semble également augmentée [
22], ainsi que celle des Smad 2 et 3 phosphorylées au contraire de Smad 7, qui serait diminuée [
23]. Plusieurs études à partir de modèles animaux ont démontré l’intérêt de neutraliser l’action du TGF-β pour bloquer le processus fibrosant. Un essai thérapeutique randomisé de phase II a été réalisé chez 43 patients atteints de ScS, qui ont reçu des anticorps anti-TGF-β (CAT-192) ou un placebo. La tolérance a été satisfaisante mais aucune réduction de la fibrose dermique n’a été observée [
24]. Cependant, la spécificité de CAT-192 semble discutée et de nouveaux essais sont envisagés avec de nouveaux anticorps monoclonaux plus spécifiques du TGF-β. La physiopathologie des fibrillinopathies et de la ScS fait intervenir des perturbations dans les interactions entre le TGF-β et la FBN-1 qui conduisent à l’activation de la voie de signalisation du TGF-β (Figure 4). Toute altération du réseau microfibrillaire pourrait modifier en partie son rôle de régulation du TGF-β. L’altération de la liaison entre la MEC et le TGF-β, nécessaire à l’activation de ce dernier, semble exclue car elle conduirait à une inhibition du TGF-β [9]. En revanche, les altérations pourraient concerner le relargage protéolytique du TGF-β à partir de la MEC, secondaire à un remodelage matriciel accru ou un défaut qualitatif des microfibrilles. 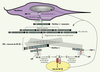 | Figure 4.
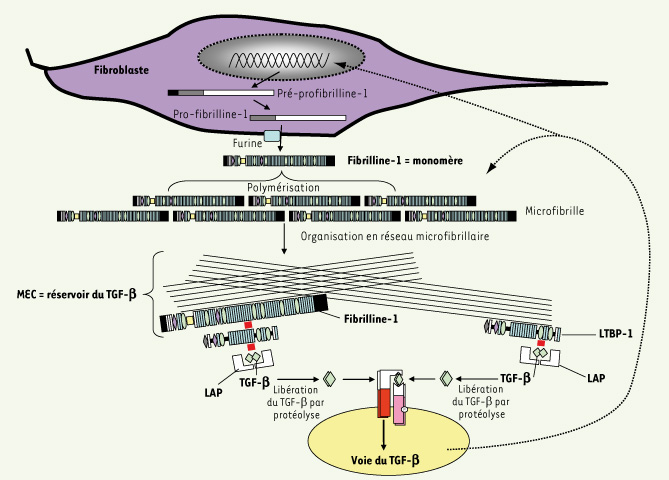
Interaction FBN-1/TGF-β. Après avoir été synthétisée par le fibroblaste, la FBN-1 est sécrétée dans le milieu sous une forme monomérique qui va se polymériser, les monomères étant décalés les uns par rapport aux autres et en partie repliés sur eux-mêmes pour former la microfibrille de 10-12 nm. Ces microfibrilles constituent le réseau microfibrillaire. Ce réseau, du fait de l’interaction entre FBN-1 et LTBP-1, sert de réservoir au TGF-β inclus dans le LLC. Le TGF-β a, en retour, une action probable sur la FBN-1, principalement sur l’incorporation de celle-ci dans le réseau microfibrillaire. |
|
Pathologies liées à des anomalies de la voie de signalisation du TGF-β Les arguments évoqués ci-dessus sont en faveur d’un rôle clé du réseau microfibrillaire et du TGF-β dans les fibrillinopathies d’origine mendélienne comme le MFS, ou multifactorielle comme la ScS. On peut ainsi suspecter des interactions fortes entre FBN-1 et TGF-β sur les arguments suivants : (1) une activation du TGF-β explique une partie du phénotype d’un modèle animal de MFS ; (2) des mutations dans les gènes FBN1 et TGFBR2 sont responsables du MFS, (3) l’inhibition du TGF-β dans un modèle murin de ScS lié à une mutation du gène fbn1 minimise la fibrose cutanée. Dans ces pathologies, la conséquence de l’interaction FBN-1-TGF-β serait une activation du signal TGF-β. Les études des MFS TGFBR2 et du syndrome de Loeys-Dietz confèrent à l’activation de la voie du TGF-β un rôle central dans la pathogénie des anévrismes de l’aorte. Par ailleurs, les télangiectasies font partie du tableau clinique de la ScS et de la maladie de Rendu-Osler, cette dernière impliquant les 2 gènes ALK1 et ENG (endoglin for Osler-Rendu-Weber syndrome 1), qui codent pour des récepteurs au TGF-β. Dans les formes familiales et idiopathiques de l’hypertension artérielle pulmonaire (HTAP), une complication sévère de la ScS, des mutations de BMPR2 ont été rapportées [
25]. L’étude d’une insertion dans l’intron 7 du gène ENG a permis de détecter une association chez les patients ScS ayant une HTAP [
26]. Cette étroite relation entre TGF-β et FBN-1 incite à réfléchir à un nouveau cadre nosologique plus large qui ferait du TGF-β le principal protagoniste d’un concept de « signalopathies » TGF-β [
27]. Cette nouvelle approche nosologique souligne l’importance du rôle fonctionnel de la MEC comme réservoir dynamique du TGF-β (Figure 4). Elle suggère également que la signalisation TGF-β pourrait représenter une nouvelle cible thérapeutique, alors que la stratégie thérapeutique dans les fibrillinopathies était focalisée avant tout sur la correction du défaut matriciel causal. Récemment, Habashi et al. ont démontré l’efficacité du losartan pour prévenir le développement de l’anévrisme aortique dans un modèle animal de MFS (Fbn1
C1039G/+) [
28]. Le mécanisme par lequel le losartan, antagoniste du récepteur de type I de l’angiotensine II (Ang II), freine le TGF-β reste incertain. Néanmoins, l’activation du TGF-β par Ang II et son rôle dans le remodelage vasculaire [
29] et dans certains modèles expérimentaux de néphropathies [
30] sont bien établis. Ces études démontrent l’intérêt d’un ciblage des voies de signalisation du TGF-β dans les pathologies matricielles. Les pathologies évoquées ci-dessus partagent ainsi une dérégulation, primitive ou indirecte, de l’activation du TGF-β modulée par le réseau microfibrillaire et la FBN-1 : ce concept de « signalopathies TGF-β » ouvre de nouvelles perspectives thérapeutiques.

|
Nous tenons à remercier pour son aide financière l’Agence Nationale pour la Recherche (Grant number R07094KS), l’Association des Sclérodermiques de France et la Société Française de Rhumatologie. Ce travail a été soutenu par le Groupe Français de Recherche sur la Sclérodermie. Nous remercions également Mme Desbas pour son expertise secrétariale.
|
1. Sakai LY, Keene DR, Engvall E. Fibrillin, a new 350-kDa glycoprotein, is a component of extracellular microfibrils. J Cell Biol 1986; 103 : 2499–509. 2. Hollister DW, Godfrey M, Sakai LY, Pyeritz RE. Immunohistologic abnormalities of the microfibrillar-fiber system in the Marfan syndrome. N Engl J Med 1990; 323 : 152–9. 3. Magenis RE, Maslen CL, Smith L, et al. Localization of the fibrillin (FBN) gene to chromosome 15, band q21.1. Genomics 1991; 11 : 346–51. 4. Kissin EY, Lemaire R, Korn JH, Lafyatis R. Transforming growth factor beta induces fibroblast fibrillin-1 matrix formation. Arthritis Rheum 2002; 46 : 3000–9. 5. Itoh S, ten Dijke P. Negative regulation of TGF-beta receptor/Smad signal transduction. Curr Opin Cell Biol 2007; 19 : 176–84. 6. Ignotz RA, Massague J. Transforming growth factor-beta stimulates the expression of fibronectin and collagen and their incorporation into the extracellular matrix. J Biol Chem 1986; 261 : 4337–45. 7. Isogai Z, Ono RN, Ushiro S, et al. Latent transforming growth factor beta-binding protein 1 interacts with fibrillin and is a microfibril-associated protein. J Biol Chem 2003; 278 : 2750–7. 8. Nunes I, Gleizes PE, Metz CN, Rifkin DB. Latent transforming growth factorb binding protein domains involved in activation and transglutaminase-dependent cross-linking of latent transforming growth factorb. J Cell Biol 1997; 136 : 1151–63. 9. Collod-Beroud G, Le Bourdelles S, Ades L, et al. Update of the UMD-FBN1 mutation database and creation of an FBN1 polymorphism database. Hum Mutat 2003; 22 : 199–208. 10. Pereira L, Andrikopoulos K, Tian J, et al. Targetting of the gene encoding fibrillin-1 recapitulates the vascular aspect of Marfan syndrome. Nat Genet 1997; 17 : 218–22. 11. Neptune ER, Frischmeyer PA, Arking DE, et al. Dysregulation of TGF-beta activation contributes to pathogenesis in Marfan syndrome. Nat Genet 2003; 33 : 407–11. 12. Mizuguchi T, Collod-Beroud G, Akiyama T, et al. Heterozygous TGFBR2 mutations in Marfan syndrome. Nat Genet 2004; 36 : 855–60. 13. Loeys BL, Chen J, Neptune ER, et al. A syndrome of altered cardiovascular, craniofacial, neurocognitive and skeletal development caused by mutations in TGFBR1 or TGFBR2. Nat Genet 2005; 37 : 275–81. 14. McGaha T, Saito S, Phelps RG, et al. Lack of skin fibrosis in tight skin (TSK) mice with targeted mutation in the interleukin-4R alpha and transforming growth factor-beta genes. J Invest Dermatol 2001; 116 : 136–43. 15. Sonnylal S, Denton CP, Zheng B, et al. Postnatal induction of transforming growth factor beta signaling in fibroblasts of mice recapitulates clinical, histologic, and biochemical features of scleroderma. Arthritis Rheum 2007; 56 : 334–44. 16. Allanore Y, Wipff J, Kahan A, Boileau C. Genetic basis of systemic sclerosis. Joint Bone Spine 2007; 74 : 577–83. 17. Wipff J, Giraud M, Sibilia J, et al. Polymorphic markers of the fibrillin-1 gene and systemic sclerosis in European Caucasian patients. J Rheumatol 2008; 4 : 643–9. 18. Wallis DD, Tan FK, Kessler R, et al. Fibrillin 1 abnormalities in dermal fibroblast cultures from first-degree relatives of patients with systemic sclerosis (scleroderma). Arthritis Rheum 2004; 50 : 329–32. 19. Tan FK, Arnett FC, Antohi S, et al. Autoantibodies to the extracellular matrix microfibrillar protein, fibrillin-1, in patients with scleroderma and other connective tissue diseases. J Immunol 1999; 163 : 1066–72. 20. Snowden N, Coupes B, Herrick A, et al. Plasma TGF beta in systemic sclerosis: a cross-sectional study. Ann Rheum Dis 1994; 53 : 763–7. 21. Coker RK, Laurent GJ, Jeffery PK, et al. Localisation of transforming growth factor beta1 and beta3 mRNA transcripts in normal and fibrotic human lung. Thorax 2001; 56 : 549–56. 22. Pannu J, Gore-Hyer E, Yamanaka M, et al. An increased transforming growth factor beta receptor type I:type II ratio contributes to elevated collagen protein synthesis that is resistant to inhibition via a kinase-deficient transforming growth factor beta receptor type II in scleroderma. Arthritis Rheum 2004; 50 : 1566–77. 23. Dong C, Zhu S, Wang T, et al. Deficient Smad7 expression: a putative molecular defect in scleroderma. Proc Natl Acad Sci USA 2002; 99 : 3908–13. 24. Denton CP, Merkel PA, Furst DE, et al. Recombinant human anti-transforming growth factor beta1 antibody therapy in systemic sclerosis: a multicenter, randomized, placebo-controlled phase I/II trial of CAT-192. Arthritis Rheum 2007; 56 :323–33. 25. Sztrymf B, Yaici A, Girerd B, Humbert M. Genes and pulmonary hypertension. Respiration 2007; 74 : 123–32. 26. Wipff J, Kahan A, Hachulla E, et al. Association between an endoglin gene polymorphism and systemic sclerosis-related pulmonary arterial hypertension. Rheumatology (Oxford) 2007; 46 : 622–5. 27. Boileau C, Jondeau G, Mizuguchi T, Matsumoto N. Molecular genetics of Marfan syndrome. Curr Opin Cardiol 2005; 20 : 194–200. 28. Habashi JP, Judge DP, Holm TM, et al. Losartan, an AT1 antagonist, prevents aortic aneurysm in a mouse model of Marfan syndrome. Science 2006; 312 : 117–21. 29. Michel JB. Système rénine-angiotensine et remodelage vasculaire. Med Sci (Paris) 2004; 20 : 409–13. 30. Campistol JM, Inigo P, Larios S, et al. Role of transforming growth factor-beta 1 in the progression of chronic allograft nephropathy. Nephrol Dial Transplant 2001; 16 (suppl 1) : 114–6. |