| |
| Med Sci (Paris). 2009 February; 25(2): 141–144. Published online 2009 February 15. doi: 10.1051/medsci/2009252141.Rôles des récepteurs nucléaires des oxystérols LXR dans la physiologie de la reproduction Kevin Mouzat,1 Georges Alves, Aurélien Pommier, Émilie Viennois, Thomas Pihen, Françoise Caira, Silvère Baron, and Jean-Marc A. Lobaccaro* Clermont Université, UMR « Génétique, Reproduction et Développement » ; CNRS UMR 6247 ; Inserm U931 ; LXR, oxystérols et tissus stéroïdogènes et Centre de Recherche en Nutrition Humaine d’Auvergne ; 24, avenue des Landais, 63177 Aubière Cedex, France 1Service de Biochimie, CHU de Nîmes et Faculté de Médecine de Montpellier-Nîmes, France MeSH keywords: Animaux, Cycle cellulaire, Protéines de liaison à l'ADN, Métabolisme énergétique, Épididyme, Femelle, Fécondité, Humains, Immunité, Infertilité féminine, Mâle, Souris, Récepteurs nucléaires orphelins, Récepteurs cytoplasmiques et nucléaires, Reproduction, Transcription génétique, Utérus |
Au début des années 1990, la découverte de très nombreux récepteurs nucléaires dits « orphelins », car aucun ligand n’avait encore été identifié, a ouvert la voie à la notion d’endocrinologie inverse où la mise en évidence de la fonction physiologique de la protéine est postérieure à la découverte de la protéine et celle de son ligand. Par la suite, la synthèse de molécules non métabolisables modulant l’activité transcriptionnelle de ces récepteurs nucléaires « orphelins-adoptés » a ouvert des perspectives intéressantes quant à leur utilisation en pathologie. Les LXR (liver X receptors) font partie de ces récepteurs nucléaires orphelins-adoptés dont l’intérêt pharmacologique n’a cessé de croître ces dernières années devant leur potentiel thérapeutique. Cependant, leur implication récente dans la régulation des fonctions de reproduction chez le mâle et la femelle oblige à beaucoup de prudence quant à une utilisation prochaine dans le traitement de certaines dyslipidémies. |
Les LXR, des récepteurs nucléaires activés par des dérivés du cholestérol Les récepteurs LXR sont des facteurs de transcription activables par des molécules dérivées directement du cholestérol, les oxystérols, et font partie des récepteurs nucléaires qui forment des hétérodimères avec RXR, le récepteur de l’acide rétinoïque 9-cis [
1]. Il existe deux isoformes LXRα (NR1H3) et LXRβ (NR1H2) provenant chacune de deux gènes distincts localisés respectivement sur les chromosomes 11p11.2 et 19q13.3 chez l’homme. Si l’expression de LXRβ est ubiquiste, LXRα est plutôt exprimé dans les organes présentant un fort métabolisme lipidique comme les tissus adipeux et les organes stéroïdogènes. En l’absence de ligand Canoniquement, les LXR sont des protéines acétylées, fixées sur l’ADN avec leur partenaire RXR ( Figure 1, étape 1) et leur capacité de transcription est inhibée par la présence de co-répresseurs, comme N-CoR ( Nuclear receptor co-repressor) et SMRT ( silencing mediator for RAR and TR) qui contactent à la fois directement et indirectement des histones déacétylases via des protéines de type Sin3. La chromatine est ainsi maintenue dans un état de condensation non permissif pour la transcription. La présence constitutive sur l’ADN des complexes RXR/LXR-co-répresseur-HDAC agit donc comme un répresseur basal de l’expression génique comme le montre la levée de la répression basale de certains gènes cibles dans les souris lxrα;β−/−
(pour une revue [ 1]).  | Figure 1.
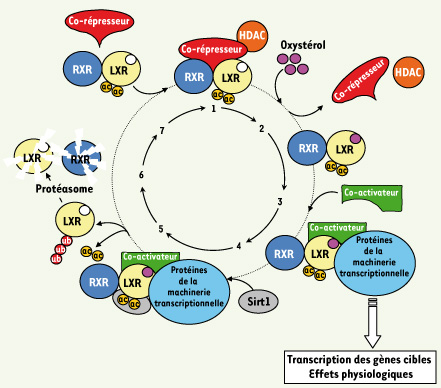
Représentation schématique du cycle d’activation/inhibition de l’hétérodimère RXR-LXR. En l’absence de ligand, l’hétérodimère RXR-LXR recrûte des co-represseurs transcriptionnels. La fixation du ligand (ne sont représentés que la poche de liaison du ligand de LXR et les oxystérols) entraîne le départ des co-répresseur et l’arrivée de protéines co-activatrices et des éléments basaux de la machinerie transriptionnelle. In fine, la réponse physiologique est activée. Le rôle de la sirtuine Sirt1 est de déacétyler LXR, d’entraîner son ubiquitination et sa dégradation via le protéasome. Par la suite un nouvel hétérodimère se place sur l’élément de réponse à LXR. Pour plus de détails voir le texte. Ac, acétylation ; Ub, ubiquitine. |
En présence de ligand Malgré une grande variabilité dans la séquence primaire des récepteurs nucléaires, les analyses cristallographiques montrent que tous les domaines de liaison du ligand ont une structure tridimensionnelle identique, composée de 11 à 13 hélices alpha arrangées en trois couches organisant une poche hydrophobe dans laquelle le ligand de nature lipophile peut venir se fixer. La liaison de l’hormone (étape 2) entraîne une modification tridimensionnelle de la poche hydrophobe et le départ des co-répresseurs. Ce réarrangement permet la libération de l’hélice 12, agissant ainsi comme un « couvercle » qui scelle la poche en renforçant les interactions entre le ligand et la poche hydrophobe et la fixation de co-activateurs (étape 3). Cette cascade d’événements provoque un environnement chromatinien permissif pour la transcription par le recrutement de protéines à activités histone acétyl-transférases comme SRC-1, la mobilisation de facteurs affectant la méthylation des histones comme Rap250 et/ou la fixation des protéines de la machinerie transcriptionnelle de base, la transcription des gènes cibles et la réponse physiologique cellulaire. De façon intéressante, la fixation concomittante de la sirtuine 1 (étape 4) provoque la déacétylation de LXR, son ubiquitinylation (étape 5), le routage vers le protéasome et sa dégradation (étape 6). Par la suite, deux nouvelles protéines RXR et LXR néosynthétisées s’hétérodimérisent en solution par leur domaine de liaison du ligand (étape 7) et le complexe reconnaît les éléments de réponse sur l’ADN. Au-delà de cette description schématique, l’activité transcriptionnelle des récepteurs LXR peut aussi être modulée par une SUMOylation, des phosphorylations, la compétition sur les sites de fixation avec d’autres récepteurs nucléaires ou pour la dimérisation avec RXR comme PPARα. |
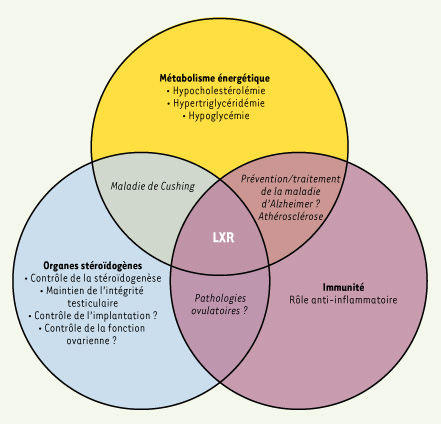
Les fonctions physiologiques régulées par les LXR Ces dernières années, la recherche des gènes cibles des LXR a permis de les associer à de nombreuses fonctions physiologiques. C’est incontestablement la disponibilité des souris dont les gènes codant chacune des deux isoformes ont été invalidés et le développement d’agonistes synthétiques non métabolisables qui ont fait augmenter de façon quasi-exponentielle le nombre de gènes cibles. Schématiquement trois fonctions physiologiques ont été associées aux LXR (Figure 2).  | Figure 2.
Synthèse du rôle des LXR dans la physiologie. Le rôle des LXR dans le contrôle des métabolismes lipidique et glucidique a été le plus étudié depuis leurs découvertes. Cependant, de plus en plus d’études récentes tendent à associer ces récepteurs nucléaires à d’autres fonctions physiologiques. La compréhension des mécanismes d’action et du rôle précis des LXR dans la physiologie générale de l’organisme aidera à terme à développer des molécules modulatrices utilisables dans la prévention et le traitement de nombreuses pathologies. |
Le métabolisme énergétique Les LXR sont hypocholestérolémiants par l’augmentation du catabolisme hépatique : régulation transcriptionnelle de certaines protéines ABC ( ATP-binding cassettes) impliquées dans le retour hépatique du cholestérol, d’apolipoprotéines et augmentation des enzymes contrôlant la synthèse des acides biliaires comme cyp7a1 [
2]. Ce rôle est le plus étudié, et tous les efforts des compagnies pharmaceutiques visent à activer cette fonction, et ce d’autant plus que l’activation des LXR est associée à une diminution du glucose circulant via l’induction de Glut4. À ce jour, ce qui bloque l’utilisation d’agonistes synthétiques des LXR in vivo, c’est le caractère hypertriglycéridémiant des LXR ; en effet les gènes acc, fas et scd-1, codant des enzymes du métabolisme des triglycérides, sont des cibles transcriptionnelles de RXR-LXR, de même que la protéine SREBP1c, véritable chef d’orchestre de la synthèse des acides gras [
3]. Le véritable défi des compagnies pharmaceutiques sera d’identifier des molécules dissociant les effets hypocholestérolémiant et hypertriglycéridémiant. L’immunité Les LXR jouent un rôle important dans la physiologie du macrophage. L’activation des LXR par un agoniste synthétique diminue la production de nitrites induite par une infection bactérienne ou des lipopolysacharides [
4], l’expression des gènes codant les facteurs pro-inflammatoires COX-2 ( cyclooxygenase-2), iNOS ( nitric oxide synthase), IL (interleukine)-1β et IL-6. De plus, les agonistes des LXR réduisent la réponse inflammatoire associée à une dermatite de contact induite chez la souris, confirmant le rôle anti-inflammatoire des LXR in vivo. De nombreuses études réalisées sur des modèles murins de la maladie d’Alzheimer ont montré que l’activation pharmacologique des LXR s’accompagnait d’une disparition des signes cellulaires de cette pathologie, comme la diminution des plaques amyloïdes ou de la neuroinflammation. L’homéostasie des tissus stéroïdogènes et des organes cibles des stéroïdes L’analyse phénotypique des tissus stéroïdogènes des souris lxr−/−
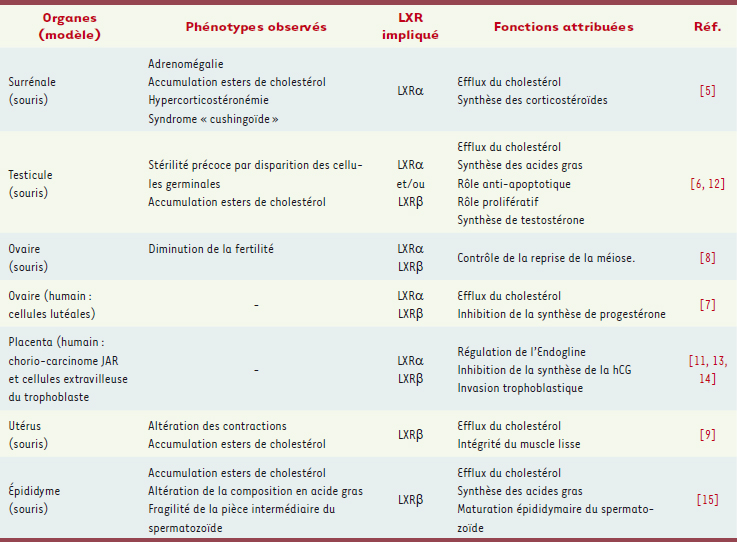
a identifié différentes anomalies révélant le rôle physiologique des LXR dans ces organes et permettant l’identification de nombreuses cibles transcriptionnelles. Chez l’homme, ce sont les analyses conjointes de recherche de gènes par bioinformatique et l’utilisation d’agonistes synthétiques qui ont identifié les fonctions physiologiques potentielles des LXR. Un résumé de ces fonctions est présenté sur le Tableau I.  | Tableau I.
Fonctions physiologiques des différentes isoformes des LXR dans les organes stéroïdogènes ou cibles des stéroïdes.
|
Schématiquement, les LXR régulent l’homéostasie lipidique et la synthèse hormonale des stéroïdes dans la plupart des organes analysés, que ce soit en augmentant la synthèse des corticostéroïdes dans la surrénale ou des androgènes dans le testicule, et ce en activant directement les gènes clés de ces synthèses comme StAR [
5,
6] ou en diminuant celle de la progestérone en favorisant l’efflux de cholestérol [
7]. Par delà ce « simple » contrôle de la biosynthèse et du catabolisme des lipides, les LXR ont aussi une activité anti-apoptotique et prolifératrice permettant la gestion efficace du pool de cellules germinales du testicule. Une des observations importantes de ces travaux est que les souris lxr−/−
deviennent ainsi de bons modèles pour appréhender des situations complexes comme le syndrome de Cushing [5], la stérilité chez l’homme [6] et la femme [
8], l’effet de l’obésité et du surpoids dans la parturition [
9] et la pré-éclampsie [
10,
11]. |
Les LXR, des cibles thérapeutiques prometteuses ? Il est incontestable que les LXR sont des cibles pharmacologiques de choix dans le traitement des hypercholestérolémies dès que cet effet sera dissocié de leur effet hépatique sur la synthèse des triglycérides, en utilisant des molécules qui ne ciblent pas le foie et/ou qui n’activent pas les gènes de cette synthèse. Cependant, on ne pourra passer sous silence les effets stéroïdogènes majeurs des LXR, en particulier sur la testostérone. En effet à l’âge où seront traités les patients, on ne peut exclure le rôle délétère d’une augmentation des stéroïdes sur le déclenchement éventuel d’un cancer hormono-dépendant (sein ou prostate). |
Une partie des projets de recherche est financée par le Centre National de la Recherche Scientifique, l’Institut National de la Santé et de la Recherche Médicale, l’Université Blaise Pascal, l’Université d’Auvergne, la Fondation pour la Recherche Médicale INE2000-407031/1 et la Fondation BNP-Paribas. K.M. a été allocataire du Ministère de l’Enseignement Supérieur et de la Recherche.
|
1. Volle DH, Lobaccaro JM. Role of the nuclear receptors for oxysterols LXRs in steroidogenic tissues: beyond the « foie gras », the steroids and sex ? Mol Cell Endocrinol 2007; 265-266 : 183–9. 2. Peet DJ, Turley SD, Ma W, et al. Cholesterol and bile acid metabolism are impaired in mice lacking the nuclear oxysterol receptor LXR alpha. Cell 1998; 93 : 693–704. 3. Repa JJ, Liang G, Ou J, et al. Regulation of mouse sterol regulatory element-binding protein-1c gene (SREBP-1c) by oxysterol receptors, LXRalpha and LXRbeta. Genes Dev 2004; 14 : 2819–30. 4. Joseph SB, Castrillo A, Laffitte BA, et al. Reciprocal regulation of inflammation and lipid metabolism by liver X receptors. Nat Med 2003; 9 : 213–9. 5. Cummins CL, Volle DH, Zhang Y, et al. Liver X receptors regulate adrenal cholesterol balance. J Clin Invest 2006; 116 : 1902–12. 6. Volle DH, Mouzat K, Duggavathi R, et al. Multiple roles of the nuclear receptors for oxysterols liver X receptor to maintain male fertility. Mol Endocrinol 2007; 21 : 1014–27. 7. Drouineaud V, Sagot P, Garrido C, et al. Inhibition of progesterone production in human luteinized granulosa cells treated with LXR agonists. Mol Hum Reprod 2007; 13 : 373–9. 8. Steffensen KR, Robertson K, Gustafsson JA, Andersen CY. Reduced fertility and inability of oocytes to resume meiosis in mice deficient of the Lxr genes. Mol Cell Endocrinol 2006; 256 : 9–16. 9. Mouzat K, Prod’homme M, Volle DH, et al. Oxysterol nuclear receptor LXRbeta regulates cholesterol homeostasis and contractile function in mouse uterus. J Biol Chem 2007; 282 : 4693–701. 10. Marceau G, Volle DH, Gallot D, et al. Placental expression of the nuclear receptors for oxysterols LXRalpha and LXRbeta during mouse and human development. Anat Rec A Discov Mol Cell Evol Biol 2005; 283 : 175–81. 11. Henry-Berger J, Mouzat K, Baron S, et al. Endoglin (CD105) expression is regulated by the liver X receptor alpha (NR1H3) in human trophoblast cell line JAR. Biol Reprod 2008; 78 : 968–75. 12. Robertson KM, Schuster GU, Steffensen KR, et al. The liver X receptor-(beta) is essential for maintaining cholesterol homeostasis in the testis. Endocrinology 2005; 146 : 2519–30. 13. Pavan L, Hermouet A, Tsatsaris V, et al. Lipids from oxidized low-density lipoprotein modulate human trophoblast invasion: involvement of nuclear liver X receptors. Endocrinology 2004 145:4583–91. 14. Weedon-Fekjaer MS, Duttaroy AK, Nebb HI. Liver X receptors mediate inhibition of hCG secretion in a human placental trophoblast cell line. Placenta 2005; 26 : 721–8. 15. Saez F, Chabory E, Cadet R, et al. Liver X receptors and epididymal epithelium physiology. Asian J Androl 2007; 9 : 574–82. |