| |
| Med Sci (Paris). 2009 February; 25(2): 125–127. Published online 2009 February 15. doi: 10.1051/medsci/2009252125.Les nanotubes de carbone : un nouvel outil contre le cancer Alberto Bianco* CNRS, Institut de Biologie Moléculaire et Cellulaire, UPR 9021, Immunologie et Chimie Thérapeutiques, IBMC, 15, rue R. Descartes, 67084 Strasbourg Cedex, France MeSH keywords: Carbone, Graphite, Humains, Nanotubes de carbone, Tumeurs |
Les nanotubes de carbone ont été découverts dans les années 1950-1960 [
1], mais c’est seulement en 1991 que le chercheur japonais Sumio Lijima les a décrits au niveau moléculaire [
2]. Les nanotubes de carbone n’existent pas à l’état naturel, mais ils ont été fabriqués par une méthode similaire à celle utilisée pour la préparation des fullerènes (voir Glossaire) [1]. Depuis, plusieurs méthodes pour leur synthèse ont été optimisées [
3]. Les nanotubes, uniquement constitués d’atomes de carbone, appartiennent à la famille des allotropes du carbone, comme le diamant, le graphite et les fullerènes. Ce sont des cylindres fermés aux extrémités composés d’un simple feuillet de graphène (voir glossaire) enroulé (nanotubes à simple paroi) ou de plusieurs plans concentriques (nanotubes à parois multiples) (Figure 1). Leurs diamètres sont de l’ordre du nanomètre et leurs longueurs peuvent atteindre plusieurs micromètres. Grâce à leurs propriétés mécaniques, électroniques, physiques et chimiques absolument uniques, les nanotubes sont considérés comme ayant un très grand potentiel non seulement en science des matériaux mais également en nanomédecine. En particulier, l’intérêt de l’utilisation de nanotubes de carbone a commencé à être exploré pour le développement de méthodologies alternatives dans le domaine des traitements anti-cancéreux [
4], ceci grâce à leur capacité à pénétrer dans les cellules [
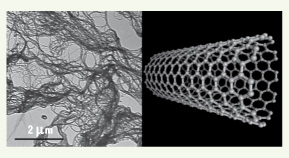
5].  | Figure 1.
Image de nanotubes de carbone à simple paroi prise au microscope électronique à transmission (A) et structure moléculaire d’un nanotube de carbone à simple paroi (B).
|
|
Une propriété unique à la base de l’utilisation anti-cancéreuse : l’absorption de la lumière dans le proche infrarouge Une caractéristique des nanotubes de carbone à simple paroi, pouvant être exploitée dans le cadre des thérapies anticancéreuses, consiste en leur capacité à absorber fortement la lumière dans la région du proche infrarouge (longueur d’onde entre 700 et 1 100 nm) [
6]. Les systèmes biologiques sont transparents et donc n’absorbent pas la lumière dans cette région spectrale. Cette propriété intrinsèque des nanotubes peut être utilisée pour induire la mort cellulaire en réponse à une irradiation qui cause une augmentation locale de la température des cellules qui ont internalisé des nanotubes de carbone. Cette approche a été récemment proposée dans deux articles parus dans le journal Proceedings of the National Academy of Science USA [
7,
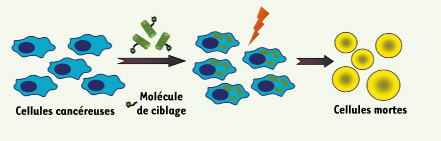
8]. Dans la première étude, l’ablation thermique par les nanotubes de carbone a été utilisée pour la destruction sélective, in vitro, d’un modèle de cellules cancéreuses du col de l’utérus, les cellules HeLa [7]. Les nanotubes de carbone ont été fonctionnalisés de manière non covalente avec des phospholipides renfermant une chaîne de polyéthylène glycol terminée par une molécule d’acide folique. Les cellules tumorales, qui surexpriment les récepteurs aux folates, internalisent les nanotubes de carbone (utilisés à une concentration de 5 µg/ml) de manière plus importante que ne le font les cellules saines. Les cellules sont ensuite irradiées en continu dans le proche infrarouge. Ce processus induit la destruction des cellules cancéreuses sans effet toxique vis-à-vis des cellules saines (Figure 2). Dans la deuxième étude, les nanotubes de carbone ont été fonctionnalisés avec des anticorps spécifiques [8]. Des lipides à base de polyéthylène glycol renfermant une molécule de biotine ont été utilisés pour préparer des dispersions stables, biocompatibles et non cytotoxiques de nanotubes de carbone à simple paroi. Des anticorps, dirigés contre les marqueurs de surface cellulaire CD22 ou CD25, et modifiés avec de l’avidine, ont été complexés aux nanotubes biotinylés. Les deux types de conjugués, utilisés en condition de saturation des récepteurs cellulaires (concentration maximale de 100 µg/ml), se sont liés in vitro de manière spécifique respectivement aux cellules de lymphome de Burkitt qui expriment CD22 (mais pas CD25) et aux cellules sanguines périphériques mononucléées qui expriment CD25 (mais pas CD22). Seules les cellules ciblées de manière spécifique ont été tuées après exposition à la lumière dans le proche infrarouge. Des études pharmacocinétiques visant à évaluer l’activité in vivo de ces nanotubes complexés aux anticorps sont en cours.  | Figure 2.
Les cellules cancéreuses sont ciblées par des nanotubes de carbone fonctionnalisés de manière non covalente. Après internalisation, l’irradiation avec un laser émettant dans la longueur d’onde du proche infrarouge provoque une absorption d’énergie par les nanotubes qui est libérée sous forme de chaleur. L’augmentation de température induit la mort cellulaire. |
Une étude très similaire avait déjà été publiée en 2007 [
9], étude dans laquelle des nanotubes de carbone à simple paroi avaient été fonctionnalisés avec des anticorps spécifiques des récepteurs de surface HER2 (human epidermal growth factor receptor) et IGF1R (insulin growth factor 1 receptor) qui sont surexprimés par un grand nombre de cellules tumorales. Ces nanotubes ont montré une interaction sélective avec des lignées cellulaires dérivées de cancer du sein. Une fois cette interaction réalisée, les cellules ont été irradiées avec des photons infrarouges provoquant leur mort. Dans l’expérience contrôle, les mêmes cellules ont été incubées avec des nanotubes fonctionnalisés avec un anticorps non spécifique et restent au contraire vivantes. Toutefois, un pourcentage non négligeable de dommages collatéraux provoqués par les nanotubes fonctionnalisés avec l’anticorps non spécifique a été observé. |
Prudence : possible toxicité des nanotubes de carbone Cette stratégie de traitement de cancers par ablation thermique est sûrement très prometteuse. Elle peut être considérée comme une alternative à d’autres stratégies anti-tumorales qui portent sur la fonctionnalisation covalente de nanotubes de carbone avec des agents anticancéreux ou des radionucléides [
10,
11]. Néanmoins, une certaine prudence est nécessaire car les nanotubes utilisés dans cette approche d’ablation thermique ne sont pas modifiés de manière covalente, ce qui ne les met pas l’abri des risques de toxicité. En effet, les complexes supramoléculaires dans lesquels des polymères organiques sont adsorbés autour de nanotubes non fonctionnalisés pour les rendre solubles, peuvent, une fois administrés, se dissocier et les nanotubes nus s’accumuler dans les cellules, les organes et les tissus. Cette stratégie nécessite donc des études approfondies sur les propriétés de distribution, d’accumulation et d’élimination éventuelle des nanotubes. Ceci est d’une importance fondamentale pour de futures applications cliniques. Les effets toxiques secondaires doivent être évalués comparativement aux bénéfices potentiels apportés. Des études récentes analysant l’impact des nanotubes de carbone sur la santé suggèrent que leur fonctionnalisation covalente augmente de manière remarquable leur biocompatibilité et les rend exploitables pour des applications biomédicales [
12,
13]. Le développement de nouveaux systèmes thérapeutiques contre le cancer est à l’heure actuelle l’un des défis majeurs pour améliorer la qualité de vie et, dans ce cadre, les nanotubes de carbone constituent très certainement un outil très intéressant et extrêmement prometteur.

|
1. Monthioux M, Kuznetsov VL, Who should be given the credit for the discovery of carbon nanotubes ? Carbon 2006; 44 : 1621–3. 2. Iijima S. Helical microtubules of graphitic carbon. Nature 1991; 354 : 56–8. 3. Dresselhaus MS, Dresselhaus G, Avouris P. Carbon nanotubes: synthesis, properties and applications. Berlin: Springer-Velag, 2001. 4. Bianco A, Kostarelos K, Prato M. Opportunities and challenges of carbon-based nanomaterials for cancer therapy. Expt Opin Drug Deliv 2008; 5 : 331–42. 5. Kostarelos K, Lacerda L, Pastorin G, et al. Functionalised carbon nanotube cellular uptake and internalisation mechanism is independent of functional group and cell type. Nat Nanotech 2007; 2 : 108–13. 6. O’Connell MJ, Bachilo SM, Huffman CB, et al. Band gap fluorescence from individual single-walled carbon nanotubes. Science 2002; 297 : 593–6. 7. Kam NWS, O’Connell M, Wisdom JA, Dai H. Carbon nanotubes as multifunctional biological transporters and near-infrared agents for selective cancer cell destruction. Proc Natl Acad Sci USA 2005; 102 : 11600–5. 8. Chakravarty P, Marches R, Zimmermann NS, et al. Thermal albation of tumor cells with antibody-functionalized single-walled carbon nanotubes. Proc Natl Acad Sci USA 2008; 105 : 8697–702. 9. Shao N, Lu S, Wickstrom E, Panchapakesan B. Integrated molecular targeting of IGF1R and HER2 surface receptors and destruction of breast cancer cells using single wall carbon nanotubes. Nanotechnology 2007; 18 : 315–401. 10. Pastorin G, Wu W, Wieckowski S, et al. Double functionalisation of carbon nanotubes for multimodal drug delivery. Chem Comm 2006; 18 : 1182–4. 11. McDevitt MR, Chattopadhyay D, Kappel BJ, et al. Tumor targeting with antibody-functionalized, radiolabeled carbon nanotubes. J Nucl Med 2007; 48 : 1180–9. 12. Lacerda L, Ali-Boucetta H, Herrero MA, et al. Tissue histology and physiology following intravenous administration of different types of functionalized multiwalled carbon nanotubes. Nanomedicine 2008; 3 : 149–61. 13. Sayes CM, Liang F, Hudson JL, et al. Functionalization density dependence of single-walled carbon nanotubes cytotoxicity in vitro. Toxicol Lett 2006; 161 : 135–42. |