| |
| Med Sci (Paris). 2008 May; 24(5): 483–490. Published online 2008 May 15. doi: 10.1051/medsci/2008245483.Stœchiométrique, mon cher Watson ! Peggy Baudouin-Cornu* CEA, iBiTecS, SBIGeM, LBI, Bâtiment 142, CEA Saclay, 91191 Gif-sur-Yvette, France |
Pour croître et se reproduire, un organisme trouve les constituants élémentaires (atomes) de ses biopolymères dans son environnement. Or, l’environnement naturel des organismes n’est pas figé. Ainsi, les constituants élémentaires du vivant, principalement le carbone (C), l’hydrogène (H), l’azote (N), l’oxygène (O), le phosphore (P) et le soufre (S), sont soumis à des cycles géochimiques et sont amenés à varier, spatialement et temporellement, dans leur forme et dans leur abondance. C’est pourquoi les organismes doivent développer des mécanismes pour s’adapter à leur environnement et pour survivre à des changements transitoires de cet environnement. De tels mécanismes peuvent influer directement sur la composition élémentaire de bio-polymères (protéines, ARN, ADN). Pour les identifier, il est alors opportun de combiner à la fois une démarche d’écologue et une démarche de biologiste moléculaire. L’écologie étudie les relations entre les êtres vivants et leur milieu. En particulier, elle analyse les flux d’énergie et de matière circulant dans un écosystème. Comme les interactions au sein de l’écosystème impliquent fondamentalement un ensemble de réactions chimiques, on peut concevoir les organismes comme des substances chimiques complexes qui interagissent entre elles et avec le monde abiotique selon une réaction chimique tout aussi complexe [
1]. Les règles de la stoechiométrie doivent alors s’y appliquer : la masse est conservée et les éléments ne sont ni créés ni détruits (on ne tient pas compte ici de la chimie nucléaire). Ce cadre de pensée, proposé en 1986 par William A. Reiners [
2], a été popularisé par James J. Elser et al. qui l’ont appelé« stoechiométrie écologique » [1–
3], puis « stoechiométrie biologique » [
4]. La stoechiométrie biologique est une approche qui combine : (1) le premier principe de la thermodynamique ; (2) le principe d’évolution par sélection naturelle ; et (3) le dogme central de la biologie moléculaire [4] (Encadré 1). Pour les biologistes moléculaires, le premier apport de la stoechiométrie biologique est de souligner l’importance de considérer les bio-polymères à une échelle encore peu explorée, l’échelle atomique, et de proposer que des pressions sélectives puissent s’exercer à cette échelle. Ainsi, nous allons voir comment plusieurs travaux, motivés par ce cadre de pensée, ont mis en évidence des biais de compositions élémentaires dans des populations de bio-polymères, et ont ainsi porté un éclairage nouveau sur l’histoire évolutive des organismes. Je tenterai ensuite de mettre en évidence un autre apport de la biologie stoechiométrique en montrant comment elle peut accompagner la recherche de traitements anticancéreux [
5]. |
Modifications transitoires de l’environnement :sélection de biais de compositions élémentaires dans des sous-populations de protéines Philippe Marlière et Didier Mazel ont été les premiers à mettre en évidence un biais de composition élémentaire lié à une adaptation spécifique à des carences nutritionnelles transitoires. Ils ont fait cette observation chez la cyanobactérie Calothrix sp. PCC 7601 [
6]. Chez cette bactérie photosynthétique, le centre récepteur de la lumière, le phycobilisome, représente jusqu’à 60 % des protéines solubles, et mobilise donc une part importante des éléments dédiés à la synthèse protéique. Lorsque le milieu de croissance est carencé en sulfate, Calothrix synthétise un phycobilisome appauvri en S grâce à l’expression spécifique d’un opéron codant pour des phycocyanines dépourvues de résidus méthionine et ne contenant qu’une seule cystéine [6]. Ce premier résultat suggérait que des contraintes nutritionnelles transitoires et répétées peuvent jouer un rôle dans l’évolution de la composition élémentaire de biopolymères [6]. Plus récemment, un mécanisme comparable a été observé chez la levure Saccharomyces cerevisiae [
7]. S. cerevisiae répond à l’exposition au cadmium, un métal lourd, en induisant fortement la biosynthèse de glutathion, un thiol tripeptidique qui le « piège » [
8]. Fauchon et al.ont montré que les protéines fortement exprimées en présence de cadmium contiennent moins de S que les protéines fortement exprimées en conditions normales [7]. Cela permet aux cellules de consacrer moins de S à la synthèse protéique, et donc d’en libérer pour la synthèse accrue de glutathion.

Les deux exemples ci-dessus illustrent bien la stœchiométrie biologique : un mécanisme affectant la composition élémentaire d’un sous-ensemble de protéines a été sélectionné pour atténuer un déséquilibre entre l’apport d’un élément par l’environnement et les besoins d’un organisme en cet élément. D’autres travaux portant sur la composition élémentaire de sous-populations de protéines ont, eux aussi, mis en évidence des biais de composition, mais ne s’inscrivent pas exactement dans ce cadre car ces biais ne permettent pas de contrebalancer des déséquilibres nutritionnels.Ainsi, il a été montré que les enzymes responsables de l’assimilation du S et du C chez S. cerevisiae et chez E. coli, et du N chez S. cerevisiae, contiennent respectivement moins de S, C ou de N que les autres protéines de ces organismes [
9]. Si ce sont bien des contraintes nutritionnelles qui semblent avoir favorisé ces biais de composition (on n’observe pas de biais en S dans des enzymes de mammifères, qui ne sont pas soumis à des carences spécifique en S du fait de leur régime alimentaire[9]), ces biais n’entraînent pas d’économies substantielles en un élément, mais permettent surtout à la cellule de maintenir fonctionnelles les voies d’assimilation en cet élément en cas de carences [9]. Un autre exemple de biais élémentaire n’ayant pas pour effet de contrebalancer des déséquilibres nutritionnels a récemment été présenté par Acquisti et al. [
10]. L’analyse de ces biais a amené les auteurs à formuler une nouvelle hypothèse sur le rôle joué par l’oxygène atmosphérique dans l’apparition d’architectures cellulaires complexes. Nous avons récemment commenté ces données dans Médecine/Sciences [
11]. |
Adaptation à l’environnement :compositions élémentaires de génomes, protéomes, et ARNomes Nous avons vu comment des biais de compositions élémentaires de sous-populations de protéines pouvaient être sélectionnés pour permettre l’adaptation à des changements transitoires de l’environnement [6, 7, 9]. Les compositions élémentaires de l’ensemble des protéomes, génomes, ou « ARNomes » (la totalité des ARN de la cellule) pourraient, quant à elles, être optimisées pour faire face à des traits persistants de l’environnement. Ainsi, les compositions en S des protéomes de 141 procaryotes séquencés montrent à la fois de larges variations inter-spécifiques et de faibles variations intra-spécifiques. Ces deux caractéristiques suggèrent que des pressions de sélection s’appliquent de façon homogène sur les contenus en S de chaque protéome [
12]. Bragg et al. proposent qu’une telle pression soit exercée par la température de croissance des organismes : les protéomes des procaryotes thermophiles1, contiennent significativement moins de S que les protéomes des autres procaryotes et, chez les thermophiles, le contenu moyen en S des protéomes est inversement corrélé à la température optimale de croissance [12]. Comme les résidus méthionine et cystéine sont thermolabiles à des températures élevées [
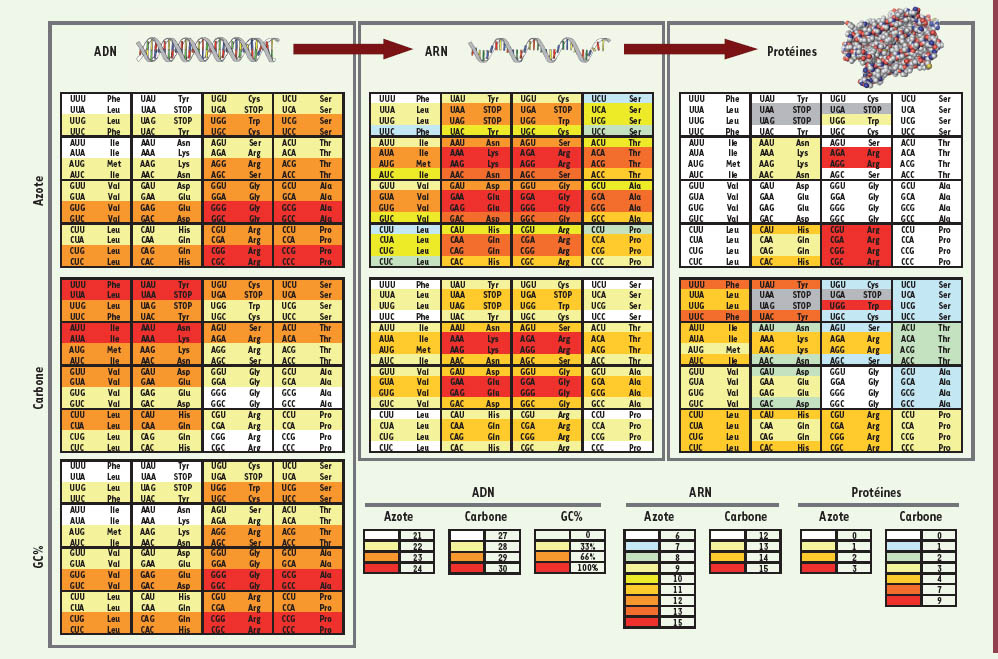
13], leur remplacement par d’autres acides aminés, à une fréquence d’autant plus accrue que la température optimale de croissance est élevée, aurait été favorisé [12]. Ce résultat met pour la première fois en évidence un lien entre un trait environnemental simple et la composition élémentaire de « bio-polymèromes ». Il reste à trouver quelles contraintes s’exercent sur les contenus en S des protéomes d’organismes mésophiles. Un faible lien entre le contenu en guanine et cytosine des génomes et les contenus en S des protéomes a été mis en évidence, mais il ne semble pas suffisant pour expliquer les importantes variations interspécifiques observées [12]. De façon remarquable, il existe plusieurs corrélations fortes entre le contenu en paires guanine/cytosine d’un génome et les contenus en N et C des bio-polyméromes correspondant. Ainsi, un génome ayant un contenu en paires guanine/cytosine élevé est construit avec plus de N et moins de C par paire de bases qu’un génome ayant un contenu en paires guanine/cytosine faible (du fait de la composition des quatre bases de l’ADN), et a tendance à coder un protéome lui aussi plus riche en N et moins riche en C (du fait de la structure du code génétique) (Figure 1) [
14,
15].
 | Figure 1.
Code génétique standard. Le code est coloré en fonction du nombre d’atomes N (haut) ou C (milieu) dans les paires de bases de l’ADN correspondant (gauche), les bases de l’ARN correspondant(centre) et les chaînes latérales des acides aminés (droite). En bas à gauche, code génétique coloré en fonction de la composition en paires guanine/cytosine de l’ADN (GC %). En bas, à droite, légende. Il existe une corrélation entre les contenus en N des ADN, ARN et acides aminés correspondant, et une corrélation entre les contenus en C des ADN et acides aminés correspondant. Ainsi, un génome ayant un GC % élevé, donc riche en N, a tendance à coder pour un ARNome et un protéome riches en N (voir texte). |
Contrairement à l’ADN génomique, les ARN sont en général monobrins. Cependant, si un ARNome contient approximativement le même nombre de bases adénine et uracile, et le même nombre de bases guanine et cytosine (ce qui serait en accord avec la deuxième règle de parité de Chargaff2 [
16]), un génome ayant un contenu en paires guanine/cytosine élevé aura tendance à coder pour un ARNome ayant un contenu en N élevé [
17] (Figure 1, le code présentant le contenu en N pour les ARN prend alors la forme du code présentant le contenu en N pour l’ADN, l’uracile ayant le même nombre de N que la thymine). Il y a donc une tendance pour les trois grandes classes de bio-polymères à avoir les mêmes biais de compositions en N : un génome ayant un contenu en paires guanine/cytosine élevé est riche en N, et code plutôt des ARN, puis des protéines, riches en N [15, 17]. C’est en remarquant le lien théorique entre le contenu en paires guanine/cytosine de l’ADN et les contenus en N des génomes et des ARNomes, que McEwan et al. ont décidé de tester l’association entre le contenu en paires guanine/cytosine de l’ADN et leur capacité à fixer le N atmosphérique [17]. Ils ont ainsi montré que chez les espèces aérobies, les bactéries incapables de fixer le N atmosphérique avaient un contenu en paires guanine/cytosine plus faible. Ces bactéries, probablement plus sujettes à des carences nutritionnelles en N, construisent donc leurs bio-polymères, ADN et ARN, avec moins de N. Deux mécanismes sélectifs peuvent expliquer cette corrélation. Soit la composition en paires guanine/cytosine de l’ADN a directement été soumise à une pression de sélection, les mutations spontanées d’une paire adénine/thymine vers une paire guanine/cytosine étant contre-sélectionnées chez les bactéries aérobies incapables de fixer l’azote [17]. Soit la composition en paires guanine/cytosine de l’ADN est le résultat d’autres contraintes (voir par exemple [
18,
19]) et la sélection s’est exercée sur la capacité des bactéries aérobies à fixer ou non le N. Nous pouvons remarquer ici que la connaissance des contenus élémentaires moyens de protéomes ou d’ARNomes ne permet d’avoir qu’une information grossière sur la quantité d’éléments réellement nécessaire à leur synthèse, les protéines et les ARN étant exprimés en quantités variables. Il faut donc affiner ces analyses. Par exemple, l’étude, pour chaque protéome d’intérêt, des compositions en C ou en S de chaque protéine codée a montré qu’au sein d’un même protéome ces compositions étaient homogènes [12, 14]. Dans des conditions normales de croissance, les compositions moyennes en C et S de ces protéomes sont donc de bons indicateurs des quantités de C et S réellement dédiées à la synthèse protéique [12, 14]. En revanche, les compositions en N n’ayant pas cette caractéristique, leur étude nécessite la prise en compte des niveaux d’expression des protéines [14]. Une telle approche a permis la première mise en évidence de biais compositionnels liés à des contraintes nutritionnelles chez des organismes multicellulaires [
20]. Au cours de travaux antérieurs, Elser et al. avaient observé que la biomasse des plantes contenait moins de N que la biomasse des animaux [
21]. Le même biais est observable au niveau des compositions élémentaires des protéomes. Ainsi, les plantes semblent exprimer des protéines contenant moins de N que les animaux. De plus, le contenu en N des protéines des plantes décroît quand le niveau d’expression des gènes correspondants augmente, alors que le contenu en N des protéines animales n’est pas lié à leur niveau d’expression [20]. Elser et al. proposent qu’il n’y ait pas de pression nutritionnelle visant à minimiser le contenu en N des protéines chez les animaux car, contrairement aux plantes, ils obtiennent directement leurs acides aminés de leur régime alimentaire [20]. À ma connaissance, aucune étude précise n’a porté sur les quantités de N et C dédiées à la synthèse des ARN. Les travaux sur les compositions élémentaires des ARNomes se sont principalement intéressés au P mobilisé par la construction du squelette des ARN. Ils ont permis l’énonciation de « l’hypothèse du taux de croissance » (HTC) [3, 4,
22] (Encadré 2). |
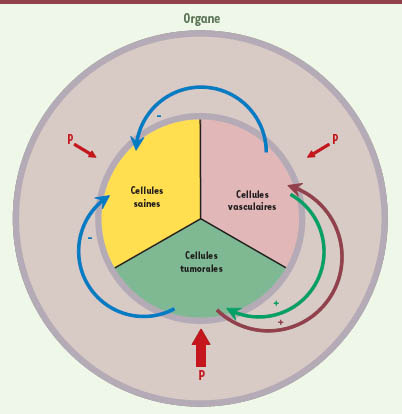
Hypothèse du taux de croissance et dynamique de prolifération d’une tumeur Beaucoup de cellules cancéreuses se caractérisent par une croissance rapide. Elles sont donc potentiellement soumises à l’HTC [22]. Elser, Kuang et Nagy ont proposé de porter un regard d’écologue sur la relation entre une tumeur et son hôte, en considérant que les 2 protagonistes constituent un système écologique couplé et qu’ils sont en compétition pour la ressource en P [5,22]. L’objectif de traitements anticancéreux est alors de faire gagner cette compétition à l’hôte ou, à défaut, d’établir un équilibre stable entre l’hôte et la tumeur. Kuang et al. ont étudié la dynamique de cet écosystème en utilisant plusieurs modèles mathématiques [5]. Ces modèles consistent en des équations différentielles avec délai qui suivent la dynamique de croissance de trois populations de cellules situées dans un organe : les cellules saines, les cellules tumorales (éventuellement hétérogènes) et les vaisseaux sanguins, qui permettent la vascularisation des cellules tumorales (Figure 2). Dans ces modèles, le contenu en P de l’organe est fixe (certains modèles plus élaborés font évoluer cette valeur au cours du temps), et est l’objet d’une compétition entre les différentes populations de cellules. Comme la construction des cellules tumorales nécessite plus de P que celle des cellules saines (Figure 2, flèches rouges), la croissance de la tumeur diminue la quantité de P utilisable pour la croissance des cellules saines. Les modèles prennent donc en compte différents modes de croissance, selon que les cellules sont dans des conditions d’apport optimal en P ou non. D’autre part, les cellules saines cessent de croître quand l’organe atteint ou dépasse son poids sain. Ainsi, la croissance de la tumeur et de la vascularisation affecte directement la croissance des cellules saines (Figure 2, flèches bleues,signe -). Enfin, la croissance des cellules tumorales est sensible au degré de vascularisation de la tumeur (Figure 2, flèche verte, signe +), vascularisation qu’elle induit avec un délai (Figure 2, flèche bordeaux, signe +) [5].
 | Figure 2.
Représentation simplifiée des modèles considérés par Kuang et al. pour étudier la prolifération d’une tumeur [ 5]. L’organe, siège de la tumeur, contient deux compartiments, appelés « milieu extracellulaire » (anneau grisé) et « milieuintracellulaire » (disque central). Le « milieu intracellulaire » est constitué de 3 populations de cellules : les cellules saines, tumorales et vasculaires. Ces trois populations de cellules sont en compétition pour l’accès au P disponible dans le « milieu extracellulaire ». Alors que la construction des cellules saines et des cellules vasculaires nécessitent la même quantité de P par unité de masse cellulaire(flèches rouges fines), les cellules tumorales, en raison de l’HTC, nécessitent plus de P par unité de masse cellulaire (flèche rouge épaisse). Les cellules tumorales induisent la croissance des cellules vasculaires avec un délai entre leur activation et leur maturation (flèche bordeaux, signe +). La croissance des cellules tumorales dépend de leur vascularisation (flèche verte, signe +). Comme les cellules saines cessent de croître si l’organe atteint sa masse initiale saine, la croissance des cellules vasculaires et tumorales affecte la croissance des cellules saines (flèches bleues, signe -). Pour une présentation détaillée des modèles voir [ 5]. |
Les simulations de Kuang et al. montrent qu’une réduction de l’apport total en P affecte presque autant l’organe sain que la tumeur. Soumettre le patient à un régime pauvre en P ne semble donc pas être une piste thérapeutique prometteuse. En revanche, modifier spécifiquement la capacité des cellules tumorales à consommer le P serait efficace [5]. Enfin, s’il y a deux populations de cellules tumorales, la population la moins agressive aura tendance à envahir toute la tumeur, étant moins affectée par la déplétion en P du fait de l’HTC. Kuang et al. suggèrent la mise au point d’un traitement mettant en jeu une telle compétition.

Une des difficultés d’un tel traitement provient de l’évolution de formes agressives de cancer vers la capacité de métastaser, donc d’avoir accès à de nouvelles sources de nutriments [5]. Depuis la publication de ce modèle, Elser et al. ont comparé les compositions élémentaires (en P, C et N) et les compositions en ARN et ADN de tissus tumoraux et sains. Leurs résultats suggèrent que les tumeurs extraites du poumon et du côlon seraient effectivement soumises à l’HTC, tandis que celles extraites du foie et du rein ne le seraient pas [
23]. Ils proposent que ces différences reflètent deux stratégies connues de colonisation d’un écosystème : soit une augmentation du taux de reproduction (l’HTC s’applique alors), soit une diminution de la mortalité [23]. Il serait intéressant de poursuivre l’étude de ces écosystèmes, en ajoutant par exemple des compétitions pour d’autres nutriments, tel que la méthionine [
24], et en prenant en compte la possibilité de métastases. |
Un nombre croissant de travaux indique que la composition élémentaire des bio-polymères peut faire l’objet de pressions sélectives spécifiques. La structure même des bio-polymères est d’ailleurs favorable à des optimisations de compositions, les contenus en N et C des génomes, protéomes et, pour le N, ARNomes, ayant tendance à montrer les mêmes biais du fait du code génétique [14, 15] (Figure 1). L’analyse des compositions élémentaires des bio-polymères, combinée à l’utilisation d’un raisonnement stoechiométrique issu de l’écologie, offre une exploration originale et fructueuse de problématiques traditionnelles de la biologie. Ainsi, cette double approche nous instruit sur l’histoire évolutive des organismes en dévoilant des stratégies de survie à des carences transitoires et répétées en nutriments [6, 9], explique certains traits génomiques, tel que le contenu en paires guanine/cytosine de l’ADN de procaryotes [17] ou la duplication de gènes [6, 7,
25], et permet d’interpréter des profils transcriptionnels par leur capacité à favoriser des économies en un élément à un moment où son utilisation optimale est critique pour l’organisme [7]. Enfin, elle peut aussi modifier notre compréhension d’un phénomène biologique, tel que le développement d’une tumeur [5, 22]. À l’heure où l’interdisciplinarité s’avère de plus en plus nécessaire, les apports de la stoechiométrie biologique sont une invitation pressante à ne pas oublier nos collègues écologues.

|
L’Auteure remercie chaleureusement Dominique Thomas pour les nombreuses idées et suggestions ; Jean-Yves Thuret, Jean Labarre et Stéphane Chédin, pour leurs relectures critiques et approfondies, et l’ensemble de l’équipe de Jean Labarre. Les travaux de P. Baudouin-Cornu bénéficient d’un financement de l’Agence Nationale de la Recherche.
|
Footnotes |
1. Sterner RW, Elser JJ. Ecological stoichiometry: the biology of elements from molecules to the biosphere. Princeton NJ : Princeton University Press. 2002 2. Reiners WA. Complementary models for ecosystems. The American Naturalist 1986; 127 : 59–73 3. Elser JJ, Dobberfuhl DR, MacKay NA, Schampel JH. Organism size, life history, and N:P stoichiometry: toward a unified view of cellular and ecosystem processes. BioScience 1996; 46 : 674–84 4. Elser JJ, Sterner RW, Gorokhova E, et al. Biological stoichiometry from genes to ecosystems. Ecology Letters 2000; 3 : 540–50 5. Kuang Y, Nagy JD, Elser JJ. Biological stoichiometry of tumor dynamics: mathematical models and analysis. Discrete Continuous Dynamical Systems Series B 2004; 4 : 221–40 6. Mazel D, Marliere P. Adaptive eradication of methionine and cysteine from cyanobacterial light-harvesting proteins. Nature 1989; 341 : 245–8 7. Fauchon M, Lagniel G, Aude JC, et al. Sulfur sparing in the yeast proteome in response to sulfur demand. Mol Cell 2002; 9 : 713–23 8. Li ZS, Lu YP, Zhen RG, et al. A new pathway for vacuolar cadmium sequestration in Saccharomyces cerevisiae: YCF1-catalyzed transport of bis(glutathionato)cadmium. Proc Natl Acad Sci USA 1997; 94 : 42–7 9. Baudouin-Cornu P, Surdin-Kerjan Y, Marliere P, Thomas D. Molecular evolution of protein atomic composition. Science 2001; 293 : 297–300 10. Acquisti C, Kleffe J, Collins S. Oxygen content of transmembrane proteins over macroevolutionary time scales. Nature 2007; 445 : 47–52 11. Baudouin-Cornu P, Thomas D. Du rôle de l’oxygène dans l’évolution. Med Sci (Paris) 2007; 23 : 255–7 12. Bragg JG, Thomas D, Baudouin-Cornu P. Variation among species in proteomic sulphur content is related to environmental conditions. Proc Biol Sci 2006; 273 : 1293–300 13. Russell RJ, Ferguson JM, Hough DW, et al. The crystal structure of citrate synthase from the hyperthermophilic archaeon pyrococcus furiosus at 1.9 A resolution. Biochemistry 1997;36 : 9983–94 14. Baudouin-Cornu P, Schuerer K, Marliere P, Thomas D. Intimate evolution of proteins. Proteome atomic content correlates with genome base composition. J Biol Chem 2004; 279 : 5421–8 15. Bragg JG, Hyder CL. Nitrogen versus carbon use in prokaryotic genomes and proteomes. Proc Biol Sci 2004; 271 (suppl 5) : S374–7 16. Forsdyke DR, Mortimer JR. Chargaff’s legacy. Gene 2000; 261 : 127–37 17. McEwan CE, Gatherer D, McEwan NR. Nitrogen-fixing aerobic bacteria have higher genomic GC content than non-fixing species within the same genus. Hereditas 1998; 128 : 173–8 18. Singer CE, Ames BN. Sunlight ultraviolet and bacterial DNA base ratios. Science 1970; 170 : 822–5 19. Sueoka N. Directional mutation pressure and neutral molecular evolution. Proc Natl Acad Sci USA 1988; 85 : 2653–7 20. Elser JJ, Fagan WF, Subramanian S, Kumar S. Signatures of ecological resource availability in the animal and plant proteomes. Mol Biol Evol 2006; 23 : 1946–51 21. Elser JJ, Fagan WF, Denno RF, et al. Nutritional constraints in terrestrial and freshwater food webs. Nature 2000; 408 : 578–80 22. Elser JJ, Nagy JD, Kuang Y. Biological stoichiometry: an ecological perspective on tumor dynamics. BioScience 2003; 53 : 1112–20 23. Elser JJ, Kyle MM, Smith MS, Nagy JD. Biological stoichiometry in human cancer. PLoS One 2007; 2 : e1028 24. Cellarier E, Durando X, Vasson MP, et al. Methionine dependency and cancer treatment. Cancer Treat Rev 2003; 29 : 489–99 25. Bragg JG, Wagner A. Protein carbon content evolves in response to carbon availability and may influence the fate of duplicated genes. Proc Biol Sci 2007; 274 : 1063–70 26. Lotka AJ. Contribution to the energetics of evolution. Proc Natl Acad Sci USA 1922; 8 : 147–51 27. Lotka AJ. Natural selection as a physical principle. Proc Natl Acad Sci USA 1922; 8 : 151–4 28. Andersen T, Elser JJ, Hessen DO. Stoichiometry and population dynamics. Ecology Letters 2004; 7 : 884–900 29. Darwin CR. On the origin of species by means of natural selection, or the preservation of favoured races in the struggle for life. London : John Murray, 1859 30. Crick F. Central dogma of molecular biology. Nature 1970; 227 : 561–3 31. Main T, Dobberfuhl DR, Elser JJ. N:P stoichiometry and ontogeny of crustacean zooplankton: a test of the growth rate hypothesis. Limnol Oceanogr 1997; 42 : 1474–8 32. Vrede T, Andersen T, Hessen DO. Phosphorus distribution in three crustacean zooplankton species. Limnol Oceanogr 1998; 44 : 225–9 33. Gorokhova E, Dowling TE, Weider LJ, et al. Functional and ecological significance of rDNA intergenic spacer variation in a clonal organism under divergent selection for production rate. Proc Biol Sci 2002;269 : 2373–9 34. Elser JJ, Watts T, Bitler B, Markow TA. Ontogenetic coupling of growth rate with RNA and P contents in five species of Drosophila. Functional Ecology 2006; 20 : 846–56 |