| |
| Med Sci (Paris). 2008 May; 24(5): 473–474. Published online 2008 May 15. doi: 10.1051/medsci/2008245473.Épimutations héréditaires Le point chez l’homme Angélique Galvani and Déborah Bourc’his* Inserm U741, Université Denis Diderot Paris 7, 2, place Jussieu, 75251 Paris Cedex 05, France MeSH keywords: Protéines adaptatrices de la transduction du signal, Cartographie chromosomique, Réparation de l'ADN, Femelle, Maladies génétiques congénitales, Humains, Mâle, Mutation, Protéines nucléaires, Pedigree |
La molécule d’ADN représente le support de l’information génétique transmise au cours des générations. Des mutations peuvent altérer cette information, avec des effets phénotypiques immédiats pour l’individu, et à plus long terme pour l’espèce lorsque ces mutations sont transmises par la lignée germinale. Les modifications épigénétiques, comme la méthylation de l’ADN, interviennent au cours du développement pour moduler l’information génétique de manière réversible. Des épimutations perturbant le programme d’expression d’un gène sans changement de sa séquence nucléotidique peuvent apparaître de façon anarchique. Il existe notamment des syndromes congénitaux liés à des défauts d’empreinte parentale et des cancers associés à des anomalies de méthylation [
1]. À la manière d’une mutation génétique, une épimutation peut-elle être héritée, et donc passer la méiose ? Les cas d’épimutations héréditaires sont fréquents chez les plantes, le plus connu étant le variant Peloric de la linaire commune décrit par Linné dès 1749 [
2]. Il existe en revanche peu de cas documentés chez les mammifères, où les profils de méthylation sont effacés entre chaque génération lors du passage par la lignée germinale. Cette reprogrammation germinale permet de restaurer un état de totipotence, de remettre à zéro les marques d’empreinte parentale et elle réduit les risques de transmission d’épimutations [
3]. Des exemples d’épimutations héréditaires ont cependant été décrits chez la souris. Ils sont toujours associés à l’insertion d’un rétrotransposon IAP (intracisternal A-particle) qui provoque une expression variable du gène voisin, modifiant un phénotype quantifiable, par exemple la couleur du pelage, et corrélée au degré de méthylation du rétrotransposon [
4]. Ces cas pourraient être isolés, les séquences IAP ayant la propriété unique de ne pas être totalement déméthylées lors de la gamétogenèse murine [
5]. Et chez l’homme ? Des études menées sur des cas familiaux de cancer colorectal sans polypose (HNPCC) ont récemment alimenté la polémique quant à l’existence d’épimutations héréditaires prédisposant au cancer. |
Transmission d’une épimutation liée au locus MLH1 Une étude publiée en 2004 rapporte le cas de deux patients non apparentés atteints de HNPCC qui, malgré des symptômes cliniques sans équivoque, sont exempts de mutations dans les deux gènes associés à ce cancer (MLH1 ou MSH2, impliqués dans la réparation des mésappariements de l’ADN) [
6,
7]. Le promoteur de MLH1 présente cependant une hyperméthylation touchant systématiquement le même allèle parental et corrélée à une perte d’expression (Figure 1). Cette hyperméthylation est trouvée dans les tissus somatiques issus des trois feuillets embryonnaires, indiquant que l’épimutation est constitutionnelle et serait apparue de novo dans la lignée germinale de l’un des parents, ou très tôt au cours du développement de l’individu. Question fondamentale : cette épimutation est-elle transmissible et peut-elle prédisposer au cancer en accord avec le modèle classique de Knudson ? Malgré l’absence de l’épimutation dans la descendance du patient masculin, l’hyperméthylation du promoteur de MLH1 est retrouvée dans 1 % de ses spermatozoïdes : pour la première fois, la possibilité de transmission d’une épimutation était évoquée chez l’homme. Revirement de situation en 2007 : le même groupe analyse de nouveau l’état de méthylation des spermatozoïdes de ce patient, en incluant cette fois un contrôle crucial, SNRPN, un gène soumis à empreinte à méthylation maternelle et donc déméthylé dans les spermatozoïdes [
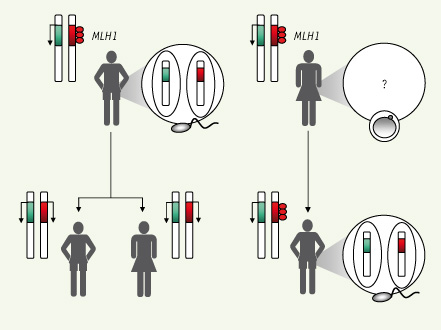
8]. Il apparaît que le faible pourcentage de méthylation observé précédemment était dû en fait à une contamination par des cellules somatiques, remettant en cause le possible maintien de cette épimutation lors de la spermatogenèse.  | Figure 1.
Transmission de l’épimutation MLH1. Le patient décrit dans [ 6], à gauche, présente une hyperméthylation (cercles rouges) au niveau du promoteur de MLH1 sur un des deux allèles, entraînant une perte d’expression du gène. Cette épimutation est perdue dans ses spermatozoïdes, traduisant un effacement de la méthylation lors de la spermatogenèse. La patiente décrite dans [
9], à droite, a transmis l’épimutation à un de ses fils. Cependant, la présence de l’hyperméthylation au promoteur de MLH1 n’a pas été déterminée dans ses ovocytes, laissant planer un doute sur le mode réel de transmission de l’épimutation. Chez le fils, l’épimutation est perdue dans les spermatozoïdes. |
Une étude parallèle réalisée par les mêmes auteurs montre que l’épimutation pourrait en revanche être transmise maternellement ; cette étude documente le cas d’une mère et son fils présentant la même hyperméthylation constitutionnelle de MLH1 au niveau somatique [9]. Les spermatozoïdes du fils ne sont cependant plus porteurs de l’épimutation. Ces observations suggèrent un mode de transmission sexe-spécifique de l’épimutation MLH1, avec effacement lors du passage par la lignée germinale mâle, mais maintien lors du passage par la lignée germinale femelle. |
Maintien ou ré-écriture ? Épimutation ou mutation à effet épigénétique ? Pour des raisons éthiques évidentes, la présence de l’épimutation n’a pu être analysée dans les ovocytes de la patiente. Le mécanisme moléculaire à l’origine de cette transmission transgénérationnelle reste inconnu. Plusieurs hypothèses : (1) L’hyperméthylation a pu être réellement maintenue lors de l’ovogenèse et est transmise telle quelle au fils ; (2) l’hyperméthylation a été effacée puis rétablie lors de l’ovogenèse, à la manière d’un gène soumis à empreinte maternelle ; ou bien (3) l’hyperméthylation a été effacée puis ré-imposée après fécondation. Dans tous les cas, on ne peut exclure l’existence d’un déterminisme génétique à l’origine de l’épimutation : un haplotype conférant une résistance à la déméthylation germinale ou favorisant la re-méthylation ovocytaire ou zygotique. Certes aucun polymorphisme de séquence n’a été associé à l’allèle hyperméthylé de MLH1. Cela n’exclut pas pour autant l’existence d’une mutation touchant des séquences régulatrices et qui induirait en cis la méthylation du promoteur, ou une mutation en trans touchant un gène codant pour une protéine intervenant dans la méthylation ou la déméthylation de l’ADN. Dans ce cas, d’autres séquences génomiques pourraient également présenter des anomalies de méthylation. Le mode de transmission de l’épimutation MLH1 reste donc incertain. L’hyperméthylation est-elle réellement maintenue de façon autonome et sexe-spécifique, ou est-elle le reflet d’une mutation génétique affectant le statut de méthylation de MLH1 ? Par analogie avec la souris, il serait tentant de spéculer que l’insertion d’un rétrotransposon à proximité du locus MLH1 pourrait être responsable de la résistance variable à la reprogrammation germinale. Seul le séquençage complet du génome de ces patients permettrait de valider l’existence d’épimutations héréditaires dans l’espèce humaine. Il en reste néanmoins que des altérations épigénétiques peuvent prédisposer au cancer et être transmises, avec une étiologie génétique ou non, au cours des générations. |
1. Dolinoy DC, Das R, Weidman JR, Jirtle RL. Metastable epialleles, imprinting, and the fetal origins of adult diseases. Pediatr Res 2007; 61 : R30–7. 2. Prouteau M, Colot V. Contrôles épigénétiques, développement et variation génétique naturelle chez les plantes. Med Sci (Paris) 2005; 23 : 422–7. 3. Trasler JM. Gamete imprinting : setting epigenetic patterns for the next generation. Reprod Fertil Dev 2006; 18 : 63–9. 4. Morgan HD, Sutherland HG, Martin DI, Whitelaw E. Epigenetic inheritance at the agouti locus in the mouse. Nat Genet 1999; 23 : 314–8. 5. Hajkova P, Erhardt S, Lane N, et al. Epigenetic reprogramming in mouse primordial germ cells. Mech Dev 2002; 117 : 15–23. 6. Suter MC, Martin DIK, Ward RL. Germline epimutations of MLH1 in individuals with multiple cancers. Nat Genet 2004; 36 : 497–501. 7. Duval A, Hamelin R. Réparation des erreurs de réplication, microsatellites et cancer. Med Sci (Paris) 2003; 19 : 55–62. 8. Hitchins MP, Ward RL. Erasure of MLH1 methylation in spermatozoa- implications for epigenetic inheritance. Nat Genet 2007; 39 : 1289. 9. Hitchins MP, Wong JJL, Suthers G, et al. Inheritance of a cancer-associated MLH1 germ-line epimutation. N Eng J Med 2007; 356 : 697–705. |