| |
| Med Sci (Paris). 2008 April; 24(4): 428–430. Published online 2008 April 15. doi: 10.1051/medsci/2008244428.Télomérase… le fin mot de l’histoire Elisabeth Blackburn Simone Gilgenkrantz* Médecine/Sciences, 9, rue Basse, 54330 Clérey-sur-Brénon, France MeSH keywords: Animaux, Australie, Histoire du 20ème siècle, Histoire du 21ème siècle, Humains, Telomerase, Tetrahymena |
Dans l’Océan indien, au sud-est de l’Australie, se trouve l’île de Tasmanie, célèbre pour son « diable », grand marsupial carnivore en voie de disparition [
1], ses wallabies, ainsi que pour ses échidnés et ses ornithorynques, monotrèmes qui - contrairement aux autres mammifères - sont ovipares et non pas vivipares. Elle devrait aujourd’hui être autrement célèbre, car dans sa capitale, à Hobart, naissait en 1948, de parents médecins, une fille qui allait laisser sa trace dans le monde scientifique grâce à deux découvertes fondamentales aussi bien en génétique qu’en biologie cellulaire et en cancérologie : la structure des télomères et l’existence de la télomérase. Il s’agit d’Elisabeth Blackburn, qui vient de recevoir le prix L’Oréal-Unesco pour l’Amérique du Nord. Depuis son départ de Melbourne où elle fit ses études et obtint en 1971 un master en science, elle a suivi une trajectoire exemplaire. Elle va d’abord en Angleterre, à Cambridge où elle travaille dans le prestigieux laboratoire de Frederick Sanger, double lauréat du prix Nobel de chimie (1958 et 1980). Après son doctorat de biologie (1975), elle obtient une bourse pour l’Université de Yale. Son choix de poursuive sa carrière aux États-Unis est double : les possibilités de travail y sont meilleures et l’ami qu’elle a rencontré à Cambridge, John Sedat, est Américain. Devenu son mari, il est à présent professeur à l’Université de San Francisco. |
Les télomères de Tetrahymena
Au début des années 1980, elle travaille avec Joe Gall sur Tetrahymena thermophila, un protozoaire cilié contenant un grand nombre de minichromosomes, idéals comme matériel d’étude pour l’analyse de la structure des extrémités télomériques [
2]. Elle constate, après clonage, que ces terminaisons comportent jusqu’à 50 répétitions de séquence T2G4/C4A2 et que le brin G-riche correspond à l’extrémité 3’. La taille de l’extension G-riche est de 12 à 16 nucléotides, la majorité se termine par la séquence 5’-TTGGGGT-3’. Mais il existe des variations du nombre des répétitions et l’hypothèse d’une addition de séquences répétées est envisagée. La même structure est retrouvée dans les chromosomes de levure. On savait - depuis les travaux de Barbara McClintock, entre autres [
3] -, que les télomères n’étaient pas adhésifs et qu’ils empêchaient la fusion entre chromosomes qui se produit habituellement lorsque deux cassures double-brin se trouvent en contact. Il fallait donc qu’il existât à l’extrémité terminale un « capuchon télomérique » de nature particulière sur lequel l’ADN polymérase (découverte par Arthur Kornberg dans les années 1960 [
4]) ne pouvait pas agir [
5]. On savait aussi que les télomères subissaient un raccourcissement terminal au fur et à mesure des divisions cellulaires. Cette érosion pouvait expliquer l’impossibilité de « repiquer » indéfiniment des cultures primaires in vitro, et selon la théorie de Hayflick, elle devait accompagner la sénescence des cellules diploïdes. |
Une enzyme qui fait sauter l’audimat scientifique Aussi, en 1985, quand Elisabeth Blackburn, alors professeure assistante à Berkeley (CA), et sa collaboratrice Carol Greider découvrent une enzyme capable de prévenir la perte des éléments terminaux par addition de séquences aux extrémités 3’, elles pressentent aussitôt qu’il ne s’agit pas d’une particularité de Tetrahymena thermophila, ou de Saccharomyces cerevisiae, mais d’un processus cellulaire général, d’une importance extrême [
6]. Cette transférase terminale spécifique des télomères fut rapidement appelée « télomérase ». Sa structure comporte deux sous-unités : la sous-unité catalytique TERT (telomerase transcriptase reverse), et TERC (telomerase RNA component), un ARN dont la séquence sert de matrice pour la synthèse de novo des séquences complémentaires [
7]. Il devenait clair alors que non seulement la sénescence cellulaire était liée à l’absence d’activité de la télomérase (dans les lignées primaires par exemple), mais que l’activation de cette enzyme pouvait expliquer l’immortalisation des cellules en lignées continue et surtout la multiplication des cellules cancéreuses [
8,
9]. Ainsi, la vie se tient « sur le fil du rasoir », entre vieillissement et cancer. La télomérase est, selon la comparaison d’Elisabeth Blackburn elle-même, à la fois Dr Jekyll and Mr Hyde. Ainsi des voies d’étude tous azimuts s’ouvraient en gériatrie, cancérologie, en biologie de la reproduction (avec raccourcissement des télomères des cellules reproductrices) et dans de nombreuses pathologies où télomères et/ou télomérase sont défectueux. Par la suite, les protéines interagissant avec les télomères et la télomérase furent décryptées ainsi que les mécanismes survenant dans de très nombreux types de cellules normales et pathologiques. Actuellement, la recherche d’inhibiteurs de la télomérase qui pourraient être utilisés comme agents anticancéreux est en cours. Deux publications dans ce numéro de Médecine/Sciences (→) viennent attester de la permanence de la fécondité de ce champ d’investigation [
10,
11]. Il suffit de voir comment, à partir de 1995, le nombre de citations sur la télomérase a crû de façon exponentielle : d’une centaine à plus de 6 000 aujourd’hui (Figure 1) [
12], et ce n’est sans doute qu’un début pour ces histoires de fin…
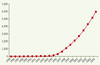 | Figure 1.
Citations cumulées sur la télomérase. Un mariage exceptionnellement réussi entre l’incontournable indice « médiatique » et une vraie découverte scientifique, ou « le fabuleux destin d’un impact factor » (d’après [ 10]). |
(→) Voir p. 383 et p. 390 de ce numéro
Elisabeth Blackburn a poursuivi ses travaux et le caractère exceptionnel de ses découvertes lui a valu de nombreux prix. Outre le prix L’Oréal-Unesco, deux autres, également prestigieux, lui ont été attribués : le prix du Dr A.H. Heineken de médecine par l’Académie Royale Néerlandaise des Sciences et Lettres en 2004, et le Prix Albert Lasker en 2006. |
Une femme de science déterminée Actuellement professeure au département de Biochimie et Biophysique à l’Université de Californie à San Francisco (UCSF), elle figure parmi les 100 personnalités influentes du monde selon le Time magazine. Élue à l’AAAS (American Association for the Advancement of Science), pendant un temps présidente de l’ASCB (American Society for Cell Biology), elle fut sollicitée en 2001 pour faire partie du Council on Bioethics sous la présidence de George W. Bush. Mais ses prises de position claires en faveur des recherches sur les cellules souches lui ont valu - fait rarissime - d’être « remerciée » pour un second mandat par la Maison Blanche qui s’attendait, de la part d’une femme, à plus de docilité. Car E. Blackburn est aussi une femme engagée. En 2003, elle a opté pour la nationalité américaine et ne fait pas mystère de ses préférences démocrates. Elle milite aussi pour l’égalité des chances entre les sexes. Pour donner l’exemple, elle a toujours cherché à favoriser autour d’elle les carrières féminines : Carol Greider, Janis Shampay, et bien d’autres, qui ont à leur tour recruté une deuxième génération de femmes scientifiques, comme Chantal Autexier de l’Institut McGill (Montréal, Canada). De ce fait, la recherche sur les télomères en Amérique est très « féminisée ». Très consciente - pour l’avoir vécu elle-même - des difficultés rencontrées par les femmes accédant à des postes à responsabilités, elle souhaite qu’elles soient plus nombreuses, et revendique pour elles le droit d’avoir à la fois une famille et un métier [
13]. Dans une biographie qui lui est consacrée, elle se plaît à évoquer le moment d’immense bonheur qu’elle a éprouvé quand elle a appris, en même temps, qu’elle était enceinte et nommée professeure titulaire [
14]. À l’heure où les statistiques montrent un déficit criant d’inscriptions vers les carrières scientifiques, au profit d’options plus sures et plus rentables, comme on aimerait qu’une telle aventure soit encore possible et qu’étudiants et étudiantes aient encore envie d’y croire…, quitte à s’expatrier comme E. Blackburn s’ils n’obtiennent pas, dans notre beau pays, les moyens d’y parvenir. |
1. Labie D. Une tumeur clonale mortelle par morsure chez un marsupial. Med Sci (Paris) 2007; 23 : 1105. 2. Szostack JW, Blackburn EH. Cloning yeast telomeres on linear plasmid vectors. Cell 1982; 29 : 245–55. 3. McClintock B. The behavior in successive nuclear divisions of a chromosome broken at meiosis. Proc Natl Acad Sci USA 1939; 25 : 405–16. 4. Kornberg A. DNA synthesis. San Francisco : W.H. Freeman, 1974. 5. LeBel C, Wellinger RJ. Structure terminale des chromosomes : le « capuchon télomérique » Med Sci (Paris) 2004; 20 : 207–12. 6. Greider CW, Blackburn EH. Identification of a specific telomere terminal transferase activity in Tetrahymena extracts. Cell 1985; 43 : 405–13. 7. Rufer N, Nabholz M. Télomérase, élixir de jouvence des cellules humaines ? Med Sci (Paris) 2003; 19 : 345–50. 8. Ouellette MM, Savre-Train I. Les télomères et le vieillissement des cellules. Med/Sci (Paris) 2000, 16 : 473–80. 9. Ancelin K, Castellazzi M, Gilson E. Télomères et cancer : les barrières tombent. Med Sci (Paris) 2000; 16 : 481–6. 10. Londoño-Vallejo A, Lenain C, Gilson E. Cibler les télomères pour forcer les cellules cancéreuses à entrer en sénescence. Med Sci (Paris) 2008; 24 : 383–9. 11. Henry Y, Hoareau-Aveilla C, Leblanc T. La dyskératose congénitale, une maladie méconnue due à un déficit de télomérase. Med Sci (Paris) 2008; 24 : 390–8 12. Blackburn EH, Greider CW, Szostak JW. Telomeres and telomerase: the path from maize, Tetrahymena and yeast to human cancer and aging. Nat Med 2006; 12 : 1133–8. 14. Brady C. Elisabeth Blackburn and the story of telomeres. Deciphering the ends of DNA. Cambridge, MA : MIT Press, 2007 : 424 p. |