| |
| Med Sci (Paris). 2008 March; 24(3): 314–316. Published online 2008 March 15. doi: 10.1051/medsci/2008243314.Grippe aviaire en décembre 2007 Fanny Lanternier,1* Marc Lecuit,2 and Olivier Lortholary3 1Service des Maladies Infectieuses et Tropicales, Centre d’Infectiologie Necker-Pasteur, Hôpital Necker-Enfants malades, Université Paris Descartes, 149, rue de Sèvres, 75015 Paris France 2Service des Maladies Infectieuses et Tropicales, Centre d’Infectiologie Necker-Pasteur, Hôpital Necker-Enfants malades, Université Paris Descartes, 149, rue de Sèvres, 75015 Paris France. Groupe « Micro-organismes et Barrières de l’Hôte », Inserm avenir U604, Institut Pasteur, 25, rue du Docteur Roux, 75015 Paris France 3Service des Maladies Infectieuses et Tropicales, Centre d’Infectiologie Necker-Pasteur, Hôpital Necker-Enfants malades, Université Paris Descartes, 149, rue de Sèvres, 75015 Paris France. Unité de Mycologie Moléculaire, CNRS URA3012, Institut Pasteur, 25, rue du Docteur Roux, 75015 Paris France MeSH keywords: Animaux, Oiseaux, Humains, Lutte contre l'infection, Sous-type H5N1 du virus de la grippe A, Vaccins antigrippaux, Grippe chez les oiseaux, Grippe humaine, Agences internationales, Nations Unies, Vaccination, Santé mondiale, Zoonoses |
L’épizootie actuelle de grippe aviaire est mondiale, et de nouveaux cas de transmission à l’homme ont été rapportés en Asie, en Afrique et désormais en Europe (Turquie). Elle est due au virus aviaire H5N1 identifié à Hong Kong en 1997 et responsable de cas humains depuis 1997. La crainte est l’apparition d’une nouvelle pandémie grippale. La barrière actuelle à l’apparition d’une telle pandémie est la faible capacité de transmission inter-humaine du virus H5N1 [
1,
2]. Un cas de possible transmission interhumaine a déjà été rapporté [
3]. Une mutation du virus aviaire, comme ce fut le cas pour la pandémie espagnole de 1918, ou une recombinaison entre une souche humaine et aviaire comme ce fut le cas en 1957 et à Hong Kong en 1968, pourraient conférer une augmentation de la capacité de transmission interhumaine [
4] au virus. Le virus responsable de la pandémie grippale de 1918 partage avec le virus H5N1 la propriété de générer chez les primates une détresse respiratoire et la mort ; ces deux virus sont capables d’induire une réponse anti-virale dérégulée pouvant contribuer à la létalité [
5]. La particularité des cas humains de grippe aviaire H5N1 est le jeune âge de la population touchée et le fort taux de létalité, 20 fois supérieur à celui de la grippe espagnole. |
Le virus aviaire H5N1 se transmet aux oiseaux par voie digestive et est responsable d’une symptomatologie essentiellement digestive. Il touche principalement les oiseaux aquatiques qui se contaminent par de l’eau souillée, et les volailles. Les oiseaux migrateurs sont également touchés. L’infection chez les oiseaux est hautement pathogène et la plupart sont malades ou meurent. Cependant, certains oiseaux migrateurs sont peu symptomatiques et probablement responsables de la dissémination rapide depuis 2005 du virus d’Asie vers l’Eurasie et l’Afrique [
6]. Les souches prélevées sur des oiseaux en Asie, en Afrique et en Europe ont été comparées ; les isolats européens et africains appartiennent tous à l’un des trois types présents en Asie, mais ont été introduits à trois reprises. Les souches responsables des cas irakiens et égyptiens appartiennent à ce type. Au sein de ce type, trois sous-types évoluent indépendamment. Un isolat résulte du réassortiment de deux sous-types [
7]. Dans le Sud de la Chine, un nouveau sous-type a émergé en 2006 et y est actuellement prédominant. Il y remplace les différents sous-types précédents et est responsable de cas à Hong Kong, au Laos, en Malaisie et en Thaïlande [
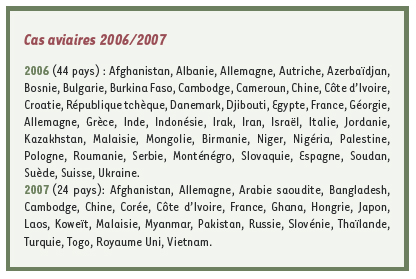
8]. Des cas ont été rapportés dans soixante pays depuis 2003. En France, trois cas ont été rapportés en Juillet 2007 chez des cygnes sauvages en Moselle. En 2006, des cas aviaires ont été déclarés dans 44 pays, et dans 24 en 2007 (Encadré).
|
La contamination humaine se fait au contact d’oiseaux (principalement des volailles) infectés par le virus H5N1, malades ou morts [
9], mais la transmissibilité à l’homme est faible [
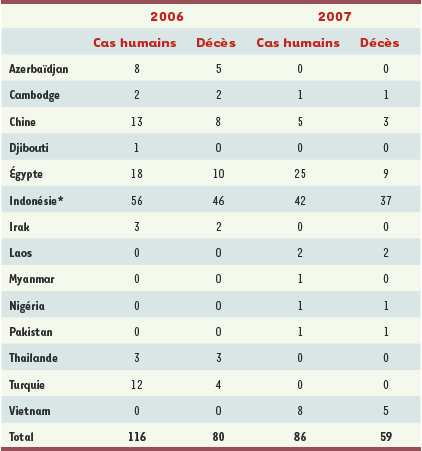
10]. Le premier cas humain, hormis celui de 1997, a été rapporté en 2003. Les cibles principales sont les enfants et jeunes adultes sains [9]. Le tableau clinique associe une fièvre et une symptomatologie respiratoire. Le traitement par inhibiteur de la neuraminidase (oseltamivir, Tamiflu® ou zanamivir, Relenza®) semble peu efficace, probablement du fait d’une administration souvent tardive. En effet, il devrait être administré dans les 48 heures suivant le début des symptômes, alors que dans les faits, les patients ont été hospitalisés en moyenne 5 jours après le début des symptômes. De rares cas de résistance à l’oseltamivir ont été rapportés, mais les souches résistantes semblent moins virulentes et le zanamivir reste efficace sur ces souches. Les patients décèdent de détresse respiratoire. L’infection a conduit dans 191 cas au décès (60 %) en moyenne 3 jours après l’hospitalisation. Actuellement un total de 343 cas humains a été déclaré. 2003 : 3 cas, 1 pays touché ; 2004 : 46 cas, 2 pays touchés ; 2005 : 95 cas, 5 pays touchés ; 2006 : 116 cas, 9 pays touchés ; 2007 : 83 cas, 9 pays touchés L’épizootie, dont l’extension reflète celle de la pandémie aviaire, n’est donc pas contrôlée et s’étend géographiquement, l’extension concernant l’Eurasie et l’Afrique en 2006. La répartition géographique des cas humains en 2006-2007 est mentionnée dans le Tableau I. Les pays les plus touchés depuis 2003 sont l’Indonésie (112 cas), le Vietnam (100 cas), l’Égypte (38 cas), la Chine et la Thaïlande avec 25 cas pour chacun. La situation semble être contrôlée en Thaïlande puisque qu’il n’y a pas eu de cas en 2007, en revanche des cas persistent en Indonésie et 7 cas ont été rapportés au Vietnam en octobre 2007 alors que ce pays avait été épargné depuis 2005. La grippe aviaire est donc dans la phase 3 d’alerte du plan grippe aviaire OMS correspondant à la phase d’alerte pandémique au cours de laquelle un nouveau virus est à l’origine de cas humains avec une transmission inter-humaine absente ou très limitée.  | Tableau I.
Cas humains confirmés de grippe aviaire A/H5N1 rapportés par l’OMS (actualisé le 21 janvier 2008). * Déjà 2 cas enregistrés en 2008 en Indonésie. |
|
Mesures de prévention de l’apparition d’une pandémie et de contrôle Plans de prévention L’OMS a édicté une conduite demandant à chaque pays de rédiger des mesures préventives et de contrôle en cas d’apparition de pandémie grippale. À la fois en Europe [
11] (où chaque pays a rédigé son propre plan) et aux États Unis [ 4], le plan repose sur la prise en charge des volailles infectées, la vaccination des personnes exposées, la prophylaxie et le traitement par inhibiteurs de la neuraminidase des patients et/ou sujets contact et enfin l’isolement strict des humains atteints. Les plans de prévention au sud-est asiatique et en Océanie, d’où la pandémie serait susceptible de démarrer, sont similaires aux plans européens pour Hong Kong, la Nouvelle-Zélande et l’Australie. En revanche, pour le Vietnam, l’Indonésie et la Chine, l’accent est mis sur les mesures vis-à-vis des volailles, mais l’approvisionnement en médicaments anti-viraux, et le choix des populations qui recevront la vaccination et le traitement antiviral sont flous [
12]. Le plan français prévoit l’utilisation des inhibiteurs de la neuraminidase en priorité dans le traitement des cas déclarés et non pour la prophylaxie. Sur le plan vaccinal, les personnes exposées seront vaccinées par le vaccin prépandémique actuellement disponible en attendant la production d’un vaccin pandémique qui sera conçu en urgence. Vaccination Les résultats détaillés des études portant sur la vaccination humaine contre le virus H5N1 seront présentés dans un prochain article rédigé par le Dr Odile Launay. Mentionnons d’ores et déjà que la mise en place d’une vaccination contre le virus H5N1 se dessine. Un vaccin inactivé sans adjuvant a été testé dans le cadre d’un essai de tolérance et d’efficacité. Deux doses de 90 μg d’hémagglutinine sont bien tolérées et 54% des patients avaient un taux d’anticorps supérieur ou égal à 1/40 [
13]. Cette posologie demande de très fortes doses vaccinales, ce qui pose un problème de production en cas de pandémie, et des schémas de réduction de doses sont à l’étude [
14]. La capacité de production vaccinale permettrait de vacciner 1,25% de la population mondiale et la capacité de traitement antiviral de toucher 25 % de la population mondiale [ 4]. La France a donc un plan national dont les grandes lignes de réflexion sont édictées par l’OMS, mais il existe une coordination Européenne ( European center for disease prevention and control). Contrôle vétérinaire Sur le plan du contrôle vétérinaire; il est coordonné au plan international par la FAO ( food and agriculture organization) et l’OIE (office international des épizooties), plus précisément au sein de l’OFFLU (organisation conjointe OIE/FAO). Ces instances donnent des directives afin que chaque pays mène sa propre stratégie de prévention et d’éradication de la grippe aviaire. En France, l’application des directives consultables sur le site du ministère de l’agriculture ont permis une prévention de la diffusion dans la population aviaire sauvage et d’élevage en 2006, mais n’ont pas empêché la survenue de cas aviaires (cas chez des canards sauvages puis cas dans un élevage de dindes à proximité). En cas d’infection de volaille d’élevage, les mesures consistent à abattre l’élevage, détruire les cadavres, nettoyer les locaux et appliquer une zone de protection de 3 km et de surveillance de 10 km. Ce n’est qu’en appliquant rigoureusement de telles mesures qu’une efficacité peut être espérée. Le contrôle de l’épizootie est plus délicat dans les pays disposant de peu de moyens financiers, et particulièrement dans les pays où l’élevage des volailles se fait dans les basse-cours [
15]. Actuellement l’épizootie n’est pas contrôlée en Indonésie, et les foyers épidémiques les plus récents se sont développés au Nigéria, et en Égypte. |
1. Zhou NN, Shortridge KF, Claas EC, Krauss SL, Webster RG. Rapid evolution of H5N1 influenza viruses in chickens in Hong Kong. J Virol 1999; 73 : 3366–74. 2. Li KS, Guan Y, Wang J, et al. Genesis of a highly pathogenic and potentially pandemic H5N1 influenza virus in eastern Asia. Nature 2004; 430 : 209–13. 3. Ungchusak K, Auewarakul P, Dowell SF, et al. Probable person-to-person transmission of avian influenza A (H5N1). N Engl J Med 2005; 352 : 333–40. 4. Bartlett JG. Planning for avian influenza. Ann Intern Med 2006; 145 : 141–4. 5. Kobasa D, Jones SM, Shinya K, et al. Aberrant innate immune response in lethal infection of macaques with the 1918 influenza virus. Nature 2007; 445 : 319–23. 6. Rappole JH, Hubalek Z. Birds and influenza H5NI virus movement to and within North America. Emerg Infect Dis 2006; 12 : 1486–92. 7. Salzberg SL. Genome analysis linking recent European and African influenza (H5N1) viruses. Emerg Infect Dis 2007; 13 : 713–8. 8. Smith GJ, Fan XH, Wang J, et al. Emergence and predominance of an H5N1 influenza variant in China. Proc Natl Acad Sci USA 2006; 103 : 16936–41. 9. Sedyaningsih ER, Isfandari S, Setiawaty V, et al. Epidemiology of cases of H5N1 virus infection in Indonesia, July 2005-June 2006. J Infect Dis 2007; 196 : 522–7. 10. Vong S, Coghlan B, Mardy S, et al. Low frequency of poultry-to-human H5NI virus transmission, southern Cambodia, 2005. Emerg Infect Dis 2006; 12 : 1542–7. 11. Mounier-Jack S, Coker RJ. How prepared is Europe for pandemic influenza ? Analysis of national plans. Lancet 2006; 367 : 1405–11. 12. Coker R, Mounier-Jack S. Pandemic influenza preparedness in the Asia-Pacific region. Lancet 2006; 368 : 886–9. 13. Treanor JJ, Campbell JD, Zangwill KM, et al. Safety and immunogenicity of an inactivated subvirion influenza A (H5N1) vaccine. N Engl J Med 2006; 354 : 1343–51. 14. Riley S, Wu JT, Leung GM. Optimizing the dose of pre-pandemic influenza vaccines to reduce the infection attack rate. PLoS Med 2007; 4 : e218. 15. Songserm T, Jam-On R, Sae-Heng N, et al. Domestic ducks and H5N1 influenza epidemic, Thailand. Emerg Infect Dis 2006; 12 : 575–81. |