| |
| Med Sci (Paris). 2008 March; 24(3): 301–305. Published online 2008 March 15. doi: 10.1051/medsci/2008243301.Inflammation et métabolisme des médicaments NF-κB et les xénorécepteurs CAR et PXR Jean-Marc Pascussi* and Marie-José Vilarem Inserm, U632, Université Montpellier 1, UMR-S632, 1919, route de Mende, 34293 Montpellier, France |
Nous sommes constamment et inévitablement exposés à de nombreuses agressions bactériennes, virales et chimiques. La majorité des agresseurs chimiques sont hydrophobes et leur métabolisme est donc nécessaire pour les rendre plus hydrophiles et plus faciles à éliminer. Ce mécanisme de défense est assuré en grande partie par la fonction de détoxication entéro-hépatique. Cette cascade métabolique a pour but ultime l’augmentation de l’hydrosolubilité et l’efflux hors de l’organisme de molécules exogènes ou endogènes lipophiles potentiellement toxiques. Ce processus est le résultat de l’action coordonnée des enzymes de fonctionnalisation ou de phase I (notamment les cytochromes P450, CYPs), des enzymes de conjugaison ou de phase II (comme les glutathion-S-transférases, les sulfo-transférases et les UDP-glucuronosyl-transférases) et de transporteurs membranaires de phase III [notamment la P-glycoprotéine MDR1 (multidrug resistance) ou les transporteurs OATP2 (organic anion transport protein) et MRP2].
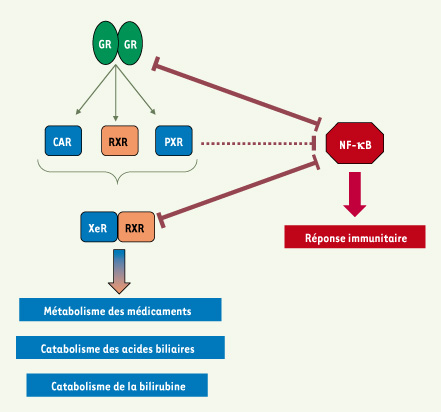
 | Figure 1.
Interférences entre le facteur de transcription pro-inflammatoire NF-kB p65 RelA et les xenorécepteurs CAR et PXR. Dans l’hépatocyte, l’activation de NF-κB p65 RelA (NF-κB) induit d’une part l’inhibition du récepteur des glucocorticoïdes (GR), ce qui conduit à la diminution de l’expression de ses gènes cibles CAR, PXR et RXRα, et d’autre part, à la formation d’hétérodimères inactifs NF-κB p65 RelA:RXR, ce qui provoque l’inhibition des gènes cibles des xénorécepteurs CAR et PXR (XeR). En outre, dans l’entérocyte, l’activation de PXR provoque l’inhibition de l’expression des gènes cibles de NF-κB selon un mécanisme encore inconnu. |
Les récepteurs PXR (pregnane X receptor, NR1I2) et CAR (constitutive androstane receptor, NR1I3) appartiennent à la superfamille des récepteurs nucléaires et coordonnent cette cascade métabolique qui constitue la fonction de détoxication entéro-hépatique [
1]. Ces récepteurs sont majoritairement exprimés dans le foie (hépatocytes) et le tractus digestif (entérocytes). Contrairement à la majorité des récepteurs nucléaires « classiques », chargés de reconnaître une hormone endogène avec une forte affinité et une forte spécificité en vue de régler une fonction physiologique précise, ces récepteurs de faible affinité et de faible spécificité semblent être dédiés à la reconnaissance d’une myriade de molécules toxiques de structure et d’origine diverses en vue de leur métabolisme et élimination. En effet, ils sont activés par de très nombreuses molécules endogènes (hormones stéroïdes, acides biliaires) et exogènes ou xénobiotiques (médicaments, toxines végétales, polluants, pesticides, etc.). De plus, ils contrôlent l’expression des acteurs majeurs des différentes voies impliquées dans l’élimination de ces composés. Sous forme d’hétéro-dimères avec leur partenaire obligatoire, le récepteur RXR de l’acide rétinoïque 9-cis (RXRα), ils se lient à de courtes séquences d’ADN [PXRE (response element) - PXR, ou CARE (response element) - CAR] présentes au sein des promoteurs de leurs nombreux gènes cibles, tels que CYP2B6, CYP3A4, CYP2C8, CYP2C9, UGT1A1, GSTA, MDR1, MRP2, etc. à ce titre, CAR et PXR induisent l’expression des enzymes (réponse adaptative et transitoire) contrôlant les effets thérapeutiques ou toxiques des molécules médicamenteuses dont elles assurent le métabolisme (90 % des médicaments actuels sont métabolisés par les CYP des familles 1, 2 et 3, et environ 60 % par le seul CYP3A4). Le rôle protecteur de PXR et CAR contre les effets néfastes de l’accumulation de composés endogènes ou exogènes dans l’organisme peut cependant engendrer des effets cliniques indésirables. En effet, l’activation de ces récepteurs en réponse à l’exposition, volontaire ou non, à des xénobiotiques (d’origine médicamenteuse ou non médicamenteuse) peut conduire à des variations d’élimination et/ou de production de métabolites toxiques risquant de modifier la pharmacologie et la toxicologie de molécules thérapeutiques. Par exemple, il a été montré que l’hyperforine (retrouvée dans des préparations issues du Millepertuis utilisé en médecine douce en automédication, ou sous forme de tisane dans le traitement de la dépression), ou le taxol (anticancéreux) sont des activateurs très efficaces de PXR et peuvent ainsi réduire de manière significative leur propre efficacité, ou celle des traitements administrés de manière concomitante, en raison de l’activation de la cascade métabolique [
2]. |
CAR, PXR et métabolisme de la bilirubine et des acides biliaires Hormis le métabolisme de composés exogènes, CAR et PXR semblent participer à la régulation de l’homéostasie des acides biliaires et de la bilirubine. En effet, le récepteur PXR reconnaît certains acides biliaires toxiques (notamment les acides biliaires secondaires très hydrophobes, tels que le lithocholate) et régule la captation au niveau de l’hépatocyte, la biosynthèse, le catabolisme et enfin l’excrétion de ces composés [
3,
4,
31]. À ce titre, le rôle de PXR est complémentaire de l’action prépondérante du récepteur FXR (farnesoid X receptor) sur l’homéostasie du cholestérol et des acides biliaires. L’activation de PXR provoque : (1) une augmentation du transporteur OATP-2 ; (2) une diminution de l’expression des CYP7A et CYP8A, enzymes clés de la conversion du cholestérol en acides biliaires ; (3) une forte induction du CYP3A4 chargé de la 6β-hydroxylation de ces composés toxiques ; et enfin (4) une augmentation du transporteur d’efflux BSEP (bile salt export pump). Le fait que la rifampicine possède une affinité importante pour ce récepteur expliquerait son action bénéfique (notamment antiprurigineuse en diminuant la sensation de démangeaison épidermique ou sous-épidermique) observée chez certains patients qui développent une cholestase [
5]. Par ailleurs, le récepteur CAR, initialement caractérisé comme le récepteur responsable de l’induction des CYP2B6 et CYP3A4 par le phénobarbital [
6], semble être très fortement impliqué dans le contrôle de l’homéostasie de la bilirubine. En effet, il a été rapporté que ce récepteur est, d’une part activable par des taux élevés de bilirubine intra-hépatocytaire, et d’autre part, il compte parmi ses gènes cibles SLC21A6, l’UGT1A1 et MRP2, respectivement impliqués dans la captation hépatique, le métabolisme et l’efflux de la bilirubine vers le canal biliaire [
7–
9]. Autrement dit, via l’activation de CAR, la bilirubine induit sa propre clairance. Ces observations expliquent, a posteriori, les bienfaits de l’utilisation du phénobarbital ou des décoctions de thés issues de la pharmacopée chinoise à base d’Artemisiae, qui s’avèrent contenir un activateur puissant de CAR (6,7 dimethylesculetin), lors de certaines formes graves de jaunisse du nourrisson [
10]. |
Influence de l’inflammation et de l’infection sur la fonction de détoxication entéro-hépatique Interférence avec les glucocorticoïdes et les cytokines L’activation des récepteurs PXR et CAR par des médicaments ou des molécules endogènes est à l’origine de l’induction des enzymes et transporteurs de la fonction de détoxication entéro-hépatique. À l’inverse, il est connu que l’inflammation et l’infection inhibent la fonction de détoxication entéro-hépatique et le métabolisme des médicaments [
11], avec des conséquences cliniques et toxicologiques importantes [
12]. Ces altérations de clairance peuvent entraîner une perte de l’efficacité thérapeutique ou une toxicité sévère de certains médicaments. De plus, certains syndromes inflammatoires ou infectieux chroniques provoquent des cholestases intra-hépatiques et/ou des hyperbilirubinémies [
13,
14]. Ces effets, longtemps inexpliqués, peuvent être maintenant rapportés à la diminution de l’expression des acteurs majeurs de la fonction de détoxication entéro-hépatique chez ces patients. Notamment, nous avons observé que l’expression et l’activité des récepteurs CAR et PXR sont étroitement régulées par des médiateurs pro- et anti-inflammatoires. En effet, alors que l’expression des gènes PXR et CAR est augmentée par les glucocorticoïdes lors de l’activation du récepteur GR ( glucocorticoid receptor) [
15,
16], certaines cytokines et molécules pro-inflammatoires (dont l’interleukine-6 [IL-6], l’IL-1β, et les lipo-polysaccharides ou LPS) inhibent l’expression transcriptionnelle de ces récepteurs [
17,
18]. Nous avons montré que les glucocorticoïdes sont nécessaires au maintien de l’expression des récepteurs CAR et PXR et à l’inductibilité de leurs gènes cibles dans l’hépatocyte humain. A contrario, des stimulus pro-inflammatoires comme les cytokines IL-1β et IL-6 ou le LPS inhibent de façon significative l’expression des ARNm codant les récepteurs PXR et CAR. L’étude de la cinétique d’action de ces molécules pro-inflammatoires montre une inhibition rapide et réversible des niveaux d’expression des récepteurs PXR et CAR. Il en résulte une diminution significative de l’expression basale et de l’inductibilité des CYP, enzymes de phase II et transporteurs normalement régulés par ces récepteurs. Ces travaux ont en outre permis de montrer l’importance du facteur nucléaire-κB (NF-κB) et de la protéine activatrice-1 (AP-1), deux facteurs transcriptionnels majeurs impliqués dans l’inflammation, dans l’inhibition de l’expression de CAR et PXR dans l’hépatocyte humain. En effet, une fois activées, ces protéines interfèrent négativement avec la voie de signalisation du GR et répriment ainsi la transcription des xénorécepteurs CAR et PXR et de leurs gènes cibles. Le rôle pivot de la famille NF-κB : inhibition de l’activité transcriptionnelle de PXR La famille NF-κB a un rôle pivot dans la régulation de la réponse immunitaire. Sous leurs formes inactives, les dimères NF-κB p65 RelA:p50 sont retenus dans le cytoplasme par leur association avec les protéines inhibitrices IκB. En réponse à des stimulus pro-inflammatoires, les IκB sont rapidement phosphorylées, ubiquitinylées et finalement dégradées. Les dimères NF-κB p65 RelA:p50 ainsi libérés passent dans le noyau et provoquent, d’une part l’activation de la transcription de gènes cibles spécifiques [
19] et d’autre part, l’inhibition de nombreux récepteurs nucléaires stéroïdiens dont le GR [
32]. NF-κB p65 RelA joue un rôle essentiel dans la réponse aux LPS ou aux cytokines pro-inflammatoires dans l’hépatocyte [
20,
21]. Nous avons identifié le site d’association du GR sur le promoteur CAR [
22] et pu mettre en évidence le rôle de l’antagoniste fonctionnel GR/NF-κB p65 RelA dans l’inhibition de la transcription de CAR par l’IL-1β et le LPS [ 17]. Par la suite, d’autres études ont confirmé nos résultats, notamment in vivo chez les rongeurs. En effet, chez la souris, le LPS provoque une inhibition du niveau d’expression des ARN messagers codant pour les CYP3A11, CYP2A5, CYP2C29 [
23], ou une inhibition du transporteur des xénobiotiques mrp2 [
24]. De plus, ces effets sont atténués chez la souris dépourvue du gène codant pour le récepteur PXR ( pxr−/−
), suggérant un rôle de PXR dans cette régulation [ 24]. De même, une diminution de l’expression des récepteurs nucléaires PXR, CAR, et RXRα a été démontrée par des analyses de microarray sur des ARN issus de foies de rats Wistar traités au LPS [
25]. Enfin, le rôle prépondérant de l’expression des récepteurs PXR, CAR et RXR sur le mécanisme d’inhibition des CYP3A et 2B a été confirmé et précisé par les travaux de Xu [
26] et Beigneux [
27] qui montrent que l’inhibition de l’expression des CYP3A et 2B10 est associée à une diminution de l’expression de PXR, CAR et RXR. Récemment, une inhibition fonctionnelle entre NF-κB et PXR a été révélée, comme il existe une inhibition fonctionnelle entre NF-κB et GR. Notamment, il a été montré que l’activation de NF-κB inhibe l’induction du CYP3A4 par le PXR in vivo [
28] et in vitro [
29]. NF-κB diminue l’activité transcriptionnelle de PXR, alors que l’inhibition de NF-κB augmente la transactivation des gènes cibles du PXR. Gu et al. ont pu mettre en évidence que l’activation de NF-κB p65 RelA provoque la diminution de l’interaction entre l’hétérodimère PXR:RXRα et les séquences PXRE du promoteur du gène CYP3A4 [29]. Contrairement à l’interaction directe qui existe entre le GR et NF-κB p65 RelA, il n’y a pas d’association physique directe entre PXR et NF-κB p65 RelA. Il semble que ce soit le domaine de liaison à l’ADN (DNA binding domain ou DBD) du RXRα qui interagisse avec NF-κB p65 RelA. Ces résultats suggèrent que d’autres partenaires de RXRα pourraient être la cible d’une telle inhibition en réponse à l’activation de NF-κB p65 RelA. Il serait très intéressant de définir dans quelle mesure l’activité transcriptionnelle de CAR peut être affectée lors de l’activation de la voie NF-κB. Enfin, il a été montré in vivo chez la souris que l’activation de PXR provoque une diminution de l’expression des gènes cibles de la voie NF-κB, tels que COX-2, TNF-α et ICAM-1, mais uniquement au niveau des entérocytes [28]. Ces effets ne sont plus observés en l’absence de PXR (souris pxr−/−
). De même, une surexpression de ces mêmes gènes ainsi qu’une inflammation de l’intestin dans les souris pxr−/−
par rapport aux souris témoins ont été observées, suggérant que PXR inhibe l’expression des gènes cibles de la voie NF-κB dans cet organe. Ces résultats semblent être à rapprocher d’une récente observation clinique suggérant un lien entre une altération fonctionnelle de PXR et/ou une expression réduite de PXR et l’apparition d’un syndrome inflammatoire du tractus gastro-intestinal (IBD, inflammatory bowel diseases) [
30]. |
Ainsi, il semble de plus en plus évident que les deux systèmes de défense de l’organisme, l’un, le système immunitaire, dédié à la reconnaissance et à l’éradication des intrus bactériens, viraux ou cellulaires, et l’autre dédié à la reconnaissance et au métabolisme d’agresseurs chimiques lipophiles, interfèrent en s’inhibant mutuellement. Ces résultats permettent de mieux comprendre les différents mécanismes moléculaires à la base de ces interactions fonctionnelles. D’une part, les cytokines pro-inflammatoires inhibent l’expression basale et induite des enzymes et des transporteurs de la fonction de détoxication entéro-hépatique ainsi que celle des récepteurs nucléaires CAR et PXR chargés de coordonner leur expression. D’autre part, le facteur de transcription NF-κB p65 RelA bloquerait l’activité transcriptionnelle de PXR, et peut-être celle de CAR, en se liant à leur partenaire obligatoire RXRα. En outre, il serait très intéressant de définir dans quelle mesure l’activité trancriptionnelle de RXRα, CAR et PXR peut être affectée en réponse à l’activation de la voie AP-1, notamment le rôle de la sous-unité Jun de AP-1 qui est connue pour interagir en situation intranucléaire avec le complexe glucocorticoïde-GR. |
1. Waxman DJ. P450 gene induction by structurally diverse xenochemicals: central role of nuclear receptors CAR, PXR, and PPAR. Arch Biochem Biophys 1999; 369 : 11–23. 2. Mannel M. Drug interactions with St John’s wort : mechanisms and clinical implications. Drug Saf 2004; 27 : 773–97. 3. Kliewer SA, Willson TM. Regulation of xenobiotic and bile acid metabolism by the nuclear pregnane X receptor. J Lipid Res 2002; 43 : 359–64. 4. Xie W, Radominska-Pandya A, Shi Y, et al. An essential role for nuclear receptors SXR/PXR in detoxification of cholestatic bile acids. Proc Natl Acad Sci USA 2001; 98 : 3375–80. 5. Ghent CN, Carruthers SG. Treatment of pruritus in primary biliary cirrhosis with rifampin. Results of a double-blind, crossover, randomized trial. Gastroenterology 1988; 94 : 488–93. 6. Sueyoshi T, Negishi M. Phenobarbital response elements of cytochrome P450 genes and nuclear receptors. Annu Rev Pharmacol Toxicol 2001; 41 : 123–43. 7. Huang W, Zhang J, Chua SS, et al. Induction of bilirubin clearance by the constitutive androstane receptor (CAR). Proc Natl Acad Sci USA 2003; 100 : 4156–61. 8. Sugatani J, Kojima H, Ueda A, et al. The phenobarbital response enhancer module in the human bilirubin UDP-glucuronosyltransferase UGT1A1 gene and regulation by the nuclear receptor CAR. Hepatology 2001; 33 : 1232–8. 9. Wagner M, Halilbasic E, Marschall HU, et al. CAR and PXR agonists stimulate hepatic bile acid and bilirubin detoxification and elimination pathways in mice. Hepatology 2005; 42 : 420–30. 10. Huang W, Zhang J, Moore DD. A traditional herbal medicine enhances bilirubin clearance by activating the nuclear receptor CAR. J Clin Invest 2004; 113 : 137–43. 11. Aitken AE, Richardson TA, Morgan ET. Regulation of drug-metabolizing enzymes and transporters in inflammation. Annu Rev Pharmacol Toxicol 2006; 46 : 123–49. 12. Morgan ET. Regulation of cytochromes P450 during inflammation and infection. Drug Metab Rev 1997; 29 : 1129–88. 13. Moseley RH. Sepsis-associated cholestasis. Gastroenterology 1997; 112 : 302–6. 14. Trauner M, Fickert P, Stauber RE. Inflammation-induced cholestasis. J Gastroenterol Hepatol 1999; 14 : 946–59. 15. Pascussi JM, Drocourt L, Fabre JM, et al. Dexamethasone induces pregnane X receptor and retinoid X receptor-alpha expression in human hepatocytes: synergistic increase of CYP3A4 induction by pregnane X receptor activators. Mol Pharmacol 2000; 58 : 361–72. 16. Pascussi JM, Gerbal-Chaloin S, Fabre JM, et al. Dexamethasone enhances constitutive androstane receptor expression in human hepatocytes: consequences on cytochrome P450 gene regulation. Mol Pharmacol 2000; 58 : 1441–50. 17. Assenat E, Gerbal-Chaloin S, Larrey D, et al. Interleukin 1beta inhibits CAR-induced expression of hepatic genes involved in drug and bilirubin clearance. Hepatology 2004; 40 : 951–60. 18. Pascussi JM, Gerbal-Chaloin S, Pichard-Garcia L, et al. Interleukin-6 negatively regulates the expression of pregnane X receptor and constitutively activated receptor in primary human hepatocytes. Biochem Biophys Res Commun 2000; 274 : 707–13. 19. Karin M, Ben-Neriah Y. Phosphorylation meets ubiquitination: the control of NF-kappaB activity. Annu Rev Immunol 2000; 18 : 621–63. 20. McKay LI, Cidlowski JA. Cross-talk between nuclear factor-kappa B and the steroid hormone receptors: mechanisms of mutual antagonism. Mol Endocrinol 1998; 12 : 45–56. 21. Widen C, Gustafsson JA, Wikstrom AC. Cytosolic glucocorticoid receptor interaction with nuclear factor-kappa B proteins in rat liver cells. Biochem J 2003; 373 : 211–20. 22. Pascussi JM, Busson-Le Coniat M, Maurel P, Vilarem MJ. Transcriptional analysis of the orphan nuclear receptor constitutive androstane receptor (NR1I3) gene promoter: identification of a distal glucocorticoid response element. Mol Endocrinol 2003; 17 : 42–55. 23. Iber H, Sewer MB, Barclay TB, et al. Modulation of drug metabolism in infectious and inflammatory diseases. Drug Metab Rev 1999; 31 : 29–41. 24. Teng S, Piquette-Miller M. The involvement of the pregnane X receptor in hepatic gene regulation during inflammation in mice. J Pharmacol Exp Ther 2005; 312 : 841–8. 25. Fang C, Yoon S, Tindberg N, et al. Hepatic expression of multiple acute phase proteins and down-regulation of nuclear receptors after acute endotoxin exposure. Biochem Pharmacol 2004; 67 : 1389–97. 26. Xu DX, Wei W, Sun MF, et al. Kupffer cells and reactive oxygen species partially mediate lipopolysaccharide-induced downregulation of nuclear receptor pregnane x receptor and its target gene CYP3a in mouse liver. Free Radic Biol Med 2004; 37 : 10–22. 27. Beigneux AP, Moser AH, Shigenaga JK, Grunfeld C, Feingold KR. Reduction in cytochrome P-450 enzyme expression is associated with repression of CAR (constitutive androstane receptor) and PXR (pregnane X receptor) in mouse liver during the acute phase response. Biochem Biophys Res Commun 2002; 293 : 145–9. 28. Zhou C, Tabb MM, Nelson EL, et al. Mutual repression between steroid and xenobiotic receptor and NF-kappaB signaling pathways links xenobiotic metabolism and inflammation. J Clin Invest 2006; 116 : 2280–9. 29. Gu X, Ke S, Liu D, et al. Role of NF-kappaB in regulation of PXR-mediated gene expression: a mechanism for the suppression of cytochrome P-450 3A4 by proinflammatory agents. J Biol Chem 2006; 281 : 17882–9. 30. Dring MM, Goulding CA, Trimble VI, et al. The pregnane X receptor locus is associated with susceptibility to inflammatory bowel disease. Gastroenterology 2006; 130 : 341–8 et 592. 31. Poupon R, Chignard N, Rosmorduc O, Barbu V, Housset C. La fonction biliaire et sa régulation. Med Sci (Paris) 2004; 20 : 1096–9. 32. Vlaeminck-Guillem V, Laudet V, Duterque-Coquillaud M. Interactions négatives entre récepteurs nucléaires et facteurs transcriptionnels. Med Sci (Paris) 2003; 19 : 1121–7. |