| |
| Med Sci (Paris). 2008 March; 24(3): 233–234. Published online 2008 March 15. doi: 10.1051/medsci/2008243233.Une cigarette, un aromatique… et un cancer Vincent Mocquet,1* Jean Marc Egly,1* and Nicholas Geacintov2* 1Institut de Génétique et de Biologie Moléculaire et Cellulaire, IGBMC, 1, rue Laurent Fries, BP 10142, 67404 Illkirch Cedex, CU Strasbourg, France 2Chemistry Department, New York University, New York, États-Unis MeSH keywords: Cancérogènes environnementaux, ADN, Adduits à l'ADN, Altération de l'ADN, Réparation de l'ADN, DNA-directed DNA polymerase, Désoxyguanosine, Température chaude, Humains, Tumeurs du poumon, Tabagisme, Relation structure-activité, Spécificité du substrat |
Depuis la deuxième moitié du XXe siècle, la dégradation de l’hygiène alimentaire, l’exposition aux rayonnements UV ou à certains produits chimiques sont parmi les principaux facteurs de risque du développement de cancers. Les études épidémiologiques de l’OMS mettent en évidence que ces expositions, dans le cadre du travail, provoque jusqu’à 200 000 morts par an dans les pays développés [
1]. Dans le domaine industriel, par exemple, les hydrocarbures provenant du charbon et du pétrole ont été impliqués dans le développement de cancers des voies aériennes, de la peau ou même de la vessie, chez les ouvriers des fours à coke, ou ceux manipulant les goudrons, les imprimeurs et les couvreurs. Cependant, dans les pays occidentaux, le facteur de risque principal est le tabagisme, responsable à lui seul d’environ un tiers des cas de cancers [
2]. En France, chaque année, 90 % des 25 000 patients atteints de cancers bronchiques sont fumeurs. |
Production de composés aromatiques cancérigènes Le lien entre tabagisme et cancer a été évoqué dès les années 1930. Aujourd’hui, au moins 200 agents cancérigènes ont été décelés parmi plus de 4 000 substances candidates présentes dans les différentes phases de la fumée de cigarette [
3]. Généralement, une cigarette se consume suivant une succession de combustions incomplètes. Entre chaque bouffée, la température du cône de combustion chute de 850°C à 600°C, en raison d’un déficit en oxygène. La combustion lente des goudrons produit alors des composés aromatiques polycycliques tels que les Benzo[a]pyrènes (B[a]P). Ces aromatiques sont hautement cancérigènes et se retrouvent principalement dans la phase particulaire de la fumée. Chaque cigarette en produit environ 70 ng. De tels composés se retrouvent d’ailleurs dans tous les produits de combustion incomplète, fumées de barbecue ou gaz d’échappement. Néanmoins le B[a]P est chimiquement inerte en tant que tel et nécessite une conversion enzymatique au niveau cellulaire afin de devenir actif : c’est un pro-carcinogène. Sa biotransformation est assurée par des mono-oxygénases dépendantes du cytochrome p450, qui convertissent les composés liposolubles en dérivés plus solubles, dont le génotoxique diol époxide de B[a]P (BPDE) et ses formes énantiomères : majoritairement le (+)-anti-BPDE et le (-)-anti-BPDE [
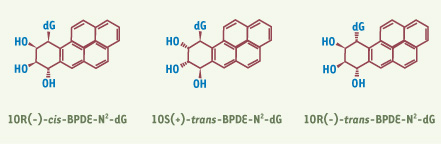
4]. Certaines quantités restant dans notre organisme réagissent avec l’ADN et forment, de façon sélective, des liaisons covalentes avec les guanines : le (+)-trans-BPDE-N2-désoxyguanosine, le (+)-cis-BPDE-N2-désoxyguanosine et le (-)-trans-BPDE-N2-désoxyguanosine [
5]. Ces trois adduits diffèrent seulement les uns des autres par l’orientation des groupements OH et du résidu guanine (Figure 1). De par leur structure, ces trois formes stéréo-isomériques d’adduits peuvent soit s’intercaler entre les deux hélices de l’ADN ((+)-cis-BPDE), soit se positionner dans le petit sillon de la double hélice ((+)/(-)-trans-BPDE). Contrairement aux (+)/(-)-trans-BPDE, le (+)-cis-BPDE provoque aussi l’extrusion d’une base hors de la double hélice. Au niveau cellulaire, ces adduits peuvent bloquer des ADN et ARN polymérases en élongation, provoquant ainsi une dérive apoptotique. Quand les polymérases parviennent tout de même à franchir la lésion, elles incorporent souvent un nucléotide aspécifique. Ainsi, en présence de (+)/(-)-trans-BPDE-dG, des substitutions d’une guanine en thymine G/T et/ou en adénine G/A ont pu être observées [
6], ce qui constitue un important facteur de risque dans l’apparition des cancers.
 | Figure 1.
Structure des ADN endommagés. Structure des trois stéréo-isomères de B[a]P et leur incorporation dans l’ADN. dG : désoxyguanosine. |
|
L’efficacité de la reconnaissance du dommage à l’ADN et de sa réparation dépend du type d’adduit formé Afin de préserver l’intégrité de son ADN, support de l’information génétique, la cellule s’est dotée de plusieurs mécanismes de réparation dont le système de la réparation par excision de nucléotides (NER). Ce mécanisme permet d’éliminer un dommage par excision du fragment d’ADN lésé, restaurant ainsi l’ADN dans sa structure première. Au cours d’un de nos travaux, il a été démontré que la NER peut réparer les ADN ayant incorporé chacune des trois formes stéréo-isomériques d’adduits [
7]. Point de départ de cette réaction qui implique jusqu’à 11 facteurs différents soit plus de 30 protéines, le complexe XPC-HR23B est le facteur à qui incombe la lourde charge de reconnaître le dommage. Il induit lui même une torsion de l’ADN, engendrant une région pré-ouverte nécessaire au recrutement des autres facteurs dont TFIIH [
8]. Nous avons montré que l’efficacité de réparation était fonction de la nature stéréo-isomèrique de l’adduit BPDE incorporé et de la structure qu’il induit dans l’ADN (Figure 1) ; ainsi a-t-on trouvé dans l’ordre décroissant : (+)-cis-BPDE » (+)-trans-BPDE > (-)-trans-BPDE [7]. L’explication est que XPC-HR23B est sélectif dans sa reconnaissance de la structure d’ADN engendrée par chacun de ces adduits et que l’élimination du fragment endommagé est directement dépendante de l’efficacité de reconnaissance du dommage par le facteur XPC-HR23B. En outre, l’analyse de la structure globale de chacun des 3 ADN endommagés, de leur point de fusion respectif, des interactions de stacking dues à l’adduit, etc., nous a permis de préciser que la fixation d’XPC-HR23B sur l’ADN et la déshybridation locale qu’il génère (en d’autres termes la reconnaissance du dommage) seraient facilitées par la déstabilisation générale de la structure de l’ADN, due à la présence d’une lésion. |
Notre étude explique pourquoi certains composés comme le (+)-trans-BPDE (la forme majoritaire après métabolisation du B[a]P [5]) ont un fort pouvoir cancérigène : les lésions induites par ce type de composé sont mal détectées donc mal réparées. À la suite de l’inhalation de fumée de cigarette, par exemple, l’ADN subit une déstabilisation suffisante pour engendrer des mutations, mais insuffisante pour que la lésion soit efficacement reconnue par la machinerie de réparation. |
1. Pandey KR. Occupational cancer kills more than 200 000 people a year. Br Med J 2007; 334 : 925. 2. Doll R, Peto R. The causes of cancer: quantitative estimates of avoidable risks of cancer in the United States today. J Natl Cancer Inst 1981; 66 : 1191–308. 3. Brunnemann KD, Kagan MR, Cox JE, et al. Determination of benzene, toluene and 1,3-butadiene in cigarette smoke by GC-MDS. Exp Pathol 1989; 37 : 108–13. 4. Buening MK, Wislocki PG, Levin W, et al. Tumorigenicity of the optical enantiomers of the diastereomeric benzo[a]pyrene 7,8-diol-9,10-epoxides in newborn mice: exceptional activity of (+)-7beta,8alpha-dihydroxy-9alpha,10alpha-epoxy-7,8,9, 10-tetrahydrobenzo[a ]pyrene. Proc Natl Acad Sci USA 1978; 75 : 5358–61. 5. Szeliga J, Dipple A. DNA adduct formation by polycyclic aromatic hydrocarbon dihydrodiol epoxides. Chem Res Toxicol 1998; 11 : 1–11. 6. Zhao B, Wang J, Geacintov NE, et al. Poleta, Polzeta and Rev1 together are required for G to T transversion mutations induced by the (+)- and (-)-trans-anti-BPDE-N2-dG DNA adducts in yeast cells. Nucleic Acids Res 2006; 34 : 417–25. 7. Mocquet V, Kropachev K, Kolbanovskiy M, et al. The human DNA repair factor XPC-HR23B distinguishes stereoisomeric benzo[a]pyrenyl-DNA lesions. EMBO J 2007; 26 : 2923–32. 8. Riedl T, Hanaoka F, Egly JM. The comings and goings of nucleotide excision repair factors on damaged DNA. EMBO J 2003; 22 : 5293–303. |