| |
| Med Sci (Paris). 2008 February; 24(2): 122–123. Published online 2008 February 15. doi: 10.1051/medsci/2008242122.β-caténine et N-ras Une association dangereuse pour le mélanocyte Corine Bertolotto* Biologie et Pathologie des cellules mélanocytaires,Inserm U895, 28, avenue de Valombrose, Université de Nice Sophia-Antipolis UFR de Médecine, Nice, F-06107, France MeSH keywords: Humains, Mélanocytes, Mélanome, Naevus, Tumeurs cutanées, bêta-Caténine, Protéines G ras |
Les mélanocytes sont des cellules spécialisées dans la production des pigments mélaniques responsables de la couleur de la peau, des cheveux et des yeux. La transformation du mélanocyte conduit au mélanome, une tumeur très agressive qui représente l’une des formes les plus dangereuse de cancer de la peau, puisque les mélanomes sont responsables de 80 % des décès par cancer cutané. La transformation tumorale du mélanocyte résulte, comme dans de nombreux cancers, de modifications épigénétiques et génétiques qui vont entraîner l’activation de voies de signalisation assurant prolifération et survie cellulaires. L’activation de ces voies va permettre à la tumeur de se développer, de croître, de résister aux mécanismes de défense anti-tumorale mis en place par l’organisme et finalement de métastaser à distance via les systèmes lymphatique et sanguin. Dans sa forme métastatique, le mélanome est réfractaire à toutes les thérapies existantes et la médiane de survie ne dépasse pas 6 mois, témoignant d’un pronostic vital extrêmement mauvais [
1]. Il est donc urgent de mieux comprendre les mécanismes impliqués dans la pathogénicité du mélanome malin afin d’identifier de nouveaux facteurs diagnostiques et pronostiques et de nouvelles cibles moléculaires [
2,
3]. |
Voies de signalisation des mélanomes Chez l’homme, la voie MAPK/ERK est souvent activée dans les cellules de mélanome cutané, conséquence de mutations oncogéniques dans N-Ras et B-Raf et il en est de même pour la voie Wnt/β-caténine, ce qui témoigne d’une activité proliférative élevée [
4–
6]. Inversement, parmi les protéines qui mettent un frein à cette prolifération cellulaire, le produit du gène suppresseur de tumeur p16Ink4a est muté ; le gène est délété ou réprimé à la suite de méthylations de son promoteur et sa perte conduit à l’immortalisation des mélanocytes. p16 est également un élément majeur du processus de sénescence, phase pendant laquelle les mélanocytes ne prolifèrent plus mais restent métaboliquement actifs, et qui agit comme une barrière à la tumorigenèse [
7,
8] (Figure 1).
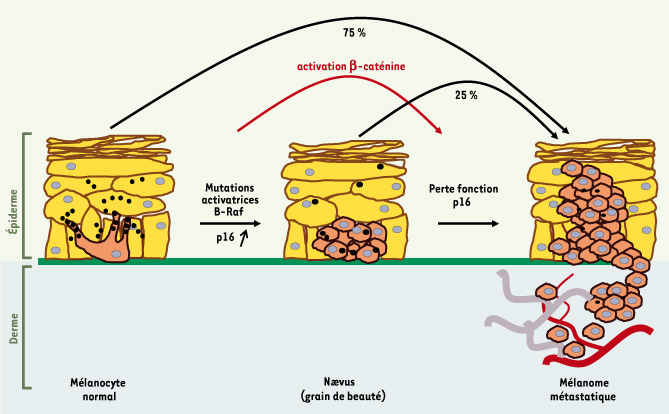
 | Figure 1.
Chez l’homme, la transformation maligne du mélanocyte de la peau, qui résulte entre autre de modifications génétiques, conduit au mélanome. Il a été montré qu’une mutation activatrice de B-Raf entraîne une prolifération modérée des mélanocytes qui s’arrête ensuite rapidement dans une phase dite de sénescence pour former un naevus. Des altérations géniques additionnelles, comme la perte de p16, seraient ensuite nécessaires au développement de la tumeur. Toutefois, dans 75 % des cas, le mélanome ne se forme pas à partir d’un nævus pré-existant. L’activation de la β-caténine pourrait donc bloquer l’induction de p16 consécutive à la mutation de B-Raf, court-circuiter la phase de sénescence et favoriser la transformation des mélanocytes. |
Dans 25 % des cas, le mélanome ne se développe pas directement à partir d’un mélanocyte mais à partir d’un naevus pré-existant. Le nævus, communément appelé « grain de beauté », représente une tumeur bénigne formée, selon le modèle établi chez l’homme, à la suite de la mutation oncogénique de B-Raf (B-Rafv600E) [3], qui a stimulé la prolifération des mélanocytes normaux, mais celle-ci s’est terminé prématurément par une entrée en sénescence, via l’induction de p16. Dans la majorité des cas, cette entité reste indolente pendant des décennies et n’évolue pas vers la malignité [
9] (Figure 1).
|
β-caténine et p16 dans l’immortalisation des mélanocytes Le groupe de Lionel Larue a étudié la contribution de la β-caténine dans l’homéostasie mélanocytaire en construisant un modèle de souris exprimant, spécifiquement dans les mélanocytes, une forme active de la β-caténine [
10]. Les auteurs montrent que ce mutant actif de la β-caténine, constitutivement localisé au noyau des cellules, n’est pas suffisant pour induire la formation de mélanomes mais qu’il augmente la pénétrance et la fréquence des mélanomes chez des souris exprimant spécifiquement dans les mélanocytes une forme oncogénique de N-Ras (N-RasQ61K) [
11]. Les auteurs se sont ensuite attachés à comprendre le mécanisme d’action de cette forme active de la β-caténine. Ils montrent que la β-caténine active n’augmente pas la prolifération des mélanocytes, mais induit leur immortalisation, une des étapes précoces de la transformation. Comme nous l’avons mentionné précédemment, la perte de fonction de p16 est la principale cause de l’immortalisation mélanocytaire. C’est ainsi que les auteurs se sont intéressés à p16 et qu’ils ont observé que cette β-caténine active diminue l’activité du promoteur de p16Ink4a et conduit ainsi à une inhibition de l’expression de cette protéine. |
Les travaux du groupe de L. Larue montrent que l’activation de la β-caténine, et l’inhibition de p16 associée, entraînent l’immortalisation des mélanocytes et que cette immortalisation peut coopérer avec la prolifération soutenue des mélanocytes qui est induite par l’activation constitutive de N-Ras, ce qui a pour conséquence de court-circuiter le processus de sénescence et de favoriser la transformation des mélanocytes et le développement des mélanomes. Chez l’homme, on peut également envisager que l’activation de la β-caténine, en diminuant l’expression de p16, participe à l’immortalisation des cellules des nævus en favorisant également la progression vers des stades malins. Afin de continuer à mieux comprendre le rôle et l’importance de cette voie dépendante de la β-caténine dans le développement des mélanomes, il serait maintenant intéressant de croiser les souris exprimant la β-caténine active avec d’autres modèles de souris exprimant spécifiquement dans les mélanocytes des protéines impliquées dans le développement des mélanomes, comme la forme oncogénique de B-Raf (B-Rafv600E). Le travail de L. Larue apporte donc une nouvelle pierre à l’édifice dans la compréhension des mécanismes moléculaires impliqués dans la pathogénicité du mélanome malin et renforce le fait que la β-caténine constitue une cible thérapeutique importante. |
1. Chin L, Garraway LA, Fisher DE. Malignant melanoma : genetics and therapeutics in the genomic era. Genes Dev 2006; 20 : 2149–82. 2. Ghiringhelli F, Zitvogel L. Stratégies vaccinales contre le mélanome. Med Sci (Paris) 2006; 22 : 183–7. 3. Dalle S, Martin-Denavit T, Thomas L. Hypervariabilité génotypique des mélanomes : un défi thérapeutique. Med Sci (Paris) 2006; 22 : 178–82. 4. Davies H, Bignell GR, Cox C, et al. Mutations of the BRAF gene in human cancer. Nature 2002; 417 : 949–54. 5. Larue, L, Delmas V. The WNT/Beta-catenin pathway in melanoma. Front Biosci 2006; 11 : 733–42. 6. Blanpain C. Importance de la voie de signalisation Wnt/bêta-caténine dans l’identité, l’activation et la différenciation des cellules souches épidermiques. Med Sci (Paris) 2007; 23 : 34–6. 7. Gray-Schopfer VC, Cheong SC, Chong H, et al. Cellular senescence in naevi and immortalisation in melanoma : a role for p16? Br J Cancer 2006; 95 : 496–505. 8. Sviderskaya EV, Gray-Schopfer VC, Hill SP, et al. p16/cyclin-dependent kinase inhibitor 2A deficiency in human melanocyte senescence, apoptosis, and immortalization : possible implications for melanoma progression. J Natl Cancer Inst 2003; 95 : 723–32. 9. Michaloglou C, Vredeveld LC, Soengas MS, et al. BRAFE600-associated senescence-like cell cycle arrest of human naevi. Nature 2005; 436 : 720–4. 10. Delmas V, Beermann F, Martinozzi S, et al. Beta-catenin induces immortalization of melanocytes by suppressing p16INK4a expression and cooperates with N-Ras in melanoma development. Genes Dev 2007; 21 : 2923–35. 11. Ackermann J, Frutschi M, Kaloulis K, et al. Metastasizing melanoma formation caused by expression of activated N-RasQ61K on an INK4a-deficient background. Cancer Res 2005; 65 : 4005–11. |