| |
| Med Sci (Paris). 2008 December; 24(12): 1083–1088. Published online 2008 December 15. doi: 10.1051/medsci/200824121083.Voie alternative d’activation de NF-κB et cancer Amis ou ennemis ? Véronique Baud1,2* and Emilie Jacque1,2,3 1Institut Cochin, Université Paris Descartes, CNRS (UMR 8104), Paris, France 2Inserm U567-Département d’Hématologie, Maternité Port-Royal-Institut Cochin, 123, boulevard de Port-Royal, 75014, Paris, France 3Division of Immune Cell Biology, National Institute for Medical Research, The Ridgeway, Mill Hill, London NW7 1AA, Royaume-Uni |
Une vingtaine d’années après leur découverte, l’intérêt que suscitent les facteurs de transcription NF-κB (nuclear factor kB) émane de la multiplicité des réponses cellulaires auxquelles ces facteurs sont associés. Ils jouent en effet un rôle central dans la réponse inflammatoire, l’immunité innée et acquise, la balance survie/mort cellulaire, mais aussi la tumorigenèse [
1–
5]. Ainsi, une dérégulation de l’activité des facteurs NF-κB, via la production de formes anormales de NF-κB, ou un défaut de leurs activités transcriptionnelles, est retrouvée de manière récurrente dans des lymphomes et des leucémies, mais aussi dans des tumeurs solides [5,
37]. Plus récemment, il a été mis en évidence que les facteurs NF-κB participent également au développement des tumeurs en activant des gènes de résistance à l’apoptose, rendant certaines tumeurs résistantes aux traitements chimiothérapeutiques et radiothérapeutiques [
6]. |
Voie canonique et voie alternative d’activation de NF-κB La famille NF-κB compte cinq membres chez les vertébrés : NF-κB1 (p50 et son précurseur p105), NF-κB2 (p52 et son précurseur p100), c-Rel, RelA (p65) et RelB [
7] (Figure 1). Ces protéines se lient à l’ADN sous forme d’homo- et d’hétérodimères, dont l’activité transcriptionnelle est régulée par deux voies principales. La première, connue sous le terme de voie d’activation canonique de NF-κB, s’applique majoritairement aux dimères RelA/p50 et repose sur la distribution cellulaire de ces dimères (Figure 2). En l’absence d’activation, les dimères RelA/p50 sont séquestrés dans le cytoplasme par leur association avec les protéines inhibitrices IκB (inhibitor of NF-kB). En réponse à de nombreux stimuli, parmi lesquels des cytokines, des agents mitogènes, des ARN double brin, des facteurs de croissance, des produits viraux ou bactériens et diverses formes de stress cellulaires (oxydatif, radiations, agents génotoxiques), les IκB sont rapidement phosphorylés par la kinase IκB (IKK) sur des résidus sérine spécifiques, puis ubiquitinylés, et finalement dégradés par le protéasome 26S [
8]. Les dimères RelA/p50 ainsi libérés de leur inhibiteur parviennent alors dans le noyau où ils activent la transcription de gènes cibles spécifiques (Figure 2). Plus récemment, une seconde voie d’activation de NF-κB, qui s’applique principalement à RelB, a été caractérisée. Cette voie, appelée voie d’activation alternative de NF-κB (Figure 3), est induite par différents membres de la superfamille du TNF (tumor necrosis factor) (CD40L, lymphotoxine β, BAFF ou B cell-activating factor belonging to the TNF family…), des protéines virales (LMP1 du virus EBV ou Epstein-Barr virus, Tax du virus HTLV1 ou human T lymphotropic virus 1…) ou la souche bactérienne Gram- Helicobacter pylori, et repose sur la protéolyse induite de la protéine p100, l’inhibiteur principal de RelB [
9]. En l’absence d’activation, les dimères RelB/p50 et RelB/p52 sont séquestrés dans le cytoplasme via leur association avec p100. En réponse à l’un des stimuli cités plus haut, la protéine NIK (NF-kB-inducing kinase) associée dans le cytoplasme à la protéine adaptatrice TRAF3 (TNF receptor-associated factor 3) est dirigée vers la membrane plasmique, où TRAF3 est alors dégradée [
10]. NIK ainsi libérée va s’autophosphoryler, former un triple complexe avec IKKα et p100 et, finalement, induire la phosphorylation de p100 alors associée à RelB, aboutissant soit à la dégradation totale de p100 et à la libération des dimères RelB/p50 [
11], soit à la protéolyse partielle de p100, libérant alors des dimères RelB/p52 (Figure 3) [
12]. Il est à noter que la plupart des stimuli qui activent la voie alternative d’activation de NF-κB sont également des inducteurs de la voie canonique d’activation de NF-κB et qu’un mécanisme de contrôle réciproque entre RelA et RelB a été mis en évidence [
13,
14].  | Figure 1.
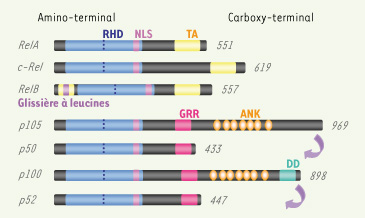
Structure des membres de la famille NF-κB. Les cinq membres de la famille NF-κB chez les mammifères (RelA, c-Rel, RelB, p50 et son précurseur p105, p52 et son précurseur p100) contiennent à leur extrémité amino-terminale un domaine d’homologie à Rel (RHD). La portion amino-terminale du RHD correspond au domaine de liaison à l’ADN et la portion carboxy-terminale est nécessaire à la dimérisation des facteurs NF-κB. La séquence de localisation nucléaire (NLS), quant à elle, permet leur translocation dans le noyau. Seuls RelA, c-Rel et RelB contiennent un domaine de transactivation (TA) à leur extrémité carboxy-terminale. RelB possède, de plus, un domaine TA amino-terminal contenant un motif de type glissière à leucines. Les précurseurs p105 et p100 contiennent à leur extrémité carboxy-terminale un domaine constitué de 7 répétitions ankyrines (ANK) qui joue un rôle crucial dans l’inhibition des protéines NF-κB, ainsi qu’une région charnière riche en glycines (GRR), correspondant à un site de maturation par clivage protéolytique. Alors que la protéolyse de p105 est principalement constitutive, celle de p100 est finement régulée par la présence à son extrémité carboxy-terminale de son domaine de mort (DD). |
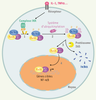 | Figure 2.
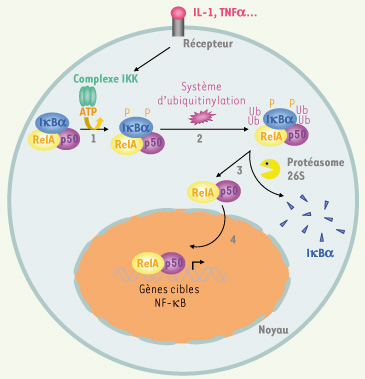
Voie d’activation classique de NF-κB. L’activation d’un certain nombre de récepteurs, comme celui du TNFα et de l’IL-1 (interleukine-1), induit la phosphorylation des protéines inhibitrices IκB par le complexe IKK (1). Les IκB sont ensuite ubiquitinylés (2), puis dégradés par le protéasome 26S (3). Les dimères RelA/p50 ainsi libérés passent dans le noyau et activent la transcription de leurs gènes cibles (4).
|
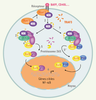 | Figure 3.
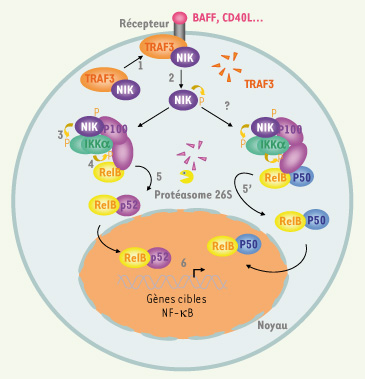
Voie d’activation alternative de NF-κB. L’activation de récepteurs de la famille du TNFR comme BAFFR et CD40 induit le recrutement du complexe TRAF3-NIK à la membrane (1), puis la dégradation de TRAF3 et l’activation de NIK par autophosphorylation (2). La formation du triple complexe NIK-IKKα-p100(3) induit la phosphorylation de p100 (4) ainsi que sa poly-ubiquitinylation. Ce mécanisme aboutit soit à la maturation de p100 en p52, générant ainsi des dimères RelB/p52 (5), soit à la dégradation de p100 libérant alors des dimères RelB/p50(5’). Ces dimères peuvent alors activer la transcription de leurs gènes cibles (6).
|
|
Le rôle essentiel du complexe IKK L’activation de la voie canonique de NF-κB (RelA), mais aussi celle de la voie alternative (RelB), repose sur l’induction de la phosphorylation des protéines inhibitrices IκB (IκBα pour la voie canonique et p100 pour la voie alternative) par IKK. IKK est un complexe multi-protéique composé de deux sous-unités catalytiques, IKKα et IKKβ et d’une sous-unité régulatrice NEMO/IKKγ (NF-kB essential modulator/IKKγ) [8,
15]. Néanmoins, l’analyse des souris déficientes pour chacune de ces sous-unités a montré que les deux voies d’activation de NF-κB ne requièrent pas les mêmes sous-unités : IKKβ et NEMO/IKKγ sont absolument nécessaires à l’activation de la voie canonique de NF-κB alors que IKKα ne l’est pas. À l’inverse, la liaison à l’ADN des dimères RelB/p50 et RelB/p52 nécessite absolument IKKα alors que IKKβ et NEMO/IKKγ ne sont pas nécessaires [11, 12], indiquant que IKKα joue un rôle essentiel dans le contrôle de l’activité de la voie alternative. Bien que la voie alternative d’activation de NF-κB n’ait été que récemment caractérisée, de nombreuses données ont déjà été acquises permettant une meilleure compréhension des mécanismes de régulation et des fonctions biologiques de cette voie. Cet article s’est donné comme objectif de faire l’état des lieux des données actuelles quant à l’implication de la voie alternative et, plus particulièrement, de RelB et de IKKα, dans le développement des cancers hématopoïétiques et solides. |
Voie alternative de NF-κB et développement de cancers Activation de la voie alternative dans les hémopathies malignes Bien qu’aucun cancer ne soit, à ce jour, décrit comme associé à une mutation ou à un réarrangement du gène codant RelB per se, un nombre important de données suggère fortement l’implication d’une dérégulation de l’activité de ce facteur dans le développement de certains cancers hématopoïétiques. Des mutations « gain de fonction » des gènes codant des molécules activatrices de la voie alternative, comme les récepteurs CD40, LTβR (récepteur de la lymphotoxine β) ou la protéine NIK, ainsi que des mutations inactivatrices de régulateurs négatifs tels que TRAF2 ( TNF receptor-associated factor 2) et TRAF3 ont été fréquemment retrouvées dans les myélomes multiples [
16,
17]. Ces mutations aboutissent à une activation constitutive de la voie alternative et par conséquent à celle de RelB. Dans certains types de lymphomes du MALT ( mucosa-associated lymphoid tissue), il a également été décrit que l’activation constitutive des dimères RelB/p50 serait impliquée dans l’inhibition de l’apoptose induite par des dommages à l’ADN [
18,
38]. Dans des leucémies lymphocytaires B chroniques, le niveau d’expression de RelB est très fortement induit en réponse au ligand de CD40, une cytokine essentielle à la survie des lymphocytes B, et le niveau d’expression de RelB joue un rôle essentiel dans le contrôle de la survie cellulaire, en partie via le contrôle de l’expression des gènes anti-apoptotiques MnSOD (manganèse superoxyde dismutase) et survivin [
19,
39]. Une étude très récente du laboratoire de Jacques Ghysdael démontre que RelB est impliqué dans le développement des leucémies aiguës lymphoblastiques T dans un modèle de souris transgéniques pour le gène de fusion TEL-JAK2
1 [
20]. Il est intéressant de noter que le rôle leucémogène de RelB s’exerce dans les cellules stromales radio-résistantes et non dans le compartiment hématopoïétique. Des remaniements du gène codant p100, l’inhibiteur principal de RelB, ont également été associés au développement de nombreuses pathologies hématopoïétiques malignes [ 9]. Ils sont fréquemment observés dans les lymphomes T cutanés, et plus rarement dans les lymphomes B non hodgkiniens, les leucémies lymphocytaires B chroniques et les myélomes multiples. La majorité de ces réarrangements conduit non seulement à la production de formes tronquées de p100 dans sa région carboxy-terminale, mais aussi à la production constitutive de p52 [
21–
23]. Il a été suggéré que cette production constitutive de p52 et ainsi la translocation nucléaire constitutive des dimères RelB/p52 induisent la prolifération incontrôlée et/ou la suppression de l’apoptose des lymphocytes, participant ainsi à la lymphomagenèse [
24]. Par ailleurs, les formes tronquées dans la région carboxy-terminale de p100 ne séquestrent plus RelB dans le cytoplasme et ne sont plus capables de réprimer sa liaison à l’ADN. Enfin, une dérégulation de l’activité de la kinase IKKa semble également participer à l’hématopoïèse maligne. Il a ainsi été montré que les protéines de fusion leucémogènes, TEL-Jak2 et TEL-Abl, stimulent l’activité de IKKα, activent de manière persistante NF-κB et induisent ainsi la production de molécules anti-apoptotiques importantes pour leurs propriétés leucémogènes. Toutefois, il semblerait que ce mécanisme n’induise pas la protéolyse de p100 [
25]. Implication de RelB dans les tumeurs solides L’implication d’une dérégulation de la voie d’activation alternative, et par conséquent de RelB, ne se limite pas aux cancers hématopoïétiques. Demicco et al. ont montré en 2005 une forte accumulation nucléaire des dimères RelB/p52 dans des tumeurs mammaires murines induites après exposition des animaux à des carcinogènes [
26]. Ils ont par ailleurs montré que l’inhibition de l’expression de RelB par ARN interférence dans des cellules issues de carcinome mammaire induit une forte diminution de l’expression de la cycline D1 et de c-myc, une diminution de la prolifération cellulaire ainsi qu’une réduction du phénotype transformé de ces cellules, suggérant que RelB pourrait contribuer au processus de carcinogenèse mammaire [ 26]. Il a aussi été décrit que les tumeurs mammaires développées par les souris transgéniques MMTV ( mouse mammary tumor virus)-c-Rel, qui expriment de manière ectopique la sous-unité NF-κB c-Rel, présentent de forts niveaux nucléaires de RelB, mais également de p52, suggérant que la voie d’activation alternative est active dans ces tumeurs [
27]. En outre, une induction de l’expression de p100/p52 a été détectée au cours du développement tumoral dans des tumeurs mammaires issues de souris exprimant l’oncoprotéine de polyome PyVT [
28]. Plus récemment, une accumulation constitutive anormale de RelB a été décrite dans des cellules humaines issues de cancers du sein invasifs qui n’expriment pas le récepteur des œstrogènes. Dans ces cellules, RelB induit le gène anti-apoptotique Bcl2 aboutissant à un phénotype plus invasif [
29]. Une expression anormalement élevée de RelB a également été observée dans d’autres types de tumeurs solides. Ainsi RelB représente la sous-unité NF-κB la plus fréquemment détectée dans le noyau de tissus dérivés de cancers prostatiques [
30]. De plus, la localisation nucléaire de RelB corrèle directement avec le Score de Gleason, qui est la méthode d’évaluation la plus souvent utilisée pour mesurer le degré d’agressivité des cancers prostatiques, suggérant que le niveau de RelB est associé à la progression de ce cancer [30]. Finalement RelB joue un rôle important dans l’acquisition de la résistance aux traitements radiothérapeutiques dans les cancers prostatiques agressifs, en partie via l’induction de l’expression de l’enzyme MnSOD [
31,
32]. Ainsi l’inhibition de RelB pourrait représenter un nouveau mécanisme de radiosensibilisation dans ce type de cancers. |
IKKα : un role anti-tumoral ? Un certain nombre de données bibliographiques récentes indique que la voie alternative d’activation de NF-κB, ou tout au moins IKKα, pourrait jouer un rôle protecteur dans le développement tumoral et en particulier dans des modèles de cancer de la peau. D’une part, l’analyse des souris déficientes pour IKKα, un des acteurs clés de l’induction de la voie alternative de NF-κB, a permis de montrer que IKKα joue un rôle crucial dans le contrôle de la prolifération et de la différenciation des kératinocytes de l’épiderme [
33]. Par ailleurs, les travaux de l’équipe de Yinling Hu ont permis de mettre en évidence le rôle critique de IKKα dans le développement de carcinomes de peau humains et murins. En effet, des mutations somatiques au niveau de l’exon 15 du gène codant IKKα ont été retrouvées avec une fréquence élevée dans des carcinomes à cellules squameuses humains [
34]. En outre, les travaux de cette équipe suggèrent une corrélation inverse entre les niveaux d’expression de IKKα et l’agressivité de ce type de cancers [34]. Ainsi, dans une souche de souris surexprimant spécifiquement IKKα dans l’épiderme, une expression élevée de IKKα est capable de contrecarrer les activités mitogéniques et angiogéniques de composés chimiques carcinogènes, réprimant ainsi la progression tumorale et les métastases induites par ces drogues [34]. À l’inverse, les souris hétérozygotes pour le gène codant IKKα développent deux fois plus de tumeurs bénignes et onze fois plus de carcinomes malins de la peau que les souris sauvages en réponse à des carcinogènes [34]. De manière remarquable, une étude plus fine de ces souris a permis de montrer que la majorité des carcinomes, ainsi que certains des papillomes issus de ces souris, ont perdu l’allèle sauvage codant IKKα [
35], suggérant que la perte de IKKα favoriserait le développement de cancers humains de la peau. Les kératinocytes IKKα
-/-
présentent effectivement un défaut d’arrêt du cycle en G2/M lié à une hyperméthylation du locus de 14-3-3σ2 et, consécutivement, à un défaut d’induction de l’expression de 14-3-3σ en réponse à des agents génotoxiques. Par ce mécanisme de contrôle, IKKα participerait au maintien de la stabilité génomique des kératinocytes [
36]. Cependant, il reste à déterminer si ces fonctions d’IKKα sont dépendantes ou indépendantes de la voie alternative d’activation de NF-κB. |
De nombreuses données ont été acquises permettant, seulement six années après sa découverte, une meilleure compréhension des mécanismes de régulation et des fonctions biologiques de la voie alternative d’activation de NF-κB. De manière remarquable, l’activation constitutive de cette voie a été observée dans plusieurs formes de cancers, comme les myélomes multiples et les cancers du sein, suggérant que la voie alternative pourrait participer au développement tumoral. Néanmoins, il est également apparu que la sous-unité a du complexe IKK, bien que clairement établie comme étant nécessaire à l’activation de la voie alternative, pouvait exercer au contraire un rôle protecteur contre le développement tumoral dans des modèles animaux de cancer de la peau. Il semble donc aujourd’hui primordial de mieux comprendre les mécanismes moléculaires permettant d’expliquer cette contradiction apparente et d’étendre les études du rôle de la voie alternative et, plus particulièrement, de RelB et d’IKKα, à d’autres modèles tumoraux in vivo. Il est fort à parier que les études à venir explorant la régulation et la spécificité de l’activité de la voie alternative devraient permettre de mieux comprendre les mécanismes moléculaires qui aboutissent à certaines transformations tumorales, de définir des conditions de contrôle de ce processus et de développer de nouvelles approches diagnostiques et thérapeutiques de certains cancers.
|
Footnotes |
1. Baeuerle PA, Henkel T. Function and activation of NF-κB in the immune system. Annu Rev Immunol 1994; 12 : 141–79. 2. Barnes PJ, Karin M. Nuclear factor-κB : a pivotal transcription factor in chronic inflammatory diseases. N Engl J Med 1997; 336 : 1066–71. 3. Karin M, Lin A. NF-κB at the crossroads of life and death. Nat Immunol 2002; 3 : 221–7. 4. Karin M, Cao Y, Greten F, Li ZW. NF-κB in cancer : from innocent bystander to major culprit. Nat Rev Cancer 2002; 2 : 301–10. 5. Rayet B, Gélinas C. Aberrant Rel/NF-kB genes and activity in human cancer. Oncogene 1999; 18 : 6938–47. 6. Wang CY, Cusack JC, Liu R, Baldwin AS. Control of inducible chemoresistance : enhanced anti-tumor therapy through increased apoptosis by inhibition of NF-κB. Nat Med 1999; 5 : 412–17. 7. Gilmore TD. NF-kappa B, KBF1, dorsal, and related matters. Cell 1990; 62 : 841–3. 8. Karin M, Ben-Neriah Y. Phosphorylation meets ubiquitination : the control of NF-κB activity. Annu Rev Immunol 2000; 18 : 621–63. 9. Dejardin E. The alternative NF-kappaB pathway from biochemistry to biology : pitfalls and promises for future drug development. Biochem Pharmacol 2006; 72 : 1161–79. 10. Liao G, Zhang M, Harhaj EW, Sun SC. Regulation of the NF-kappaB-inducing kinase by tumor necrosis factor receptor-associated factor 3-induced degradation. J Biol Chem 2004; 279 : 26243–50. 11. Derudder E, Dejardin E, Pritchard LL, et al. RelB/p50 dimers are differentially regulated by tumor necrosis factor-alpha and lymphotoxin-beta receptor activation : critical roles for p100. J Biol Chem 2003; 278 : 23278–84. 12. Dejardin E, Droin NM, Delhase M, et al. The lymphotoxin-beta receptor induces different patterns of gene expression via two NF-kappaB pathways. Immunity 2002; 17 : 525–35. 13. Jacque E, Tchenio T, Piton G, et al. RelA repression of RelB activity induces selective gene activation downstream of TNF receptors. Proc Natl Acad Sci USA 2005; 102 : 14635–40. 14. Jacque E, Baud V. RelA, un nouvel acteur dans la régulation de l’activité de RelB. Med Sci (Paris) 2006; 22 : 113–4. 15. Gautheron J, Courtois, G. Les nouvelles fonctions de NEMO, la sous-unité régulatrice de la kinase activant NF-κB. Med Sci (Paris) 2008; 24 : 954–60. 16. Annunziata CM, Davis RE, Demchenko Y, et al. Frequent engagement of the classical and alternative NF-kappaB pathways by diverse genetic abnormalities in multiple myeloma. Cancer Cell 2007; 12 : 115–30. 17. Keats JJ, Fonseca R, Chesi M, et al. Promiscuous mutations activate the noncanonical NF-kappaB pathway in multiple myeloma. Cancer Cell 2007; 12 : 131–44. 18. Stoffel A, Chaurushiya M, Singh B, Levine AJ. Activation of NF-kappaB and inhibition of p53-mediated apoptosis by API2/mucosa-associated lymphoid tissue 1 fusions promote oncogenesis. Proc Natl Acad Sci USA 2004; 101 : 9079–84. 19. Mineva RD, Rothstein TL, Meyers JA, et al. CD40 ligand-mediated activation of the de novo RelB NF-kB synthesis pathway in transformed B cells promotes rescue from apoptosis. J Biol Chem 2007; 282 : 17475–85. 20. Dos Santos NR, Williame M, Gachet S, et al. RelB-dependent stromal cells promote T-cell leukemogenesis. PLos One 2008; 3 : e2555. 21. Zhang J, Chang CC, Lombardi L, Dalla-Favera R. Rearranged NFκB2 gene in the HUT78 T-lymphoma cell line codes for a constitutively nuclear factor lacking transcriptional repressor functions. Oncogene 1994; 9 : 1931–7. 22. Neri A, Fracchiolla NS, Migliazza A, et al. The involvement of the candidate proto-oncogene NFKB2/lyt-10 in lymphoid malignancies. Leuk Lymphoma 1996; 23 : 43–8. 23. Derudder E, Laferte A, Ferreira V, et al. Identification and characterization of p100HB, a new mutant form of p100/NF-kappa B2. Biochem Biophys Res Commun 2003; 308 : 744–9. 24. Hacker H, Karin M. Is NF-kappaB2/p100 a direct activator of programmed cell death ? Cancer Cell 2002; 2 : 431–3. 25. Malinge S, Monni R, Bernard O, Penard-Lacronique V. Activation of the NF-kappaB pathway by the leukemogenic TEL-Jak2 and TEL-Abl fusion proteins leads to the accumulation of antiapoptotic IAP proteins and involves IKKalpha. Oncogene 2006; 25 : 3589–97. 26. Demicco EG, Kavanagh KT, Romieu-Mourez R, et al. RelB/p52 NF-kappaB complexes rescue an early delay in mammary gland development in transgenic mice with targeted superrepressor IkappaB-alpha expression and promote carcinogenesis of the mammary gland. Mol Cell Biol 2005; 25 : 10136–47. 27. Romieu-Mourez R, Kim DW, Shin SM, et al. Mouse mammary tumor virus c-rel transgenic mice develop mammary tumors. Mol Cell Biol 2003; 23 : 5738–54. 28. Connelly L, Robinson-Benion C, Chont M, et al. A transgenic model reveals important roles for the NF-kappa B alternative pathway (p100/p52) in mammary development and links to tumorigenesis. J Biol Chem 2007; 282 : 10028–35. 29. Wang X, Belguise K, Kersual N, et al. Estrogen signalling inhibits invasive phenotype by repressing RelB and its target BCL2. Nat Cell Biol 2007; 9 : 470–8. 30. Lessard L, Begin LR, Gleave ME, et al. Nuclear localisation of nuclear factor-kappaB transcription factors in prostate cancer : an immunohistochemical study. Br J Cancer 2005; 93 : 1019–23. 31. Josson S, Xu Y, Fang F, et al. RelB regulates manganese superoxide dismutase gene and resistance to ionizing radiation of prostate cancer cells. Oncogene 2006; 25 : 1554–9. 32. Xu Y, Fang F, St Clair DK, et al. Suppression of RelB-mediated manganese superoxide dismutase expression reveals a primary mechanism for radiosensitization effect of 1alpha,25-dihydroxyvitamin D(3) in prostate cancer cells. Mol Cancer Ther 2007; 6 : 2048–56. 33. Hu Y, Baud V, Delhase M, et al. Abnormal morphogenesis but intact IKK activation in mice lacking the IKKalpha subunit of IkappaB kinase. Science 1999; 284 : 316–20. 34. Liu B, Park E, Zhu F, et al. A critical role for I kappaB kinase alpha in the development of human and mouse squamous cell carcinomas. Proc Natl Acad Sci USA 2006; 103 : 17202–7. 35. Park E, Zhu F, Liu B, et al. Reduction in IkappaB kinase alpha expression promotes the development of skin papillomas and carcinomas. Cancer Res 2007; 67 : 9158–68. 36. Zhu F, Xia X, Liu B, et al. IKKalpha shields 14-3-3sigma, a G(2)/M cell cycle checkpoint gene, from hypermethylation, preventing its silencing. Mol Cell 2007; 27 : 214–27. 37. Lobry C, Weil R. Mécanismes régulateurs de la voie NF-κB dans les lymphocytes T. Med Sci (Paris) 2007; 23 : 857–61. 38. Lobry C, Weil R. Nouveaux mécanismes régulateurs de Bcl10 : Une avancée dans la compréhension de la survenue des lymphomes du MALT ? Med Sci (Paris) 2007; 23 : 353–5. 39. Romagnoli M, Séveno C, Bataille R, Barillé-Nion S. Survivine en cancérologie : aspects moléculaires et applications thérapeutiques. Med Sci (Paris) 2008; 24 : 821–7. |