| |
| Med Sci (Paris). 2008 December; 24(12): 1017–1019. Published online 2008 December 15. doi: 10.1051/medsci/200824121017.La pré-éclampsie Virginie Rigourd, Sonia T. Chelbi, and Daniel Vaiman* Team 21, Genomics and epigenetics of placental diseases, Institut Cochin, U567 Inserm, UMR8104 CNRS, 24, rue du Faubourg Saint-Jacques, 75014 Paris, France MeSH keywords: Animaux, Protéines de transport, Catechol O-methyltransferase, Modèles animaux de maladie humaine, Épigenèse génétique, Femelle, Prédisposition génétique à une maladie, Humains, Protéines et peptides de signalisation intercellulaire, Isoantigènes, Échange foetomaternel, Souris, Souris knockout, Néovascularisation physiologique, Placenta, Prééclampsie, Grossesse, Risque |
Une pathologie fréquente et grave La pré-éclampsie (PE) est une pathologie placentaire très fréquente (environ 5 % des grossesses, soit 40 000 cas par an en France), caractérisée par une hypertension artérielle gravidique (tension artérielle systolique/diastolique > 140/90 mmHg) apparaissant de novo au-delà de la 20e semaine d’aménorrhée et accompagnée d’une protéinurie (> 300 mg/24h), et souvent d’œdèmes. Cette pathologie spécifique de la grossesse est aussi la première cause de mortalité maternelle en occident (15 décès par an en France). Les symptômes de la PE apparaissent tardivement au cours de la grossesse, et nécessitent souvent l’extraction précoce d’un fœtus immature et parfois hypotrophe (1/3 des cas). C’est le seul moyen actuellement à la disposition des équipes obstétrico-pédiatriques pour limiter la morbidité materno-fœtale. Les symptômes disparaissent en effet quelques jours après la délivrance. Durant cette période, le risque de survenue d’une éclampsie persiste néanmoins (1/10 000 accouchements). L’introduction de la détection de la protéinurie (appelée alors albuminurie [
1]) et la mesure de la tension artérielle des patientes, développée au XIXe siècle [
2] puis popularisée par l’utilisation de tensiomètre à brassard [
3], ont permis de définir précisément la notion de PE. L’éclampsie avait, quant à elle, été décrite de façon allusive depuis l’antiquité égyptienne, chinoise ou romaine [
4]. Le mot éclampsie partage l’étymologie du mot éclair, en raison de la soudaineté des crises convulsives qui caractérisent la pathologie et qui rappellent les clonies épileptiques. Les obstétriciens ne disposent que de peu de moyens pour dépister une PE. C’est essentiellement sur les signes cliniques que repose le diagnostic qui est donc souvent tardif. Depuis peu, la progression des techniques d’imagerie médicale et l’apparition de l’échographie doppler permettent de mieux apprécier la vascularisation utéroplacentaire et le bien-être fœtal (retard de croissance in utero, reverse flow
1…). |
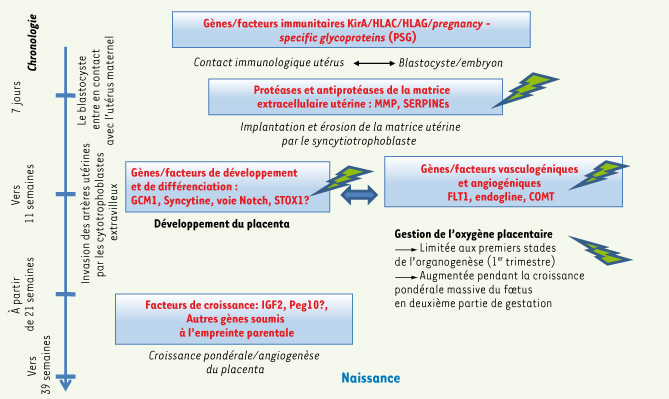
Une pathologie multifactorielle La PE est une pathologie complexe, multifactorielle et encore relativement mal comprise. La meilleure façon d’appréhender sa complexité est probablement de prendre en considération deux voies partiellement indépendantes conduisant aux symptômes : une voie affectant la fonction de gènes modulant le développement placentaire, et une voie hautement dépendante de mécanismes impliquant des anomalies liées à la disponibilité de l’oxygène (hypoxie ou hyperoxie). Ces deux voies présentent bien entendu des interactions ; enfin, elles sont coordonnées de façon précoce par la relation immunologique très particulière qui permet l’implantation d’une hémi-allogreffe (le blastocyste, puis le fœtus) dans l’utérus (Figure 1). Plusieurs travaux ont pu mettre en évidence un dialogue immunologique mère-fœtus au niveau cellulaire, entre les antigènes HLA de classe I C et G, synthétisés par les cytotrophoblastes et d’autre part, les récepteurs KIR-A et KIR-B (killer inhibitory receptors) des cellules utérines natural killer (NK) [
5]. Une question majeure encore mal résolue est celle du passage de défauts confinés au placenta à une pathologie maternelle impliquant des désordres vasculaires disséminés. L’hypothèse la plus vraisemblable [
6] repose sur l’idée d’une libération de débris du syncytiotrophoblaste dans la circulation maternelle, libérant des molécules vasoconstrictrices ou favorisant la lyse cellulaire et l’activation endothéliale (facteurs pro-apoptotiques, endothélines). Une étude récente a montré que ce phénomène s’intensifie au troisième trimestre de grossesse, qu’il est plus important en cas de PE et est à l’origine de l’activation de toute la cascade de l’inflammation qui caractérise la PE [
7]. L’hypertension maternelle serait un mécanisme adaptatif pour maintenir le débit utéro-placentaire [6].  | Figure 1.
Les principales voies connues du développement placentaire (rouge, carrès bleus), avec les étapes clés du développement placentaire. Les flèches vertes marquent les gènes ayant un impact démontré sur le développement de la pathologie (la question reste ouverte pour STOX1). Les altérations se situent dans la première moitié de la gestation, alors que les symptômes de la pathologie n’apparaissent qu’ultérieurement. MMP : matrix metalloproteases ; Kir : killer-cell inhibitory receptor ; GCM1 : glial cells missing homolog 1 ; COMT : catécholamine méthyltransférase ; IGF2 : insulin-like growth factor 2 ; Peg10 : paternally expressed 10.
|
|
Des hypothèses et des gènes candidats Depuis bien peu de temps, des gènes candidats impliqués dans les deux voies physiopathologiques de la PE (développement placentaire et hypoxie) ont été identifiés. Voie associée au développement placentaire Le résultat le plus marquant de ces dernières années a probablement été la découverte du facteur transcriptionnel STOX-1 ( storkhead box 1) en 2005 [
8]. Ce gène interviendrait dans la fusion des cytotrophoblastes en syncytiotrophoblastes, étape cruciale du développement placentaire. L’identification du gène a été facilitée par l’exploitation de la notion de la transmission strictement maternelle de la pathologie dans les familles étudiées, ce qui suggérait l’implication d’un facteur soumis à l’empreinte parentale. Le rôle de STOX1 est maintenant controversé ; en particulier, la « mutation » découverte par les auteurs, Y153H, est en réalité très bien représentée dans de nombreuses populations humaines indemnes ; de plus, l’analyse transcriptionnelle du gène dans les placentas à terme ou proches du terme, montre que le niveau d’expression de STOX1 ne varie pas avec la pathologie placentaire. Finalement, même son statut de gène soumis à empreinte est maintenant remis en cause [
9–
11]. Des résultats récents de notre équipe semblent néanmoins suggérer que STOX1 pourrait quand même avoir un rôle clé dans les événements précoces du développement placentaire. En effet, nous avons montré que sa surexpression dans un modèle cellulaire est associée à la modulation de nombreux gènes cibles impliqués dans la fusion des cytotrophoblastes en syncytiotrophoblastes et aux propriétés invasives de ces cellules (Rigourd et al., en préparation). Voie angiogénique Des défauts de développement et de différenciation vasculaires placentaires pourraient conduire à une hypoxie locale et à la survenue d’une PE. Dans ce cadre, un résultat majeur a été la découverte du rôle de l’endogline, une composante régulatrice du complexe récepteur-ligand de plusieurs facteurs de la famille du TGF-β ( transforming growth-factor β), et la mise en évidence de son utilité potentielle comme marqueur précoce, détectable dans le sérum dès la 20 e semaine de gestation dans les grossesses pré-éclamptiques [
12,
13]. Une forte concentration d’endogline circulante aboutit à la captation (et donc à la neutralisation) d’un ligand pro-angiogénique de la famille du TGF-β. Le mécanisme est similaire à celui décrit pour le récepteur soluble sFLT1, spécifique d’un autre membre de la famille du TGF-β, le VEGF ( vascular endothelial growth factor). La concentration sérique de sFLT1 est en effet accrue dans la pathologie pré-éclamptique. Une des limitations majeures dans la compréhension de la pathologie pré-éclamptique est une carence certaine en modèles animaux, en particulier murins, mimant la PE naturelle. Néanmoins, deux cas d’invalidation de gènes reproduisent au moins partiellement le syndrome chez la souris : l’invalidation du gène soumis à empreinte p57Kip2 [
14], et, plus récemment, l’étude remarquable du gène de la catécholamine méthyl transférase (Comt) [
15]. Dans cette étude récente, portant avant tout sur la souris, le phénotype complet de la PE (protéinurie et hypertension gestationnelle) est reproduit. Les souris Comt−/−
sont caractérisées par une absence du métabolite du gène, 2-méthoxyœstradiol (2-ME), un métabolite naturel de l’œstradiol dont le taux est élevé pendant le premier trimestre des grossesses normales. Les auteurs montrent de façon spectaculaire que l’administration de 2-ME aux souris compense les effets de l’invalidation. L’action du métabolite passe par une suppression de l’hypoxie placentaire et des effets induits par le senseur primaire de l’hypoxie tissulaire chez les eucaryotes, la protéine HIF1a, responsable par exemple de l’induction du gène codant sFLT1. Les résultats obtenus chez la souris dans cette étude semblent transposables à l’humain, quoique l’effectif testé soit encore très réduit. Modifications épigénétiques Elles participent aussi à la cascade physiopathologique de la PE. Le placenta subit, en cas de PE, et ceci même avant l’apparition des symptômes, une agression liée au défaut précoce d’apport en oxygène (soit par hypoxie, soit par hyperoxie), au moment où les cellules se divisent activement. Les conditions environnementales peuvent alors aboutir à des anomalies de la régulation de l’expression des gènes, qui se transmettent de générations cellulaires en générations cellulaires par des voies épigénétiques, faisant par exemple intervenir des défauts de la méthylation de l’ADN à des positions stratégiques. Nous avons pu mettre en évidence certains de ces défauts, en particulier au niveau du promoteur de la SERPINA3 ( Serpin peptidase inhibitor, clade A [α-1 antiproteinase, antitrypsin], member 3) [
16]. Ces défauts corrèlent avec des niveaux anormaux de transcrits SERPINA3 au niveau du placenta pré-éclamptique. La protéine est impliquée dans la protection de la matrice extracellulaire contre la dégradation, étape cependant nécessaire à l’implantation dès le stade blastocyste. La surexpression du gène, et la localisation de la protéine au niveau de la membrane du syncytiotrophoblaste, pourraient être très défavorables à une implantation correcte et augmenter ainsi les risques de pathologies placentaires, dont la PE. Nous avons également identifié d’autres altérations épigénétiques (Chelbi et al., en préparation) et nous soulignons l’intérêt d’une exploration pan-génomique de cette question. |
La PE constitue donc une pathologie particulièrement intéressante d’un point de vue scientifique, puisqu’elle représente le résultat d’une « négociation » à l’interface fœto-maternelle, aboutissant à un statu quo insatisfaisant entre le fœtus et la mère. Plusieurs mise en scènes peuvent être imaginées avec deux extrêmes : une implantation défectueuse qui aboutit à une fausse couche, situation considérée comme très fréquente dans l’espèce humaine (50 %-75 % des fécondations) et à l’autre extrémité du spectre, l’obtention d’une grossesse harmonieuse pour le couple mère-enfant, parvenant au terme dans les délais prévus. Entre ces deux situations, la PE et certains retards de croissance intra-utérin pourraient représenter un scénario intermédiaire. La complexité de la physiopathologie de la PE est illustrée par nos incertitudes sur son mécanisme, mais les dix dernières années ont enfin vu la découverte d’acteurs crédibles permettant de mieux décrypter les deux cascades complémentaires impliquées dans l’établissement d’un placenta fonctionnel. On pourrait parier qu’à la fin des dix années à venir, nous aurons acquis une vision très intégrée de la PE, ce qui ouvrira des voies nouvelles en matière de diagnostic précoce et permettra une meilleure prise en charge de ces couples mère-enfant.

|
Footnotes |
1. Simpson JY. Contributions to the pathology and treatment of diseases of the uterus. London and Edinburgh Monthly Journal of Medical Science 1843; 3 : 1008–11. 2. Poiseuille J. Recherches sur la force du coeur aortique. Archives Générales de Médecine 1828; 8 : 550–4. 3. Korotkov N. On methods of studying blood pressure Izvest. Imp. Voyenno-Med. Akad St Petersburgh 1905; 11 : 365. 4. Purkerson ML, Vekerdy L. A history of eclampsia, toxemia and the kidney in pregnancy. Am J Nephrol 1999; 19 : 313–9. 5. Hiby, SE, Walker JJ, O’shaughnessy KM, et al. Combinations of maternal KIR and fetal HLA-C genes influence the risk of preeclampsia and reproductive success. J Exp Med 2004; 200 : 957–65. 6. Redman, CW, Sargent IL. Latest advances in understanding preeclampsia. Science 2005; 308 : 1592–4. 7. Germain SJ, Sacks GP, Sooranna SR, et al. Systemic inflammatory priming in normal pregnancy and preeclampsia: the role of circulating syncytiotrophoblast microparticles. J Immunol 2007; 178 : 5949–56. 8. Van Dijk M, Poutsma A, Könst AA, et al. Maternal segregation of the Dutch preeclampsia locus at 10q22 with a new member of the winged helix gene family. Nat Genet 2005; 37 : 514–9. 9. Kivinen K, Peterson H, Hiltunen L, et al. Evaluation of STOX1 as a preeclampsia candidate gene in a population-wide sample. Eur J Hum Genet 2007; 15 : 494–7. 10. Berends AL, Bertoli-Avella AM, de Groot CJ, et al. STOX1 gene in pre-eclampsia and intrauterine growth restriction. Br J Obst Gynecol 2007; 114 : 1163–7. 11. Iglesias-Platas I, Monk D, Jebbink J, et al. STOX1 is not imprinted and is not likely to be involved in preeclampsia. Nat Genet 2007; 39 : 279–80. 12. Venkatesha S, Toporsian M, Lam C, et al. Soluble endoglin contributes to the pathogenesis of preeclampsia. Nat Med 2006; 12 : 642–9. 13. Levine RJ, Lam C, Qian C, et al. Soluble endoglin and other circulating antiangiogenic factors in preeclampsia. N Engl J Med 2006; 355 : 992–1005. 14. Kanayama N, Takahashi K, Matsuura T, et al. Deficiency in p57Kip2 expression induces preeclampsia-like symptoms in mice. Mol Hum Reprod 2002; 8 : 1129–35. 15. Kanasaki K, Palmsten K, Sugimoto H, et al. Deficiency in catechol-O-methyltransferase and 2-methoxyoestradiol is associated with pre-eclampsia. Nature 2008; 453 : 1117–21. 16. Chelbi ST, Mondon F, Jammes H, et al. Expressional and epigenetic alterations of placental serine protease inhibitors: SERPINA3 is a potential marker of preeclampsia. Hypertension 2007; 49 : 76–83. 17. Zhou CC, Zhang Y, Irani RA, et al. Angiotensin receptor agonistic autoantibodies induce pre-eclampsia in pregnant mice. Nat Med 2008; 14 : 855–62. |