| |
| Med Sci (Paris). 2008 November; 24(11): 954–960. Published online 2008 November 15. doi: 10.1051/medsci/20082411954.Les nouvelles fonctions de NEMO, la sous-unité régulatrice de la kinase activant NF-κB
Jérémie Gautheron and Gilles Courtois* |
NF-κB (Nuclear factor-κB) est un facteur de transcription dimérique formé à partir de l’association de cinq sous-unités : RelA, RelB, c-Rel, p50 et p52, ces deux dernières étant dérivées des précurseurs p105 et p100, respectivement. Dans la cellule au repos, NF-κB est associé dans le cytoplasme à l’inhibiteur IκB, qui regroupe un ensemble de trois protéines (IκBα, IκBβ, IκBε) possédant des répétitions du domaine ankyrine capables d’interagir avec NF-κB et de masquer son site de localisation nucléaire. En réponse à des stimulus variés comme des cytokines pro-inflammatoires [l’IL-(Interleukine)-1β, le TNF-α (tumor necrosis factor-α)], des produits bactériens [LPS (Lipopolysaccharide)], des protéines virales [Tax, LMP-1 (EBV-encoded latent membrane protein 1)] ou diverses formes de stress (UV, régénération hépatique), l’inhibiteur IkB est phosphorylé sur deux résidus sérine par la kinase IKK (IκB kinase). Cette modification induit sa polyubiquitinylation puis sa dégradation par le protéasome. NF-κB libre peut alors entrer dans le noyau et activer la transcription de gènes impliqués dans l’immunité, l’inflammation, l’adhésion cellulaire ou la protection contre l’apoptose [
1,
31]. |
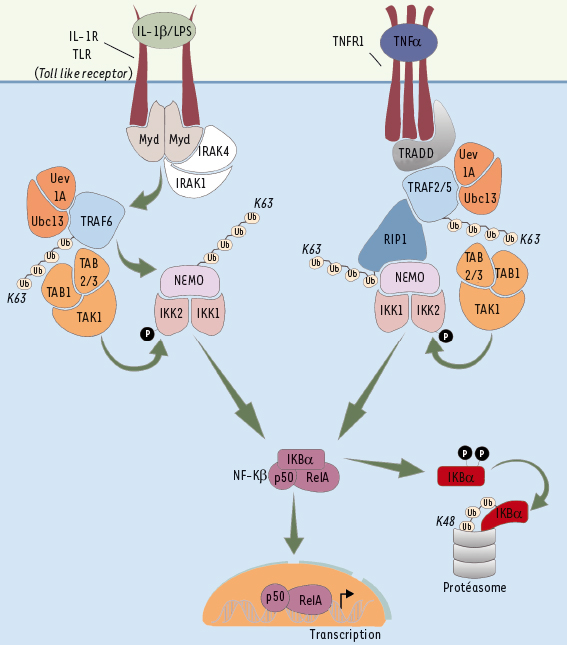
NEMO : un composant essentiel des voies classiques d’activation de NF-κB La kinase IKK est un complexe protéique comprenant deux sous unités catalytiques, IKK1/IKKα et IKK2/IKKβ, et une sous unité régulatrice appelée NEMO (NF-κB essential modulator)/IKKγ [
2]. La plupart des voies de signalisation activant NF-κB nécessitent NEMO et IKK2 (voie classique d’activation de NF-κB) alors que la lymphotoxine β, BAFF (B cell activating factor) et le ligand de CD40 nécessitent IKK-1 mais pas NEMO (voie alternative). Dans les voies d’activation classiques, utilisées par l’IL-1β, le LPS ou le TNF-α, la fixation du ligand sur la région extracellulaire de récepteurs spécifiques induit le recrutement et l’activation de molécules adaptatrices et de kinases spécifiques ainsi que d’éléments communs (Figure 1) [
3]. En réponse à l’IL-1β et au LPS, c’est l’adaptateur Myd88 (Myeloid differentiation primary response gene 88), entrant en relation avec des kinases de la famille IRAK (IL-1β receptor-associated kinase), qui conduit au recrutement du reste du module de signalisation. Dans la voie du TNF-α, c’est l’adaptateur TRADD (TNF receptor-associated death domain) et la kinase RIP (Receptor interacting protein) qui assurent cette fonction. Des molécules identiques sont ensuite utilisées. D’une part, la kinase TAK1 (TGF-β associated kinase 1), qui, régulée par les sous-unités TAB (TAK1-binding proteins), est responsable de la phosphorylation activatrice de IKK. D’autre part, des ubiquitine ligases de la famille des TRAF (TNF receptor-associated factors) qui, en association avec une enzyme de conjugaison de l’ubiquitine, Ubc13 (Ubiquitin conjugating enzyme 13)/Uev1A (Ubiquitin E2 variant), participent à des processus de poly-ubiquitinylation1 de type « K63 » qui modifieraient les TRAF elles-mêmes, RIP ou NEMO. Contrairement aux chaînes de type « K48 », qui fournissent une étiquette reconnue par la sous-unité 28S du protéasome, les chaînes « K63 » régulent l’activité et non la demi-vie des substrats modifiés [
4]. Dans la voie NF-κB, elles favoriseraient les interactions protéine/protéine en étant reconnues par les domaines reconnaissant les chaînes de poly-ubiquitine présents dans TAB2 ou NEMO, par exemple.
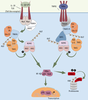 | Figure 1.
Les voies d’activation classiques de NF-κB. Les principales molécules participant aux voies de l’IL-1R/TLR et du TNF-R1 sont indiquées. Ub : ubiquitine ; P : phosphate. |
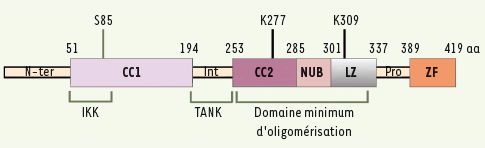
La sous-unité régulatrice NEMO constitue une interface essentielle entre les modules de signalisation décrits ci-dessus et la kinase IKK. Elle se compose de deux domaines Coiled Coil (CC1 et CC2), d’un domaine intermédiaire, d’un domaine reconnaissant les chaînes de poly-ubiquitine (NUB, NEMO ubiquitin binding domain), d’un Leucine Zipper (LZ) et d’un Zinc Finger (ZF) (Figure 2). Le site d’interaction avec les kinases IKK1 et IKK2 se situe dans la partie amino-terminale du CC1, alors que le CC2 et le LZ de NEMO représentent le domaine minimal d’oligomérisation de la molécule. De son côté, le domaine NUB participe au recrutement de IKK et à son activation, en interagissant avec des partenaires ubiquitinylés, tel que RIP dans la voie du TNF-R1 (Figure 1).
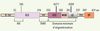 | Figure 2.
La protéine NEMO. Les différents domaines structuraux de NEMO, ainsi que la région participant à son oligomérisation, sont présentés. Les sites de phosphorylation, de sumoylation et d’ubiquitinylation qui participent à la réponse au stress génotoxique et le site d’interaction avec TANK, sont également indiqués. N-ter : domaine amino-terminal ; CC : Coiled Coil ; Int : domaine intermédiaire ; NUB : domaine reconnaissant les chaînes de poly-ubiquitine ; LZ : leucine zipper ; Pro : domaine riche en proline, ZF : zinc finger. |
Le rôle exact de l’ubiquitinylation de type K63 modifiant NEMO durant le processus d’activation de IKK n’est pas encore totalement élucidé. Plusieurs sites d’ubiquitinylation ont été identifiés et participeraient de façon différentielle aux différentes voies d’activation de NF-κB. Ce processus d’ubiquitinylation favoriserait le recrutement de la kinase TAK1 par le biais de ses sous-unités TAB qui ont une affinité pour les chaînes K63. Alternativement, l’état d’oligomérisation de NEMO pourrait être régulé par ce type de modification [
5]. |
Nouvelles fonctions de NEMO NEMO est un senseur des dommages causés à l’ADN Sumoylation de NEMO et translocation nucléaire La cellule eucaryote dispose d’une machinerie sophistiquée pour détecter et corriger les dommages qui affectent l’ADN et déclencher, quand des dégâts irréversibles sont détectés, la mort cellulaire par apoptose [
6]. Ce processus de surveillance est crucial car il permet d’éviter une accumulation de défauts génomiques qui pourrait aboutir à la transformation cellulaire. Il nécessite d’être finement régulé et NF-κB participe au contrôle du processus apoptotique en contrebalançant l’action pro-apoptotique de p53 [
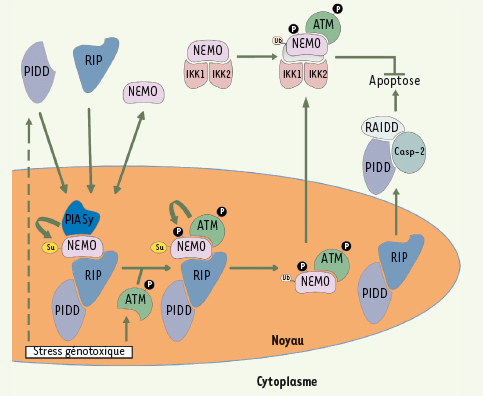
7]. Le groupe de Miyamoto et al. a été le premier à détecter une modification post-transcriptionnelle, de type sumoylation, affectant NEMO après le traitement de cellules par des agents induisant des dommages génomiques, comme l’étoposide/VP16, la camptothécine et la doxorubicine [
8]. Cette modification, qui n’est pas observée après traitement par le TNF-α ou l’IL-1β, implique deux résidus lysine (K277 et K309) (Figure 2) et nécessite la ligase PIASy (Protein inhibitor of activated STAT y) [
9]. De façon remarquable, la sumoylation de NEMO semble induire l’accumulation, dans le noyau, d’un pool de molécules NEMO libres, c’est-à-dire non associées à IKK1 et/ou IKK2. À ce niveau, NEMO interagirait avec PIDD (p53-induced protein with a death domain) et RIP, qui ont également rejoint le compartiment nucléaire, pour former un complexe ternaire [
10]. PIDD est une protéine contenant des répétitions riches en Leucine qui pourrait détecter des composants engendrés par le stress génotoxique. RIP est une protéine adaptatrice originellement identifiée comme participant à la voie du TNF-R1 et c’est un partenaire connu de NEMO (voir ci-dessus). La protéine NEMO sumoylée nucléaire est ensuite phosphorylée par ATM (Ataxia telangiectasia mutated), la kinase qui est spécifiquement activée par les cassures de l’ADN [
11]. Cette phosphorylation de NEMO sur le résidu Ser85 induit la mono-ubiquitinylation des lysines 277 et 309 de la protéine qui retourne alors dans le cytoplasme, associée à ATM, où elle active IKK selon un mécanisme incomplètement défini (Figure 3). L’activation de NF-κB peut alors induire l’expression de protéines anti-apoptotiques telles que c-FLIP (cellular-FLICE-inhibitory protein), Bcl-2 (B cell lymphoma-2) ou cIAP1/2 (cellular inhibitory of apoptosis 1/2). Si cette série complexe d’événements est inhibée, par exemple en mutant les sites de sumoylation de NEMO ou en invalidant le gène codant pour RIP, une mortalité cellulaire par apoptose est observée [11,
12].
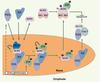 | Figure 3.
Participation de NEMO à la voie du stress génotoxique. Les modifications de NEMO induites par des dommages causés à l’ADN sont présentées. Elles participent au processus d’activation de IKK qui est anti-apoptotique. Parallèlement à l’activation de IKK, un complexe multiprotéique appelé PIDDosome régule l’activation de la caspase 2, un événement pro-apoptotique. Su : SUMO ; Ub : ubiquitine ; P : phosphate. |
Relations entre le complexe PIDDosome et la voie NF-κB Il a été montré que ce processus apoptotique est causé par la formation d’un complexe multiprotéique, appelé PIDDosome, contenant non seulement PIDD, le partenaire de NEMO dans le noyau, mais également RAIDD ( receptor-interacting protein associated ICH1/CED-3 homologous protein with a death domain) et la pro-Caspase 2 [
13]. C’est la formation du PIDDosome dans le cytoplasme qui induit l’activation de la Caspase 2 et le processus apoptotique (Figure 3). De manière intéressante, la formation du PIDDosome actif est retardée par rapport au processus d’activation de IKK/NF-κB, suggérant que l’activation de NF-κB représente un point de contrôle préservant l’intégrité de la cellule en réponse à un choc génotoxique. Si ce point de contrôle est défectif, la voie pro-apoptotique dépendante de p53 prévaut et l’apoptose a lieu. Ce type de mécanisme de contrôle d’une voie proapoptotique par NF-κB n’est pas sans rappeler celui qui opère dans la voie du TNF-R1 et implique la caspase 8, présente dans un complexe pro-apoptotique latent après stimulation par le TNF-α [
14]. La caractérisation moléculaire de la réponse aux agents endommageant l’ADN, plus particulièrement concernant le mécanisme spécifique d’activation de NF-κB via la sumoylation de NEMO, permet d’entrevoir le développement de nouveaux traitements anti-cancéreux. En effet, la plupart des traitements utilisant une chimiothérapie affectent l’ADN et il a été montré de façon convaincante que leur efficacité est contrecarrée par l’activation de NF-κ qu’ils induisent [
15]. L’utilisation d’inhibiteurs de NF-κB en combinaison avec un agent chimiothérapeutique a donc été proposée. Malheureusement, ces inhibiteurs agissent sur de multiples voies activant NF-κB, dont celles qui participent à la réponse immunitaire, et pourraient entraîner une immunodéficience. La découverte d’une voie d’activation de NF-κB spécifiquement induite par les dommages causés à l’ADN, mais pas par les stimulus classiques, laisse augurer du développement possible d’une nouvelle classe d’inhibiteurs, affectant le processus de sumoylation de NEMO par exemple. |
NEMO coordonne l’activation des kinases IKK et TBK1/IKKε durant l’infection virale Les différentes classes de senseurs La réponse immunitaire innée constitue la première ligne de défense lors d’infections bactériennes ou virales. Elle implique la reconnaissance de composants arborant la signature spécifique de ces micro-organismes, tels que le lipopolysaccharide des bactéries Gram -, le peptidoglycane des bactéries Gram+, l’ADN ou l’ARN double brin synthétisé lors de la réplication virale ou la flagelline, un composant du flagelle bactérien [
16]. Ces composants sont détectés par différentes classes de senseurs, localisés à la surface ou à l’intérieur de la cellule. La classe la mieux caractérisée, celle des « Toll-like receptors » (TLR), regroupe une famille de 10 membres qui présentent une analogie avec des membres de la superfamille du récepteur d’IL-1β, notamment au niveau du domaine TIR ( Toll/IL-1 receptor) intra-cytoplasmique ( voir ci-dessus) [
17]. Les TLR sont présents au niveau de la membrane plasmique, comme TLR4 ou TLR2, qui reconnaissent des composants de l’enveloppe bactérienne, ou au niveau de la membrane de l’endosome et du phagosome, comme TLR3, TLR7 ou TLR9, qui détectent respectivement l’ARN double brin viral, l’ARN simple brin viral et l’ADN bactérien et viral. Une autre classe de senseurs plus récemment décrite regroupe des membres de la famille des hélicases pour ARN, tels que RIG-I ( Retinoic acid-inducible gene I) ou MDA5 ( Melanoma differentiation-associated gene 5), qui sont localisés au niveau du cytoplasme et détectent l’ARN double brin cytoplasmique produit durant la phase réplicative virale [
32]. Ils agissent par l’intermédiaire de MAVS ( Mitochondrial antiviral signaling), une protéine transmembranaire mitochondriale [
18]. Finalement, DAI ( DNA-dependent activator of IFN-regulatory factors), qui reste incomplètement caractérisé, représente le senseur de l’ADN viral double brin [
19]. La voie d’activation des IRF Après reconnaissance des produits bactériens et viraux par les senseurs décrits ci-dessus, plusieurs voies de signalisation sont spécifiquement activées, permettant la synthèse de protéines inflammatoires et de cytokines de la famille de l’interféron (IFN) qui coopèrent pour lutter contre l’infection. Parmi ces voies figure la voie NF-κB, qui régule plus particulièrement des gènes pro-inflammatoires, et celle des IRF, qui contrôle la synthèse des IFN de classe 1. L’activation de NF-κB par les TLR ou les protéines de la famille des hélicases fait intervenir des molécules adaptatrices et des kinases déjà décrites ci-dessus dans le cas de la voie de l’IL-1β et implique NEMO (Figure 1). La voie d’activation des IRF, qui est plus spécifiquement activée par les virus, est restée, en revanche, mal définie jusqu’à une date récente. Les IRF sont des facteurs de transcription cytoplasmiques qui sont activés par phosphorylation, ils dimérisent et rejoignent le compartiment nucléaire pour réguler, avec les co-activateurs CBP et p300, leurs gènes cibles [
20]. L’énigme concernant l’identité de la (des) kinase(s) phosphorylant les IRF après infection virale n’a été levée qu’en 2003 lorsque les groupes de T. Maniatis [
21] et de J. Hiscott [
22] ont montré qu’il s’agissait des kinases « IKK-like » TBK1 (TANK-binding kinase 1) et IKKε. Ces deux kinases, bien que présentant une forte homologie de séquence avec IKK1 et IKK2, particulièrement au niveau du domaine catalytique, ne semblent pas se comporter comme des kinases ciblant les sérines des IκB, comme supposé initialement. Elles sont, par contre, capables de phosphoryler des résidus sérine de IRF3 et IRF7 qui sont essentiels à l’activation de ces facteurs de transcription. De manière intéressante, TANK (TRAF family member-associated NF-κB activator), une protéine adaptatrice dont la fonction est restée obscure jusqu’à récemment, mais qui avait permis initialement de cloner TBK1, s’est également révélé être un intermédiaire essentiel dans l’activation des IRF en réponse à l’infection virale [
23]. Une autre pièce de ce puzzle moléculaire a été identifiée encore plus récemment quand il a été démontré que TRAF3 était le TRAF spécifiquement utilisé par TLR3, le senseur d’ARN double brin, pour activer la synthèse d’IFN [
24,
25]. Sachant que TRAF3 est une molécule capable d’interagir avec TANK, une nouvelle voie de signalisation cohérente, aboutissant à l’activation des IRF, a donc pu être proposée (Figure 4). Néanmoins, une question majeure subsiste. L’activation de NF-κB par IKK et celle des IRF par TBK1/IKKε, en réponse à une exposition virale, a-t-elle lieu de manière indépendante ? Il est probable que non. En effet, plusieurs gènes cibles induits par les virus, comme ceux de l’Interféron β ou de ISG20 (Interferon-stimulated gene 20), sont régulés par ces deux types de facteurs de transcription, qui, dans le cas de l’IFN β, par exemple, coopèrent au niveau d’un élément de régulation génique appelé « enhanceosome » [
26]. De plus, la transcription des gènes spécifiquement induits par NF-κB, d’un côté, et par IRF, de l’autre, nécessite d’être finement coordonnée.
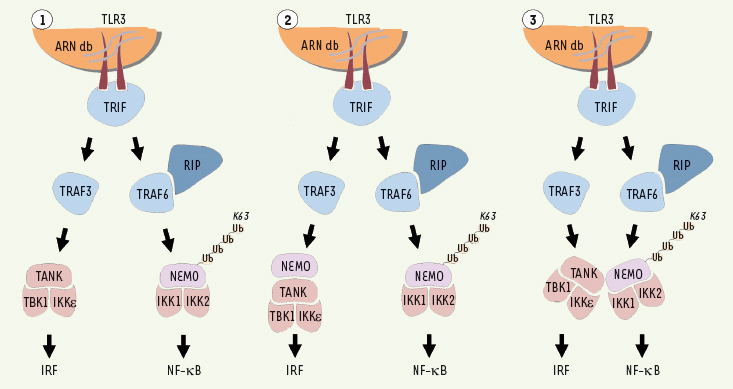
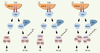 | Figure 4.
Participation de NEMO dans la voie des IRF. Jusqu’à une date récente, les voies d’activation de IRF et de IKK, en réponse à l’ARN double brin viral, étaient supposé fonctionner indépendamment l’une de l’autre et impliquer deux molécules adaptatrices/régulatrices distinctes, TANK et NEMO (1). La découverte d’une interaction entre TANK et NEMO, ainsi que la participation de NEMO au processus d’activation de IRF, laisse supposer que NEMO pourrait être un nouveau composant du complexe TANK/TBK1/IKKε, (2) ou qu’une interaction entre TBK1/IKKε et IKK1/IKK2 pourrait exister et coordonner l’activation de ces deux kinases (3). Quel que soit le mécanisme moléculaire exact, l’activation de TBK1/IKKe pourrait nécessiter une étape de polyubiquitinylation comme déjà démontré pour IKK avec la polyubiquitinylation de NEMO par TRAF6. |
Un rôle pour NEMO dans l’activation de la voie IRF ? Un facteur permettant de co-réguler l’activation de NF-κB et de IRF pourrait être NEMO. Tout d’abord, il a été montré, lors d’un crible par double-hybride dans la levure, que TANK interagissait avec NEMO et que la séquence de NEMO nécessaire à cette interaction était localisée entre les acides aminés 200 et 250 [
27]. Une interaction tri-moléculaire NEMO/TANK/TBK1 a également été observée, après co-transfection, suggérant que TANK pourrait fournir un lien physique entre NEMO et TBK1. Plus récemment, une étude de Zhao et al. [
28] a démontré que l’invalidation de nemo dans des fibroblastes murins abolissait l’activation de IRF7 et la synthèse de gènes régulés par ce facteur de transcription. De manière notable, l’invalidation de IKK2 n’abolit pas cette activation, indiquant que le rôle de NEMO dans l’activation de IRF est indépendant de IKK. Finalement, l’analyse fonctionnelle de plusieurs mutations de NEMO causant la maladie génétique EDA-ID (Dysplasie ectodermique anhidrotique avec immunodéficience), par complémentation de fibroblastes nemo, a montré un défaut d’activation de la voie IRF après infection virale, ce qui pourrait expliquer une partie du phénotype immunitaire des patients EDA-ID. Comment NEMO participe à l’activation de TBK1/IKKε/IRF reste mal compris (Figure 4). De manière intéressante, il a été démontré qu’un processus d’ubiquitinylation de type K63 pourrait jouer un rôle dans l’activation de la voie IRF. En effet, TRAF3 apparaît capable de s’auto-ubiquitinyler en synthétisant des chaînes d’ubiquitine K63 et une nouvelle déubiquitinase, DUBA (Deubiquitinating enzyme A), interagissant avec TRAF3 a été récemment identifiée [
29]. Cette déubiquitinase jouant un rôle négatif dans la réponse à l’infection virale, sa cible pourrait être TRAF3 elle-même. Néanmoins, une autre hypothèse est envisageable. Sachant que l’ubiquitinylation de NEMO par TRAF6 est nécessaire au processus d’activation d’IKK (voir ci-dessus), il est possible d’imaginer un processus similaire, via TRAF3, lors de l’activation de TBK1/IKKε. |
Dix années après sa découverte, la protéine NEMO continue de révéler de nouveaux aspects de sa « personnalité » moléculaire. Si sa participation cruciale au processus d’activation de IKK par la voie classique commence à être mieux définie mécanistiquement, à travers l’identification de modifications post-traductionnelles impliquant un processus de polyubiquitinylation de type K63 et la découverte de sa propre affinité pour ce type de chaînes, il apparaît qu’elle pourrait également agir en dehors du complexe IKK, en interagissant avec d’autres partenaires tels que PIDD/RIP (voie du stress génotoxique) ou TANK (voie des IRF). Il reste maintenant à définir plus finement la nature de chacune de ces fonctions (domaines de la protéine impliqués, types de modification l’affectant, molécules partenaires, etc.) pour peut-être agir spécifiquement sur l’une d’entre elles sans affecter les autres, à des fins thérapeutiques. |
Footnotes |
1. Karin M, Ben-Neriah Y. Phosphorylation meets ubiquitination : the control of NF-κB activity. Annu Rev Immunol 2000; 18 : 621–63. 2. Israël A. The IKK complex : an integrator of all signals that activate NF-κB ? Trends Cell Biol 2000; 10 : 129–33. 3. Hayden MS, Ghosh S. Signaling to NF-κB. Genes Dev 2004; 18 : 2195–224. 4. Deng L, Wang C, Spencer E, et al. Activation of the IκB kinase complex by TRAF6 requires a dimeric ubiquitin-conjugating enzyme complex and a unique polyubiquitin chain. Cell 2000; 103 : 351–61. 5. Sebban H, Yamaoka S, Courtois G. Posttranslational modifications of NEMO and its partners in NF-κB signaling. Trends Cell Biol 2006; 16 : 569–77. 6. Sancar A, Lindsey-Boltz LA, Unsal-Kaçmaz K, et al. Molecular mechanisms of mammalian DNA repair and the DNA damage checkpoints. Annu Rev Biochem 2004; 78 : 39–85. 7. Perkins ND. Integrating cell-signalling pathways with NF-κB and IKK function. Nat Rev Mol Cell Biol 2007; 8 : 49–62. 8. Huang TT, Wuerzberger-Davis SM, Wu ZH, et al. Sequential modification of NEMO/IKKγ by SUMO-1 and ubiquitin mediates NF-κB activation by genotoxic stress. Cell 2003; 115 : 565–76. 9. Mabb AM, Wuerzberger-Davis SM, Miyamoto S. PIASy mediates NEMO sumoylation and NF-κB activation in response to genotoxic stress. Nat Cell Biol 2006; 8 : 986–93. 10. Janssens S, Tinel A, Lippens S, et al. PIDD mediates NF-κB activation in response to DNA damage. Cell 2005; 123 : 1079–92. 11. Wu ZH, Shi Y, Tibbetts RS, et al. Molecular linkage between the kinase ATM and NF-κB signaling in response to genotoxic stimuli. Science 2006; 311 : 1141–6. 12. Hur GM, Lewis J, Yang Q, et al. The death domain kinase RIP has an essential role in DNA damage-induced NF-κB activation. Genes Dev 2003; 17 : 873–82. 13. Tinel A, Tschopp J. The PIDDosome, a protein complex implicated in activation of caspase-2 in response to genotoxic stress. Science 2004; 304 : 843–6. 14. Micheau O, Tschopp J. Induction of TNF receptor I-mediated apoptosis via two sequential signaling complexes. Cell 2003; 114 : 181–90. 15. Wang CY, Cusack JC Jr, Liu R, et al. Control of inducible chemoresistance : enhanced anti-tumor therapy through increased apoptosis by inhibition of NF-κB. Nat Med 1999; 5 : 412–7. 16. Takeuchi O, Akira S. Signaling pathways activated by microorganisms. Curr Opin Cell Biol 2007; 19 : 185–91. 17. Kawai T, Akira S. TLR signaling. Cell Death Differ 2006; 13 : 816–25. 18. Onomoto K, Yoneyama M, Fujita T. Regulation of antiviral innate immune responses by RIG-I family of RNA helicases. Curr Top Microbiol Immunol 2007; 316 : 193–205. 19. Takaoka A, Wang Z, Choi MK, et al. DAI (DLM-1/ZBP1) is a cytosolic DNA sensor and an activator of innate immune response. Nature 2007; 448 : 501–5. 20. Hiscott J. Triggering the innate antiviral response through IRF-3 activation. J Biol Chem 2007; 282 : 15325–9. 21. Fitzgerald KA, McWhirter SM, Faia KL, et al. IKKe and TBK1 are essential components of the IRF3 signaling pathway. Nat Immunol 2003; 4 : 491–6. 22. Sharma S, tenOever BR, Grandvaux N, et al. Triggering the interferon antiviral response through an IKK-related pathway. Science 2003; 300 : 1148–51. 23. Guo B, Cheng G. Modulation of the interferon antiviral response by the TBK1/IKKi adaptor protein TANK. J Biol Chem 2007; 282 : 11817–26. 24. Häcker H, Redecke V, Blagoev B, et al. Specificity in Toll-like receptor signalling through distinct effector functions of TRAF3 and TRAF6. Nature 2006; 439 : 204–7. 25. Oganesyan G, Saha SK, Guo B, et al. Critical role of TRAF3 in the Toll-like receptor-dependent and -independent antiviral response. Nature 2006; 439 : 208–11. 26. Agalioti T, Lomvardas S, Parekh B, et al. Ordered recruitment of chromatin modifying and general transcription factors to the IFN-beta promoter. Cell 2000; 103 : 667–78. 27. Chariot A, Leonardi A, Muller J, et al. Association of the adaptor TANK with the IκB kinase (IKK) regulator NEMO connects IKK complexes with IKKε and TBK1 kinases. J Biol Chem 2002; 277 : 37029–36. 28. Zhao T, Yang L, Sun Q, et al. The NEMO adaptor bridges the nuclear factor-κB and interferon regulatory factor signaling pathways. Nat Immunol 2007; 8 : 592–600. 29. Kayagaki N, Phung Q, Chan S, et al. DUBA : a deubiquitinase that regulates type I Interferon production. Science 2007; 318 ; 1628–32. 30. Andermarcher E, Bossis G, Farras R, Jariel-Encontre I, Piechaczyk M. La dégradation protéasomique : de l’adressage des protéines aux nouvelles perspectives thérapeutiques. Med Sci (Paris) 2005; 21 : 141–9. 31. Lobry C, Weil R. Mécanismes régulateurs de la voie NF-kappaB dans les lymphocytes T. Med Sci (Paris) 2007; 23 : 857–61. 32. Bisbal C, Salehzada T. La RNase L, une endoribonucléase au carrefour de la régulation des ARN viraux et cellulaires. Med Sci (Paris) 2008; 24 : 859–64. |