| |
| Med Sci (Paris). 2008 November; 24(11): 947–953. Published online 2008 November 15. doi: 10.1051/medsci/20082411947.Les Bryophytes, source potentielle de médicaments de demain ? Lucie Krzaczkowski,* Michel Wright, and Jean Edouard Gairin* Centre de Recherche en Pharmacologie-Santé, UMR2587 CNRS-Pierre Fabre, Institut de Sciences et Technologies du Médicament de Toulouse, 3, rue des Satellites, BP 94244, 31432 Toulouse Cedex 4, France |
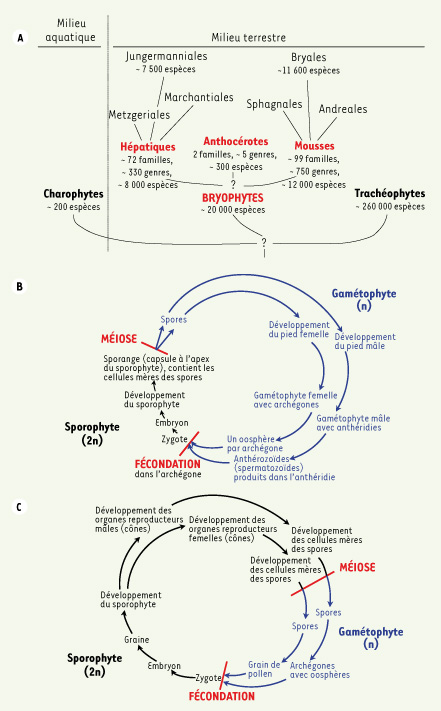
Groupe hétérogène de 12 000 mousses, 8 000 hépatiques et 300 anthocérotes (Figure 1), les Bryophytes constituent le second plus important phylum de plantes terrestres après les Angiospermes (voir lexique) [
1]. Malgré leur petite taille, leurs caractères morphologiques sont relativement complexes, permettant une colonisation d’habitats variés dans toutes les régions climatiques. Elles possèdent un cycle de vie où la phase haploïde prédomine, contrairement aux Trachéophytes pour lesquelles la phase diploïde est privilégiée (Figures 2B et 2C). Bryophytes et Trachéophytes ont divergé d’un ancêtre commun il y a 400 millions d’années (Figure 2A) et ont évolué parallèlement en développant des stratégies différentes d’adaptation au milieu terrestre. Bien que classiquement regroupées dans les Bryophytes, mousses et hépatiques ont aussi divergé très tôt au cours de l’évolution et se différencient par de nombreux caractères morphologiques et chimiques qui conduisent à les traiter de façon distincte.
 | Figure 1.
Exemples de Bryophytes. Les Bryophytes sont de petites plantes aux caractères morphologiques particuliers. g : gamétophyte, s : sporophyte. A. Mousse du genre Polytrichum. L’appareil végétatif correspond au gamétophyte (vert) qui se présente sous forme d’un pseudo-cormus comprenant un axe avec des organes foliacés. L’image montre des « fructifications » qui correspondent aux sporophytes (bruns) vivant aux dépens du gamétophyte. B. Hépatique à feuilles (Jungermanniale) du genre Jungermannia. Le gamétophyte est pourvu de feuilles insérées sur deux rangées latérales et porte le sporophyte. C. Hépatique à thalle (Metzgeriale) du genre Pellia. L’appareil végétatif correspond au gamétophyte qui se présente sous forme d’un thalle chlorophyllien ramifié et qui repose sur le substrat.D. Anthocérote du genre Phaeoceros. Le gamétophyte est un thalle aplati et rigide qui porte les sporophytes allongés et dressés. Ils sont verts à la base en raison de la présence de chlorophylle. E. Mousse du genre Neckera poussant sur un bloc rocheux. Les Bryophytes diffèrent des Trachéophytes par l’absence de tissu lignifié, de racine et souvent de tissu conducteur, ce qui limite leur taille. Elles possèdent des rhizoïdes qui leur permettent de s’installer sur des surfaces impénétrables aux racines des Trachéophytes et de coloniser des habitats variés dans toutes les régions climatiques (excepté le milieu marin). F. Cellules foliaires d’une hépatique du genre Nardia montrant des oléocorps (o) et des chloroplastes (c). Les oléocorps sont des organites caractéristiques des hépatiques, absents des autres végétaux (mousses, anthocérotes et plantes supérieures). Ils sont incolores, granuleux et au centre des cellules foliaires chez Nardia, tandis que les chloroplastes sont verts et localisés à la périphérie cellulaire. Les échelles sont indiquées de façon approximative (les photos A à E ont été reproduites avec l’aimable autorisation de Michael Lüth et sont issues du CD-ROM Bilder von Mossen, http://www.milueth.de). |
 | Figure 2.
Caractéristiques évolutives des Bryophytes. Phylogénie des Bryophytes (A) : les Bryophytes et les plantes vasculaires (Trachéophytes) constituent la lignée monophylétique des plantes terrestres, les Embryophytes. Selon les analyses phylogénétiques, ces deux groupes de plantes divergent d’un ancêtre commun proche d’une algue verte Charophyte. Cependant, il n’a pas encore été possible de construire un arbre évolutif non ambigu. La phylogénie, qui détermine les relations évolutives entre les organismes, s’appuie sur l’étude des fossiles et des données de systématique moléculaire. Peu de fossiles de Bryophytes ont été retrouvés, généralement postérieurs à ceux des plantes vasculaires. Les études moléculaires ne permettent pas actuellement de définir avec précision les relations évolutives entre les Bryophytes et les Trachéophytes et celles entre les différents groupes de Bryophytes. Le schéma simplifié représente les principaux ordres des Bryophytes et montre que les hépatiques et les mousses constituent deux groupes complexes d’un point de vue évolutif. Cycles biologiques comparés des Bryophytes (
B
: exemple du Polytric) et des Trachéophytes (
C
: exemple de l’If) : Comme tous les végétaux, les Bryophytes et les Trachéophytes ont un cycle de développement hétéromorphique où alternent des générations haploïdes (en bleu) et diploïdes (en noir). Dans le cas des Bryophytes, la phase haploïde domine : le gamétophyte (n) est grand, chlorophyllien et autonome, au contraire du sporophyte (2n) qui est réduit et reste fixé sur le gamétophyte(B). Il réalise rapidement la méiose dont sont issues les spores qui donneront naissance à de nouveaux gamétophytes. Au contraire, chez les Trachéophytes, la phase haploïde est réduite avec un gamétophyte non chlorophyllien, plus ou moins simplifié, tandis que le sporophyte généralement de grande taille et de structure complexe mène une vie autonome, indépendante du gamétophyte (C).
|
|
Utilisation en médecine traditionnelle Le mot « hépatique » tire son origine du grec « hêpar » qui signifie foie, en référence aux feuilles évoquant les trois lobes principaux de cet organe. Cette ressemblance a conduit à les employer pour traiter les affections du foie selon la Doctrine des Signatures [
2]. Des Bryophytes ont été utilisées comme rembourrage, dans des décoctions ou encore en pommades, broyées et mélangées à des huiles ou à du miel, pour soigner les plaies et les brûlures [
3,
4]. Asakawa en 1995 énumère une vingtaine de mousses et d’hépatiques utilisées en médecine traditionnelle chinoise contre la tuberculose pulmonaire, les saignements gingivaux, les coupures, etc. Elles sont également dites posséder des propriétés diurétiques, antipyrétiques, antiseptiques, anti-poisons [
5]… Une même mousse a souvent des applications variées, comme Rhodobryum giganteum (maladies cardiovasculaires, nervosité) ou Haplocladium catillatum (angines, bronchites, cystites). |
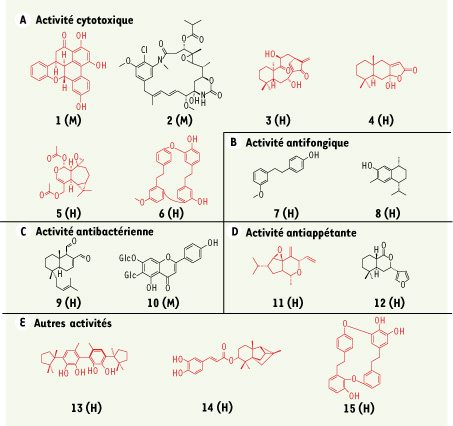
Sources de métabolites particuliers et de substances bioactives Les années 1970 marquent le début des études phytochimiques destinées à identifier les métabolites secondaires produits par les Bryophytes, essentiellement par les hépatiques. Ces dernières synthétisent des composés aromatiques, particulièrement des bibenzyls et des bisbibenzyls spécifiques, et des composés terpéniques, notamment des di- et sesquiterpènes originaux contenus dans des organites des cellules foliaires limités par une seule membrane et appelés oléocorps (Figure 1F). Les mousses et les anthocérotes, dépourvues d’oléocorps, possèdent majoritairement des métabolites plus classiques : lipides, terpènes, flavonoïdes dont des biflavonoïdes spécifiques pour les mousses, sesquiterpènes et quelques composés aromatiques pour les anthocérotes. L’isolement de composés nouveaux et originaux sur le plan phytochimique laisse entrevoir la découverte potentielle de nouvelles têtes de série actives. Cette approche revêt un intérêt tout particulier dans le domaine des médicaments antitumoraux, antibactériens et antifongiques où des phénomènes de résistance sont récurrents. Dans ces domaines, la recherche de produits nouveaux est indispensable pour améliorer l’approche thérapeutique. Caractérisation de composés actifs issus des Bryophytes La caractérisation de composés bioactifs issus des Bryophytes suit deux démarches. L’une consiste à identifier de nouvelles entités chimiques en purifiant les produits majoritaires qui sont ensuite soumis à des essais pharmacologiques. L’autre passe par la sélection d’un extrait actif puis la caractérisation des substances responsables de l’activité (suivi bioguidé). Quelques activités ont ainsi été décrites [ 5–
7] : insecticide, molluscicide, piscicidale, cardiotonique, neurotrophique, myorelaxante, de régulation de la croissance des plantes, d’inhibition d’enzymes, d’inhibition de la libération de superoxydes (impliqués dans diverses angiopathies) (Figure 3). Des études plus nombreuses ont porté sur les activités antibiotiques et antifongiques des Bryophytes, propriétés décrites dans la revue Science dès 1960 [
8]. Les substances actives (flavonoïdes, biflavonoïdes, terpènes, dérivés d’acides gras, bibenzyls et bisbibenzyls) constituent pour les plantes une « barrière chimique » contre les agressions des micro-organismes, ce qui justifie leurs utilisations traditionnelles contre les infections et maladies cutanées [
9]. Parfois, une espèce possède plusieurs substances actives avec des spectres d’action différents et les produits isolés présentent une activité plus faible que celle de l’extrait total suggérant des effets synergiques [ 5,
10].
 | Figure 3.
Diversité et originalité chimiques de quelques substances bioactives isolées à partir d’extraits de mousses (M) et d’hépatiques (H). En rouge : molécules aux squelettes originaux par rapport à celles isolées des végétaux supérieurs ; Glc = glucose. La configuration des molécules 2 et 14 est absolue ; la configuration des autres molécules chirales est relative. 1 : ohioensine A, benzonaphthoxanthenone isolée de Polytrichum ohioense (M), ED 50 = 2,7 µM sur P388 [ 5] ; 2 : ansamitocine P-3, maytansinoïde isolé de Claopodium crispifolium (M), ED 50 = 0,6 pM sur A549 [
14,
15] ; 3 : 8,9-secokaurane, diterpène isolé de Lepidolaena taylorii (H), IC 50 = 0,5 µM sur P388 [
17] ; 4 : glaucescenolide, lactone sesquiterpénique isolée de Schistochila glaucescens (H), IC 50 = 9 µM sur P388 [
23] ; 5 : plagiochiline A, sesquiterpène isolé de plusieurs espèces de Plagiochila (H), IC 50 = 0,8 µM sur cellules KB [ 5] ; 6 : riccardine A, bisbibenzyl isolé de Riccardia multifida (H), IC 50 = 23 µM sur cellules KB [ 5] ; 7 : bibenzyl isolé de plusieurs espèces de Radula (H), inhibe Trichophyton mentagrophytes à 270 µM [ 5] ; 8 : 7-hydroxycalamène, sesquiterpène isolé de Bazzania trilobata (H), IC 50 = 4 µM contre Phythophthora infestans [ 10] ; 9 : sacculatal, diterpène isolé de Pellia endiviifolia (H), inhibe Streptococcus mutans à 26 µM [
6] ; 10 : saponarine, flavonoïde isolé de Plagiomnium cuspidatum (M), inhibe Pseudomonas aeruginosa à 30 µM [ 5] ; 11 : hodgsonox, sesquiterpène isolé de Lepidolaena hodgsoniae (H), activité insecticide [ 7] ; 12 : ricciocarpine A, sesquiterpène isolé de Ricciocarpos natans (H), activité molluscicide [ 5] ; 13 : mastigophorène A, sesquiterpène isolé de Mastigophora diclados (H), activité neurotrophique [ 5] ; 14 : cyclomyltaylyl-3-caffeate, sesquiterpène isolé de Bazzania japonica, inhibe la libération de superoxyde [ 6] ; 15 : marchantine A, bisbibenzyl isolé de plusieurs espèces de Marchantia (H), possède entre autres des activités cardiotonique, de relaxation musculaire et d’inhibition de la calmoduline [ 5]. |
Exemple de substances cytotoxiques extraites des Bryophytes Les propriétés cytotoxiques de substances isolées chez les Bryophytes constituent une part importante des investigations phytochimiques et pharmacologiques de ces végétaux. Dans cette revue, nous utilisons cet exemple pour illustrer la variété et l’originalité de produits issus des Bryophytes, puis les difficultés associées à leurs études. Avant les années 1980, la cytotoxicité des Bryophytes reste peu étudiée. La connaissance d’utilisations traditionnelles, les premiers produits bioactifs isolés, la cytotoxicité de quelques Bryophytes, incitent le National Cancer Institute (NCI) à mener une campagne de criblage focalisée sur ces plantes au début des années 1980. Sur les 208 extraits évalués dans des tests de cytotoxicité in vitro, in vivo et sur l’inhibition de l’assemblage des microtubules, 39 extraits de mousses et 4 d’hépatiques ont été trouvés actifs [
11]. Au laboratoire, nous avons récemment criblé une banque d’échantillons de Bryophytes en utilisant un test phénotypique basé sur l’observation des effets de perturbation de la mitose dont certains éléments sont déjà des cibles antitumorales [
12,
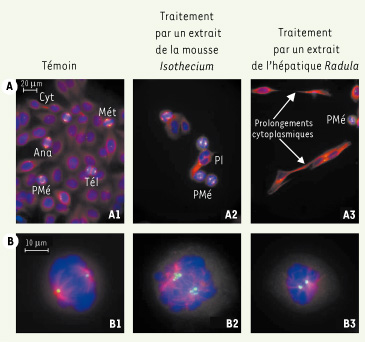
13]. Sur 232 spécimens extraits à l’acétate d’éthyle puis testés, 42 perturbent la mitose (Figure 4). Les Bryophytes peuvent ainsi être considérées comme une source potentielle de molécules susceptibles d’être soumises à des essais antitumoraux.
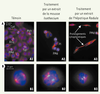 | Figure 4.
Effets d’extraits de Bryophytes sur des cellules cancéreuses humaines en culture (HeLa). Les cellules Hela sont marquées par immunofluorescence. Les microtubules (tubuline α/β) sont marqués par un fluorochrome rouge, les centrosomes (tubuline γ) par un fluorochrome vert, et l’ADN par un fluorochrome bleu. Les images présentées résultent de la superposition des trois marquages conduisant à une coloration jaune (superposition du rouge et du vert) des centrosomes quand ceux-ci nucléent les microtubules (A1, A2, A3 et B1). En revanche, lorsque la nucléation des microtubules est inhibée, les centrosomes apparaissent en vert (B2 et B3). A. Aspect général à faible grossissement. B. Aspect de cellules mitotiques en prométaphase à fort grossissement. Contrôle (1re colonne) : les cellules interphasiques sont reconnaissables à leur noyau elliptique et à leur forme allongée (A1). Les cellules mitotiques sont arrondies et toutes les phases de la mitose sont observées : prométaphase (PMé), métaphase (Mét), anaphase (Ana), télophase (Tél). Des cytokinèses (Cyt) sont également visibles. En prométaphase (B1), les cellules possèdent deux centrosomes (jaunes) d’où se développent les microtubules (rouges) formant ainsi les deux pôles du fuseau mitotique ; l’ADN est condensé en chromosomes répartis entre ces deux pôles. Traitement de 24 h par un extrait de la mousse Isothecium myosuroides (2e colonne) : la densité cellulaire est plus faible (cytotoxicité ?) et l’index mitotique (rapport entre le nombre de cellules en mitose sur le nombre de cellules total) est augmenté (A2). Les cellules en interphase sont soit arrondies, soit plurinucléées (Pl). Les cellules en mitose (B2), bien que majoritairement bipolaires, sont aberrantes : elles présentent diverses anomalies comme une fragmentation des centrosomes (verts) et un fuseau mitotique désorganisé. Traitement de 12 h par un extrait de l’hépatique Radula perrottetii (3e colonne) : la densité cellulaire est plus faible (effet cytostatique ?) et en interphase, la plupart des cellules possèdent de longues protrusions cytoplasmiques (A3). Les cellules en prométaphase (B3) ont un fuseau pseudo-monopolaire avec deux centrosomes peu éloignés l’un de l’autre. |
Peu de substances cytotoxiques ont été caractérisées à partir des mousses, uniquement des benzonaphthoxanthénones, composés aromatiques [5], et des analogues de la maytansine, comme l’ansamitocine P-3, actif sur plusieurs lignées tumorales humaines (ED50 autour de 10-12 M) [14, 15]. Très minoritaires dans les extraits, ces molécules sont présentes en quantités inférieures au ppm (de l’ordre de 1 mg pour 10-30 kg de mousse sèche). En revanche, les hépatiques ont permis l’isolement de plusieurs composés aromatiques (notamment des bisbibenzyls caractéristiques de ces végétaux), di- et sesquiterpéniques cytotoxiques [5] dont certains ont des squelettes nouveaux et parfois originaux. C’est le cas de diterpènes de type atisane et secokaurane fortement oxygénés possédant des IC50 comprises entre 0,3 et > 40 μM et des activités différentielles selon les lignées cellulaires tumorales [
16–
18]. D’autres diterpènes sont des agents antitumoraux potentiels, notamment ceux possédant un squelette de type kaurane, car ils ont un rôle bien caractérisé dans l’inhibition de la voie NF-κB et induisent ainsi l’apoptose. Certains composés issus d’espèces de Jungermannia ont une activité cytotoxique inférieure à 1 μM et dans un cas, les voies de signalisation caspase-8 et caspase-9 sont activées [
19–
21]. Des sesquiterpènes cytotoxiques ont également été identifiés par suivi bioguidé à partir de Chiloscyphus rivularis avec des IC50 de l’ordre de 10 μM sur différentes lignées cellulaires. Un des produits montre une activité sélective dans un test de dommages à l’ADN et n’agit pas comme inhibiteur des topoisomérases I ou II [
22]. D’autres composés nouveaux ont été isolés d’hépatiques, comme le glaucescenolide ou des bisbibenzyls connectés à un noyau sesquiterpénique [23]. Bien que certaines substances soient faiblement cytotoxiques, l’originalité de leurs structures incite toutefois à chercher et/ou synthétiser des analogues plus actifs. |
Difficultés des études chimiques et pharmacologiques L’étude des Bryophytes se heurte à des difficultés rencontrées dès la récolte des échantillons et lors de l’isolement des produits actifs. Tout d’abord, la petite taille des Bryophytes rend délicate l’identification sur le terrain, d’autant plus que plusieurs espèces de Bryophytes poussent généralement en mélange. À leur récolte s’associe celle du substrat et de débris végétaux nécessitant ensuite un tri minutieux. De plus, l’isolement et la caractérisation de substances bioactives par suivi bioguidé (voir ci-dessus) exigent de grandes quantités de plantes sèches (entre 10 et 250 g pour les hépatiques, entre 2 et 20 kg pour les mousses). La faible biomasse disponible rend donc nécessaire la récolte en plusieurs endroits. Or la composition chimique d’une même espèce peut varier selon le lieu de la récolte, ce qui rend aléatoires les collectes à grande échelle [
20,
24]. Les substances d’intérêt pharmacologique sont parfois présentes en quantité insuffisante pour déterminer leur structure. En effet, in vitro, les effets d’extraits actifs peuvent être détectés à des concentrations inférieures à 10 μg/ml. Or, l’activité d’un extrait brut dépend du nombre de produits actifs présents, de la quantité de chaque composé et de l’activité biologique intrinsèque de ces substances. Si la sensibilité des essais pharmacologiques permet de déceler un produit actif en faible quantité (de l’ordre du nanogramme pour une molécule active au nanomolaire comme le paclitaxel [Taxol®]), il en faut mille fois plus pour le caractériser par RMN (résonance magnétique nucléaire). Nous nous sommes heurtés à plusieurs reprises à cette difficulté de caractériser la molécule associée à une activité biologique lors de l’étude de mousses perturbant la mitose. La question des quantités de substances biologiquement actives devient cruciale si l’on envisage des essais in vivo afin d’étudier leur activité antitumorale. Pour une première évaluation chez la souris, ces essais nécessitent généralement entre 200 et 500 mg de produit en fonction de la dose optimale efficace et du schéma d’administration. Des quantités de l’ordre du gramme sont ensuite requises pour confirmer et étendre les essais. |
Origine des produits bioactifs Des bactéries, des cyanophycées, des champignons, vivent souvent en association avec les Bryophytes formant dans plusieurs cas des associations spécifiques [
25–
27]. Il est donc difficile d’exclure que les activités observées dans les extraits ne soient pas dues aux éléments associés à ces végétaux. Dans le cas des hépatiques, les produits bioactifs isolés jusqu’ici font partie des produits majoritaires et sont donc des substances propres à ces végétaux. La variabilité des constituants chimiques constatée au sein d’une espèce est occasionnelle et limitée à des lieux de collecte géographiquement éloignés. En revanche, les mousses synthétisent des composés simples et peu originaux ; l’origine des substances bioactives peut être discutée. En effet, nous avons remarqué que différents lots d’une même espèce récoltée en des endroits proches (< 1 m) peuvent exprimer des degrés de toxicité différents. Les composés actifs sont souvent très minoritaires. Ils peuvent être synthétisés par des organismes associés, ou éventuellement être modifiés par la mousse elle-même, voire être produits par la mousse en réponse à des substances issues des organismes associés. Les dérivés de la maytansine en constituent un exemple significatif chez les mousses (Figure 3A, composé 2) mais aussi chez les Trachéophytes, car il est établi qu’un micro-organisme associé est impliqué dans leur biosynthèse [
28]. Même si les produits actifs proviennent d’organismes associés, les mousses pourraient constituer des indicateurs de biocénose permettant la découverte de nouveaux organismes producteurs de substances originales. |
Perspectives et potentialités thérapeutiques Les études phytochimiques et pharmacologiques actuelles montrent que mousses et hépatiques n’ont pas le même intérêt. Les métabolites produits par les mousses ne sont pas d’une originalité particulière par rapport à ceux issus des autres végétaux. Leur petite taille et l’absence de racine les rendent très sensibles à la composition physico-chimique de la couche superficielle des sols et entraînent une micro-répartition beaucoup plus complexe que celle rencontrée pour les Trachéophytes. Les mousses constituent plutôt des indicateurs de la biodiversité encore inexploités : leur association avec des organismes spécifiques pourrait permettre d’isoler les micro-organismes associés, potentiellement nouveaux et producteurs de substances originales, puis de les cultiver afin d’obtenir les molécules actives en quantités importantes. Contrairement aux mousses, les hépatiques synthétisent des métabolites caractéristiques possédant pour certains des squelettes chimiques originaux. L’activité de ces composés a été évaluée in vitro, mais les essais in vivo sont rares et les mécanismes d’action non élucidés, ce qui est le principal obstacle à leur développement pharmaceutique. La faible biomasse des hépatiques représente un autre facteur limitant dans l’obtention de quantités suffisantes de produits pour leurs analyses biologiques. Cette difficulté peut être surmontée par l’utilisation de processus de synthèse chimique, comme c’est le cas de bisbibenzyls antifongiques [
29] ou de bibenzyls cytotoxiques [
30], ou par la culture in vitro des hépatiques ou de leurs cellules. En effet, ces cultures produisent qualitativement et quantitativement les mêmes métabolites secondaires que les végétaux récoltés dans la nature [
31]. Il deviendrait alors possible d’obtenir des substances bioactives en quantité suffisante afin non seulement d’élucider leur mécanisme d’action mais également de procéder aux essais in vivo. Des applications dans le domaine pharmaceutique pourront ensuite être envisagées par la synthèse ou l’hémisynthèse des produits retenus. Dans ce contexte, il est intéressant de rapprocher les difficultés décrites et les stratégies envisagées aujourd’hui avec les Bryophytes de celles rencontrées, il y a 25 ans, avec certains végétaux supérieurs, comme l’if Taxus brevifolia qui a fourni un anticancéreux majeur, le paclitaxel. En effet, l’activité cytotoxique de l’extrait de Taxus a été établie en 1962 mais la structure originale de la molécule active, le paclitaxel, n’a été déterminée qu’en 1971. Les essais cliniques ont été tardifs (1984) pour des questions d’approvisionnement d’abord, de solubilité ensuite. Le paclitaxel, mis sur le marché en 1992, est aujourd’hui produit par une approche semi-synthétique ainsi que par la culture de cellules végétales [
32]. En 1962, l’exploitation thérapeutique de l’activité cytotoxique des extraits de Taxus semblait improbable ; pourtant aujourd’hui le paclitaxel contribue largement au traitement de cancers et 33 analogues sont en développement pré-clinique ou clinique. Cette référence historique aux difficultés rencontrées lors de la découverte et du développement de ce médicament anticancéreux majeur ne peut que renforcer et valider l’intérêt qu’il nous faut porter aujourd’hui aux Bryophytes.
|
Nous remercions Michael Lüth pour ses photographies de Bryophytes (http://www.milueth.de) et le Dr Georges Massiot pour ses commentaires et sa lecture critique du manuscrit. Lucie Krzaczkowski a bénéficié d’une bourse BDIE CNRS-Pierre Fabre.
|
Footnotes |
1. Shaw AJ, Goffinet B. Bryophyte bology. Cambridge : Cambridge University Press, 2000 : 476 p. 2. De Sloover JL. Hépatiques, mousses et muscinées. Namur : Presses Universitaires, 1997 : 194 p. 3. Glime JM, Saxena D. Uses of Bryophytes. New Delhi : Today and Tomorrow’s Printers and Publishers, 1991 : 100 p. 5. Asakawa Y. Chemical constituents of the bryophytes. Wien-New York : Springer Verlag, 1995 : 618 p. 6. Asakawa Y. Biologically active compounds from bryophytes. Pure Appl Chem 2007; 79 : 557–80. 7. Ainge GD, Gerard PJ, Hinkley SF, et al. Hodgsonox, a new class of sesquiterpene from the liverwort Lepidolaena hodgsoniae. Isolation directed by insecticidal activity. J Org Chem 2001; 66 : 2818–21. 8. McCleary JA, Sypherd PS, Walkington DL. Mosses as possible sources of antibiotics. Science 1960; 131 : 108. 9. Kahn A. Des plantes et des hommes. Med Sci (Paris) 2001; 17 : 825–8. 10. Scher JM, Speakman JB, Zapp J, et al. Bioactivity guided isolation of antifungal compounds from the liverwort Bazzania trilobata (L.) S.F. Gray. Phytochemistry 2004; 65 : 2583–8. 11. Spjut RW, Suffness M, Cragg GM, et al. Mosses, liverworts, and hornworts screened for antitumor agents. Econ Bot 1986; 40 : 310–38. 12. Arnal I, Sassoon I, Tournebize R. Dynamique du fuseau : vers une cible anti-cancéreuse. Med Sci (Paris) 2002; 18 : 1227–35. 13. Pommier Y, Kohn KW. Cycle cellulaire et points de contrôle : nouvelles cibles thérapeutiques. Med Sci (Paris) 2003; 19 : 173–86. 14. Sakai K, Ichikawa T, Yamada K, et al. Antitumor principles in mosses : the first isolation and identification of maytansinoids, including a novel 15-methoxyansamitocin P-3. J Nat Prod 1988; 51 : 845–50. 15. Suwanborirux K, Chang CJ, Spjut RW, et al. Ansamitocin P-3, a maytansinoid, from Claopodium crispifolium and Anomodon attenuatus or associated actinomycetes. Experientia 1990; 46 : 117–20. 16. Perry NB, Burgess EJ, Tangney RS. Cytotoxic 8,9-secokaurane diterpenes from a New Zealand liverwort, Lepidolaena taylorii. Tetrahedron Lett 1996; 37 : 9387–90. 17. Perry NB, Burgess EJ, Baek SH, et al. 11-oxygenated cytotoxic 8,9-secokauranes from a New Zealand liverwort, Lepidolaena taylorii. Phytochemistry 1999; 50 : 423–33. 18. Perry NB, Burgess EJ, Baek SH, et al. The first atisane diterpenoids from a liverwort : polyols from Lepidolaena clavigera. Org Lett 2001; 3 : 4243–5. 19. Nagashima F, Kasai W, Kondoh M, et al. New ent-kaurene-type diterpenoids possessing cytotoxicity from the New Zealand liverwort Jungermannia species. Chem Pharm Bull (Tokyo) 2003; 51 : 1189–92. 20. Nagashima F, Kondoh M, Fujii M, et al. Novel cytotoxic kaurane-type diterpenoids from the New Zealand Liverwort Jungermannia species. Tetrahedron 2005; 61 : 4531–44. 21. Kondoh M, Nagashima F, Suzuki I, et al. Induction of apoptosis by new ent-kaurene-type diterpenoids isolated from the New Zealand liverwort Jungermannia species. Planta Med 2005; 71 : 1005–9. 22. Wu C, Gunatilaka AA, McCabe FL, et al. Bioactive and other sesquiterpenes from Chiloscyphus rivularis. J Nat Prod 1997; 60 : 1281–6. 23. Scher JM, Burgess EJ, Lorimer SD, et al. A cytotoxic sesquiterpene and unprecedented sesquiterpene-bisbibenzyl compounds from the liverwort Schistochila glaucescens. Tetrahedron 2002; 58 : 7875–82. 24. Spjut RW, Cassady JM, McCloud T, et al. Variation in cytotoxicity and antitumor activity among samples of the moss Claopodium crispifolium (Thuidiaceae). Econ Bot 1988; 42 : 62–72. 25. Davey ML, Currah RS. Interactions between mosses (Bryophyta) and fungi. Can J Bot 2006; 84 : 1509–19. 26. Opelt K, Berg G. Diversity and antagonistic potential of bacteria associated with bryophytes from nutrient-poor habitats of the Baltic sea coast. Appl Environ Microbiol 2004; 70 : 6569–79. 27. Read DJ, Ducket JG, Francis R, et al. Symbiotic fungal associations in « lower » land plants. Philos Trans R Soc Lond B Biol Sci 2000; 355 : 815–31. 28. Cassady JM, Chan KK, Floss HG, et al. Recent developments in the maytansinoid antitumor agents. Chem Pharm Bull (Tokyo) 2004; 52 : 1–26. 29. Siddiqui IR, Singh PK, Singh J. Synthesis and fungicidal activity of novel 4,4’-bis(2’ ‘-aryl-5’ -methyl/unsubstituted-4’ ‘-oxo-thiazolidin-3’ ‘-yl) bibenzyl. J Agric Food Chem 2003; 51 : 7062–5. 30. Barrero AF, Herrador MM, Quilez del Moral JF, et al. Couplings of benzylic halides mediated by titanocene chloride : synthesis of bibenzyl derivatives. J Org Chem 2007; 72 : 2251–4. 31. Hohe A, Reski R. From axenic spore germination to molecular farming. One century of bryophyte in vitro culture. Plant Cell Rep 2005; 23 : 513–21. 32. Kingston DG. Taxol and its analogs. In : Cragg GM, Kingston DG, Newman DJ, eds. Anticancer agents from natural products. Boca Raton : CRC Press, 2005 : 89–122. |