| |
| Med Sci (Paris). 2008 November; 24(11): 939–946. Published online 2008 November 15. doi: 10.1051/medsci/20082411939.Plantes, médicaments et génétique
Quelles applications pour demain ? Loïc Faye1* and Yves Champey2* 1CNRS, Université de Rouen, IFRMP23, UFR des Sciences, 76821 Mont Saint Aignan Cedex, France 2Genopole, 5, rue Henri Desbruères, 91030 Évry Cedex, France |
Les plantes au cœur de l’histoire du médicament Dès l’antiquité, des recueils comme le Pen Tsao (Chine 2800 av.-J.C.), les papyrus d’Eber (Egypte 1500 av.-J.C.) ou encore les écrits d’Hypocrate (Grèce 500 av.-J.C.) présentent plusieurs centaines de plantes médicinales et de remèdes à base de plantes. Au moyen-âge, certaines abbayes comme celle de Salagon (Haute-provence) développent la culture des plantes médicinales et une phytothérapie enrichie par les explorations (exemple : Quinquina du Pérou). À la même époque, dans la pharmacopée arabe et juive, on assiste aux premiers développements d’une chimie d’extraction et certaines universités, comme celles de Salerne ou Montpellier, se spécialisent dans la recherche de nouveaux médicaments à base de plantes, et forment les premiers apothicaires. Au début du XIXe siècle, l’on observe un grand tournant dans l’histoire du médicament lorsque, imprégnée jusqu’alors d’une pratique empirique et souvent d’inspiration magico-religieuse, la pharmacie commence à être dominée par la chimie scientifique. L’apparition de la chimie structurale permet l’identification et la caractérisation des substances actives présentes dans les extraits végétaux. La chimie d’extraction devient aussi de plus en plus performante et permet dès 1815 l’isolement de la morphine à partir du pavot ou en 1820, la purification de la quinine de l’écorce de quinquina. Enfin, les premières molécules thérapeutiques issues de la chimie de synthèse font leur apparition dès 1899, avec la synthèse de l’aspirine par Bayer. Avec la chimie scientifique, c’est la professionnalisation et l’industrialisation qui font leur entrée dans l’histoire du médicament au début du XIXe siècle. Peu à peu, une méthodologie rigoureuse s’installe avec les essais thérapeutiques en double aveugle et le rapprochement entre le chimiste, le physiologiste, le biochimiste et le clinicien. La purification de molécules à usage thérapeutique s’élargit alors à d’autres systèmes que les plantes avec en particulier, l’isolement de nombreuses protéines à partir du sang humain. Aujourd’hui encore, cette chimie d’extraction et de synthèse est pourvoyeuse d’une grande partie de nos médicaments. Avec l’apparition du génie génétique vers 1960, des molécules complexes, difficiles à isoler ou encore impossibles à synthétiser, vont être produites en grande quantité et en toute sécurité dans des organismes génétiquement modifiés (OGM) : bactéries, levures ou encore cellules animales. Ainsi, le génie génétique va rapidement enrichir et révolutionner les méthodes de recherche et de production des médicaments. Ce n’est qu’en 1989, avec la production d’un anticorps dans des plantes de tabac, que les plantes génétiquement modifiées (PGM) entrent dans la liste des OGM producteurs de médicaments recombinants. On verra plus loin que depuis ce premier essai, les PGM ont montré leur capacité à produire de nombreuses protéines thérapeutiques, en masse et à bas coût. |
Les molécules thérapeutiques d’origine végétale Les plantes sont encore aujourd’hui au coeur de la pharmacopée humaine. En effet, en 2006, les molécules thérapeutiques d’origine végétale utilisées en médecine humaine représentaient un marché de plus de 30 milliards de dollars et environ 50 % des petites molécules mises sur le marché pour le traitement des cancers étaient extraites ou dérivées de plantes. Il est également intéressant de noter qu’au début du XXIe siècle, plusieurs médicaments importants sont issus de médecines traditionnelles d’origine végétale ou de recherches chimiques sur des molécules d’origine végétale. Une démarche systématique consiste aujourd’hui à cribler des familles entières de substances chimiques provenant d’extraits purifiés de substances végétales ou marines, d’isoler la substance qui produit l’effet observé, de la caractériser et de la synthétiser ou de l’extraire en fonction de la difficulté ou du coût de ces opérations (→) [
1]. (→) Voir l’article de Lucie Krzaczkowski et al., page 947 de ce numéro
Ces opérations scientifiques et techniques permettent de produire des médicaments nouveaux de grande actualité. Trois exemples, choisis dans les domaines des maladies tropicales, du cancer et de la grippe, montrent l’actualité de ces recherches. L’artémisinine dans le traitement du paludisme Le paludisme est un fléau de santé publique majeur dans les populations pauvres des pays en voie de développement. Trois cent millions de personnes sont exposées chaque année à la maladie et deux millions de morts sont recensés dont la moitié d’enfants en dessous de cinq ans. Le premier médicament efficace, la quinine, était déjà issu des observations faites au début du XVII e siècle par des apothicaires jésuites, au Pérou chez les indiens Ketchua. La chimie moderne a créé un assez grand nombre de molécules synthétiques qui ont été largement utilisées, souvent mal à propos, et des résistances sont apparues compliquant considérablement le traitement de la maladie. La situation a été modifiée par l’apport de l’artémisinine produite par la Chine moderne. La médecine traditionnelle chinoise sait traiter « les fièvres » par des extraits de qinghaosu (armoises). Les chimistes chinois ont identifié le principe actif il y a une trentaine d’années et en ont fait le médicament de choix en Chine. Il a fallu encore une quinzaine d’années de recherche pour découvrir l’importance de l’artémisinine et pour que les chercheurs chinois la transforment en un médicament. C’est le médicament principal des associations à doses fixes utilisées dans les schémas thérapeutiques recommandés par l’OMS, et progressivement adoptés par les pays d’Afrique où la maladie représente l’un des grands fléaux de santé publique. La production d’armoise est devenue en Chine, mais aussi en Asie du Sud-Est et en Afrique, une source de revenus pour un grand nombre d’agriculteurs. Les prix de l’artémisinine fluctuent comme le font les prix des productions agricoles, en fonction des conditions climatiques mais aussi en fonction de l’offre et de la demande et donc des surfaces cultivées. La menace plane d’une pénurie due à une demande trop forte, à des prix trop élevés ou à des conditions climatiques défavorables qui entraînent une baisse de la production. Cette crainte a suscité la mise en place de programmes de recherches, maintenant en cours et financés par la Fondation Bill et Melinda Gates, dont l’objectif est la mise au point de productions par des bactéries transgéniques qui pourraient en théorie assurer un approvisionnement plus facilement prévisible en qualité et en quantité. L’If et le Taxol dans le traitement du cancer du sein Les substances d’origine naturelle sont le plus souvent des structures moléculaires d’une grande complexité. Elles servent de support aux recherches des chimistes médicinaux. Parmi ces molécules, le docétaxel est utilisé dans les schémas thérapeutiques d’un grand nombre de cancers depuis la fin des années 1980. Les chimistes du National Cancer Institute aux États-Unis, avaient observé l’efficacité d’extraits d’ifs (paclitaxel) de la côte Ouest des États-Unis ( Taxus brevifolia) dans des tests classiques d’activité utilisant des cellules cancéreuses. Après plusieurs années de travail, cette substance a donné naissance à un médicament important pour le traitement du cancer du sein : le taxol. La grande difficulté, très vite apparue, est que le paclitaxel était extrait de l’écorce d’arbres centenaires et que le prélèvement des écorces tuait ces arbres. C’est ici qu’intervient l’Institut des Substances Naturelles de Gif-sur-Yvette, laboratoire du CNRS, qui a mis au point une méthode semi-synthétique de production du docétaxel, extrait des bourgeons et des aiguilles de Taxus bacata dont la cueillette mondiale, bien organisée, permet le renouvellement de ces aiguilles et la pérennité d’une production régulière du médicament anticancéreux. Cette recherche a stimulé un grand nombre d’équipes de chimistes qui ont maintenant produit plusieurs succédanés de ces molécules complexes, très difficiles à produire, mais indispensables. L’anis et l’oseltamivir (Tamiflu®) dans le traitement de la grippe Des graines d’anis entrent dans la composition d’un très grand nombre de recettes de cuisine chinoises et indiennes, et dans la composition d’assaisonnements de nombreux mets dans les pays d’Asie. La substance chimique extraite de ces graines d’anis, l’acide shikimique, a donné naissance à l’oseltamivir, un des rares médicaments dont l’efficacité est prouvée dans le traitement de la grippe (Tamiflu ®). Le médicament est prescrit à la satisfaction du laboratoire suisse qui le produit, mais les menaces d’épidémie de grippe aviaire au cours de l’hiver 2005 ont mobilisé de façon massive tous les services de santé publique dans le monde. La question de la constitution de stocks suffisants d’oseltamivir pour répondre à une demande éventuelle massive pour tenter de circonscrire l’épidémie à une région où elle apparaîtrait chez l’homme, a mis en lumière le besoin de nouvelles sources d’approvisionnement. Une campagne de recherche intensive a été alors déclenchée, impliquant un grand nombre d’équipes de chimistes médicinaux, et cinq voies de synthèse nouvelles ont été mises au point en l’espace de quelques mois. Des productions nouvelles ont pu rapidement être mises en œuvre et répondre ainsi à la nécessité de constitution de stocks. Ces trois exemples illustrent l’importance des molécules thérapeutiques d’origine végétale, ils montrent aussi que rien n’est jamais acquis en matière de thérapeutique et de santé publique et que des recherches sont toujours nécessaires pour améliorer les situations ou répondre à des exigences particulières, et cela quelle que soit l’origine des inventions. |
OGM, PGM et médicaments recombinants Depuis leur première introduction dans le secteur de la pharmacie en 1982, avec la mise sur le marché d’une insuline humaine produite chez Escherichia coli (l’Humulin produite par Genentech), les organismes génétiquement modifiés (OGM) ont été largement utilisés pour la production de protéines d’intérêt thérapeutique trop complexes pour être synthétisées, ou encore dont la purification présente trop de risques de contamination par des virus ou des pseudovirus dangereux pour l’homme. Les OGM les plus fréquemment utilisés comme outils de production de médicaments recombinants par les industriels de la pharmacie sont des bactéries, des levures, ou encore des cellules animales. Ils permettent la production, dans des conditions parfaitement contrôlées, de molécules plus ou moins complexes. La production des molécules les plus simples étant confiée à des bactéries transgéniques, alors que des molécules plus complexes comme les anticorps, qui nécessitent pour leur activité thérapeutique de nombreuses étapes de maturation post-traductionnelle, sont produites le plus souvent dans des cellules de mammifères comme les cellules ovariennes de hamster chinois (CHO). En 1982, la première plante transgénique est mise au point. Il s’agit d’une plante de tabac qui résiste à un antibiotique. Cette découverte ouvre rapidement la voie à l’incorporation dans des plantes de nouvelles caractéristiques, telles que la résistance aux insectes ou la tolérance à certains herbicides. Une autre application de la transformation génétique des plantes concerne leur utilisation pour la production de médicaments recombinants comme les anticorps, les vaccins sous-unitaires ou encore les allergènes recombinants. Les planticorps La demande en anticorps recombinants destinés principalement à l’immunothérapie des cancers croît très rapidement. Elle pourrait dépasser prochainement la capacité de production des installations disponibles utilisant des cellules de mammifères cultivées en bioréacteurs. C’est pourquoi, après la démonstration dès 1989, par une équipe californienne, de la possibilité de produire un anticorps dans des feuilles de tabac, de nombreux anticorps ou fragments d’anticorps ont été produits dans différentes plantes génétiquement modifiées (PGM) telles que tabac, pomme de terre, luzerne, orge, blé maïs, Arabidopsis, etc. [
2]. Toutefois, aucun « planticorps » n’a encore été commercialisé en raison de spécificités végétales propres à la maturation de ces molécules. Ainsi, nous avons montré qu’un anticorps produit dans une cellule végétale diffère essentiellement par sa partie sucre (N-glycane) lorsque l’on le compare au même anticorps produit dans une cellule de mammifère. En raison de l’immunogénicité des N-glycanes végétaux, l’utilisation d’un planticorps en thérapie chez l’homme présente des risques. Ainsi, parmi les planticorps en cours d’essais cliniques, le produit le plus avancé, actuellement en phase II, reconnaît la principale protéine d’adhésion de Streptococcus mutans, un pathogène oral responsable de la carie dentaire ; il est destiné à une application locale. Nos travaux actuels ont pour objectif, grâce au transfert de plusieurs gènes humains dans le tabac et la luzerne, de produire dans ces plantes des planticorps présentant des N-glycanes « humanisés » [
3]. Ainsi, nos résultats récents montrent que la co-expression transitoire dans des feuilles de tabac des chaînes lourdes et des chaînes légères constitutives d’un anticorps, et d’une glycosyltransférase humaine, permet de produire de grandes quantités d’un anticorps dont la glycosylation est compatible avec une utilisation chez l’homme. Les contraintes liées aux maturations post-traductionnelles spécifiques des plantes ne sont donc plus un obstacle à l’utilisation des planticorps en thérapie chez l’homme puisque plusieurs systèmes végétaux de production présentant une glycosylation humanisée sont maintenant disponibles. La « banane vaccin » ou les vaccins sous unitaires d’origine végétale C’est le concept de vaccination orale qui a suscité l’utilisation de plantes pour la production de vaccins. Ainsi, C. Arntzen en 1995 propose de remplacer la vaccination par injection d’antigènes vaccinaux par l’administration par voie orale d’un végétal consommable produisant ces mêmes antigènes [
4]. De là est né un nouveau concept : la « banane vaccin ». Ce concept a beaucoup évolué et il n’est plus question aujourd’hui de cultiver dans chaque village africain quelques bananiers transgéniques fournissant aux populations locales l’ensemble des vaccins nécessaires. La nécessité de standardisation, de dosage des antigènes et même la mise en évidence que la production de bananiers transgéniques soulève des difficultés techniques inattendues ont fait évoluer les projets de vaccination orale par PGM vers plus de réalisme. Ce concept a toutefois suscité une grande activité de recherche dans ce domaine et de très nombreux vaccins utilisables par voie orale ont été produits depuis dans de nombreuses PGM [
5]. Récemment des fondations caritatives, en particulier la fondation Bill et Melinda Gates, ont financé plusieurs équipes de recherche et sociétés de biotechnologie en leur fixant comme objectif de développer des PGM produisant des vaccins peu coûteux (moins de 0,8 dollar la dose) et dont la conservation au froid n’est pas nécessaire. En effet, le coût, mais aussi et surtout la logistique, sont des freins majeurs pour l’accès des populations des pays en développement aux vaccins disponibles aujourd’hui : comment mettre à la disposition de ces populations des produits périssables alors que les routes et les systèmes de conservation au froid ne sont pas disponibles. Une très forte activité de recherche dans ce secteur concerne également l’utilisation de PGM pour la production de vaccins oraux destinés à la médecine vétérinaire. Ainsi, plus de trente vaccins destinés aux animaux ont déjà été produits chez les plantes (fièvre aphteuse, rage, gastroentérite porcine, myxomatose, etc.), et le premier médicament recombinant issu d’une plante transgénique ayant obtenu une autorisation de mise sur le marché est un vaccin contre la maladie de Newcastle du poulet, produit dans des cellules de tabac par la société Dow AgroSciences (http://www.dowagro.com/ ; Newcastle disease vaccine). Plusieurs vaccins oraux destinés aux chiens ou aux chevaux pourraient être commercialisés prochainement par cette société. Alors que les objectifs des travaux présentés ci-dessus concernent la production de vaccins peu coûteux, stables à température ambiante et utilisables par la voie orale sous forme de poudres ou de pâtes, ou sous forme hautement purifiée pour une administration par voie injectable, nos travaux en cours cherchent à exploiter les spécificités des plantes comme système de production. Ainsi, en collaboration avec l’Institut de Recherche Pierre Fabre, nous recherchons si les maturations protéiques spécifiques des cellules végétales pourraient faciliter la production en bioréacteur d’un vaccin sous unitaire contre la bronchiolite alors qu’aucun autre OGM n’a encore permis cette production. De la même façon, nous étudions si les glycosylations spécifiques des plantes, alors qu’elles représentaient un handicap pour l’utilisation des planticorps, ne pourraient pas être, en revanche, un atout pour la production de vaccins, en amplifiant l’immunogénicité de certains antigènes et/ou en facilitant leur présentation aux cellules dendritiques de la muqueuse buccale [3]. Des PGM pour la production d’allergènes recombinants Les allergies sont de plus en plus fréquentes et concernent aujourd’hui le quart de la population mondiale. Les manifestations allergiques vont du simple rhume des foins au choc anaphylactique entraînant dans la plupart des cas de graves conséquences et pouvant engager le pronostic vital. Les allergies les plus fréquentes en Europe et aux États-Unis sont dues aux pollens de graminées et aux acariens. Aujourd’hui le traitement des patients allergiques par désensibilisation consiste en des injections répétées de quantités croissantes d’extraits protéiques totaux d’organes ou d’organismes contenant les allergènes. Ainsi, c’est un extrait protéique de culture d’acariens qui sera utilisé pour la désensibilisation et non les quelques protéines de cet extrait auxquelles sont allergiques la majorité de malades. Afin d’accroître la spécificité de la désensibilisation par l’utilisation de produits standardisés et de composition parfaitement définie, un objectif est aujourd’hui de remplacer les extraits bruts par un mélange d’allergènes majeurs purifiés produits dans des OGM. En collaboration avec la société Stallergenes SA, nous avons cloné les gènes codant les allergènes majeurs de l’acarien Dermatophagoides pteronyssinus et nous avons introduit ces gènes dans le génome de cellules de tabac. Ces cellules génétiquement modifiées, cultivées en fermenteur, permettent aujourd’hui de produire en masse et en condition confinée des allergènes recombinants qui présentent les mêmes caractéristiques physicochimiques et biologiques que les allergènes naturels. Ces allergènes recombinants sont actuellement en cours de validation dans la perspective de leur utilisation pour la désensibilisation de patients [
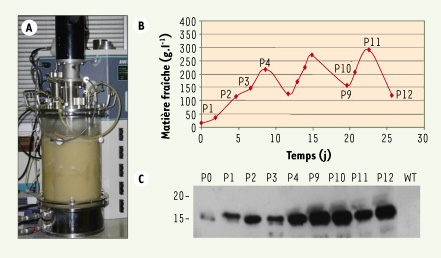
6]. Dans ce cas précis, le choix du système de production d’allergènes recombinants n’a pas été un choix a priori. En effet, une étude de faisabilité financée par OSEO-ANVAR (http://www.oseo.fr/), a été menée en parallèle avec plusieurs OGM : bactéries, levures, plantes et cellules de tabac. Parmi ces différents OGM, seuls les systèmes végétaux ont été capables de « copier à l’identique » les allergènes d’acariens. C’est pour des raisons de sécurité environnementale évidentes que nous avons décidé de produire ces allergènes dans des cellules de tabac cultivées en milieu confiné en fermenteur, plutôt que dans des plantes de tabac dont la culture en serre n’offre pas les garanties d’un confinement aussi strict (Figure 1).  | Figure 1.
Production de l’allergène d’acarien Derp2 dans des cellules de tabac cultivées en bioréacteur. A. Après sélection, un clone « fort producteur » de cellules transgéniques BY2 de tabac est transféré pour être cultivé dans un fermenteur de 10l, conduit en mode discontinu. B. L’étude porte ici sur trois cycles de culture, pour une durée totale de 26 jours. Le fermenteur est vidangé partiellement à la fin de chaque cycle. C. L’allergène recombinant est sécrété et s’accumule sous forme soluble dans le milieu de culture des cellules de tabac où il présente une grande stabilité. La concentration de Derp2 est environ de 50 mg/l dans le milieu dès la fin du premier cycle de culture (collaboration UMR CNRS 6037-Stallergenes SA-R & D Nestlé-Tours). |
|
Diversité des systèmes de production de médicaments recombinants dans les plantes Le stockage dans les graines Les quelques exemples qui précèdent illustrent la grande diversité de molécules thérapeutiques qui ont été produites dans des plantes transgéniques. Ces exemples montrent aussi la capacité des plantes à produire des molécules complexes et enfin, comme l’illustre la Figure 2, la grande diversité des systèmes de production offerte par les PGM. Ainsi les protéines thérapeutiques peuvent être stockées dans différents organes de la plante, les graines ou les feuilles par exemple. Les graines sont des organes végétaux spécialisés dans le stockage de réserves, en particulier de protéines. La stabilité des protéines de réserve dans la graine est également observée pour les protéines recombinantes à usage thérapeutique qui y sont stockées. Ainsi, des planticorps produits dans des graines de maïs sont stables et conservent leur activité biologique pendant plusieurs années sans qu’il soit nécessaire de stocker ces graines au froid. De nombreuses protéines recombinantes ont également été produites dans des feuilles ou dans des fruits ; dans ce cas l’extraction doit être rapide après la récolte, à moins que ces organes ne soient destinés à la vaccination orale. Dans ce second cas, ils seront broyés et éventuellement lyophilisés avant d’être conditionnés pour une administration par voie orale sous forme de poudre ou de pâte.
 | Figure 2.
Les plantes offrent une grande diversité de systèmes de production de médicaments recombinants. De nombreux médicaments recombinants (anticorps, antigènes, hormones, etc.) ont été produits dans des plantes transgéniques et stockés plus particulièrement dans certains organes végétaux comme les graines (A) (maïs, riz, etc) ou les feuilles (B) (tabac, luzerne, etc.). La plante offre également au niveau cellulaire de nombreux compartiments de stockage des médicaments recombinants comme le système endomembranaire de sécrétion (vacuole, réticulum endoplasmique), le cytosol ou les chloroplastes (C). Comme les organes de la plante (graine ou feuille), ces différents compartiments de la cellule végétale représentent à eux seuls des systèmes d’expression distincts où la protéine d’intérêt présentera une stabilité et des maturations post-traductionnelles différentes. Les plantes transgéniques productrices de médicaments sont cultivées en plein champ (D) ou encore dans des serres (E) qui permettent un contrôle de l’environnement et la reproductibilité des conditions de culture. Enfin, des cellules végétales cultivées en fermenteur (F) permettent une production de médicaments recombinants en conditions confinées et parfaitement contrôlées. |
La cellule végétale offre également plusieurs compartiments de production (Figure 2C). Ainsi des molécules complexes produites dans le système de sécrétion de la cellule végétale subiront des processus de maturation comme dans des cellules de mammifères, à l’exception de la glycosylation comme on l’a vu plus haut. La production peut être ciblée vers différents sous compartiments de ce système de sécrétion, chacun exprimant un processus de maturation spécifique. La production de protéines recombinantes peut également avoir lieu dans les chloroplastes. Ces organites, comme les bactéries, sont parfaitement adaptées à la production en très grande quantité de molécules thérapeutiques simples [
7]. Production en milieu ouvert ou fermé Enfin, les systèmes de cultures des PGM sont également nombreux. La production au champ ne se justifiera que pour des protéines thérapeutiques pour lesquelles la demande est très forte, comme l’albumine humaine ou l’insuline dont les besoins annuels s’expriment en dizaines, voire en centaines, de tonnes. La production d’une protéine thérapeutique en milieu ouvert nécessite en effet des études d’impact approfondies, tant sur l’environnement que sur la santé humaine, qui ne se justifieraient pas pour des productions réalisables en conditions confinées. Les PGM peuvent également être cultivées en milieu semi-confiné comme des serres. Certaines entreprises de biotechnologies ont d’ailleurs investi récemment dans la construction de complexes de production associant serres de haut niveau de confinement et unités d’extraction aux normes GMP (Good manufacturing practice) pour la production de médicaments à partir de PGM (http://www2.medicago.com/en/). Enfin, comme nous l’avons évoqué plus haut, les fermenteurs végétaux de seconde génération en cours de développement par certaines compagnies, vont offrir des conditions de production parfaitement adaptées aux produits pharmaceutiques avec un contrôle rigoureux de l’environnement des cellules végétales génétiquement modifiées utilisées pour la production de molécules thérapeutiques [
8]. Ainsi, en 2007, la société Protalix (Israël) a débuté les essais cliniques d’une glucocérébrosidase recombinante (destinée au traitement de la maladie de Gaucher) produite dans des cellules de carotte cultivées en fermenteurs jetables [
9] (http://www.protalix.com/). Coûts et rendements Les coûts de purification d’une molécule pharmaceutique représentent souvent plus de 80 % du prix du produit fini. L’utilisation de cellules végétales cultivées en fermenteur et sécrétant la protéine pharmaceutique dans leur milieu de culture pauvre en protéines contaminantes simplifie la purification du produit recombinant. Cet atout pourrait compenser, au moins en partie, les surcoûts liés à la mise en œuvre et à l’utilisation de fermenteurs végétaux. Les plantes transgéniques sont bien adaptées à la production en masse de molécules pharmaceutiques parce que les surfaces mises en culture, contrairement au volume des fermenteurs, ne sont pas limitantes. Cela venant compenser des rendements souvent assez faibles et des délais importants pour la mise en place du système de production. Ainsi, les rendements en protéines thérapeutiques produites dans des feuilles de tabac transgénique dépassent rarement 1 à 50 mg/kg de matière fraîche. De plus, l’obtention d’une lignée transgénique stabilisée productrice d’une protéine pharmaceutique est un processus très long qui nécessite plusieurs années de travail dans certains végétaux comme le maïs. Mais, six a douze mois sont également nécessaires après la transformation de cellules de mammifères avant de produire le premier gramme d’un anticorps monoclonal. Avec l’introduction des techniques de « transplastomique », des rendements très élevés (2 à 5 g/kg de matière fraîche) ont été obtenus pour des molécules thérapeutiques produites dans les chloroplastes de feuille de tabac. Enfin, il est maintenant possible de produire très rapidement de grandes quantités de protéines thérapeutiques dans les cellules de plantes non transgéniques grâce à l’expression transitoire. Cette nouvelle approche [
10] permet une très grande souplesse de production et une très grande réactivité en cas de pandémie. À titre d’exemple, une combinaison de technologies développées dans l’UMR CNRS 6037 et la compagnie canadienne Medicago Inc a permis d’obtenir des rendements de l’ordre de 1 500 doses d’un vaccin contre la grippe aviaire ou de 1 g d’un anticorps humanisé par kg de feuilles de tabac, et cela seulement six jours après l’infiltration sous vide des plantes de tabac par des agrobactéries transgéniques [
11,
12]. |
Conclusions et perspectives Le criblage systématique de familles de substances chimiques provenant d’extraits végétaux a permis d’isoler de nombreuses molécules thérapeutiques utilisées aujourd’hui en médecine humaine. La production de ces molécules naturelles est toutefois fonction de la disponibilité des plantes productrices et dépend donc étroitement de facteurs politiques, climatiques et socio-économiques difficilement maîtrisables. La menace de pénurie a stimulé un grand nombre d’équipes de chimistes qui ont synthétisé ces molécules ou leurs homologues. L’utilisation de PGM a permis plus récemment d’utiliser les plantes pour la production de molécules complexes, difficiles à isoler ou encore impossibles à synthétiser comme les anticorps. Dans ce domaine, les atouts des PGM sont nombreux, en effet, ils permettent la production d’un vaccin recombinant ou d’un anticorps humanisé en grande quantité, pour un coût réduit et, grâce à l’expression transitoire, seulement en quelques jours après le transfert d’un gène dans une plante sauvage. Dans un proche avenir, la transformation génétique va également permettre de produire par ingénierie métabolique des cellules végétales « reprogrammées » pour la production en fermenteurs, dans des conditions optimisées et parfaitement contrôlées, de molécules naturelles comme le taxol, l’oseltamivir ou l’artémisinine. Ainsi, alors qu’elles soignaient déjà l’homme de Néandertal, les plantes sont toujours au cœur de la pharmacopée humaine à l’ère des nanotechnologies. |
1. Krzaczkowski L, Wright M, Gairin JE. Les Bryophytes, source potentielle de médicaments de demain ? Med Sci (Paris) 2008; 24 : 947–53. 2. Gomord V, Sourrouille C, Fitchette AC, et al. Production and glycosylation of plant-made pharmaceuticals: the antibodies as a challenge. Plant Biotechnol J 2004; 2 : 83–100. 3. Saint-Jore-Dupas C, Faye L, Gomord V. From planta to pharma with glycosylation in the toolbox. Trends Biotechnol 2007; 25 : 317–23. 4. Haq TA, Mason HS, Clements JD, Arntzen CJ. Oral immunization with a recombinant bacterial antigen produced in transgenic plants. Science 1995; 268 : 714–6. 5. Liénard D, Sourrouille C, Gomord V, Faye L. Pharming and transgenic plants. Biotechnol Annu Rev 2007; 13 : 115–47. 6. Lienard D, Tran Dinh O, van Oort E, et al. Suspension-cultured BY-2 tobacco cells produce and mature immunologically active house dust mite allergens. Plant Biotechnol J 2007; 5 : 93–108. 7. Grevich J, Daniell H. Chloroplast genetic engineering: Recent advances and perspectives. Crit Rev Plant Sci 2005; 24 : 1–25. 8. Terrier B, Courtois D, Hénault N, et al. Two new disposable bioreactors for plant cell culture: the wave and undertow bioreactor and the slug bubble bioreactor. Biotechnol Bioeng 2007; 96 : 914–23. 9. Shaaltiel Y, Bartfeld D, Hashmueli S, et al. Production of glucocerebrosidase with terminal mannose glycans for enzyme replacement therapy of Gaucher’s disease using a plant cell system. Plant Biotechnol J 2007; 5 : 579–90. 10. Giritch A, Marillonnet S, Engler C, et al. Rapid high-yield expression of full-size IgG antibodies in plants coinfected with noncompeting viral vectors. Proc Natl Acad Sci USA 2006; 103 : 14701–6. 11. D’Aoust MA, Lavoie PL, Couture M, et al. Influenza VLPs produced by transient expression in Nicotiana benthamiana induce a strong immune response in mice. Plant Biotechnol J 2008 (sous presse). 10. Gomord V, D’Aoust MA, Faye L, et al.
Transient co-expression for fast and high yield production of antibodies with human-like N-glycans in plants. Biotechnology Havana 2008 : AgBiotechnology: facing huge challenges with new approaches. Havana, Cuba, 30 novembre-5 décembre 2008. |