| |
| Med Sci (Paris). 2008 November; 24(11): 925–927. Published online 2008 November 15. doi: 10.1051/medsci/20082411925.Différenciation des lymphocytes TH17 Des souris et des hommes Vassili Soumelis* and Elisabetta Volpe Institut Curie et Inserm U653, Département d’Immunologie, 26, rue d’Ulm, 75005 Paris, France MeSH keywords: Animaux, Antigènes CD38, Différenciation cellulaire, Humains, Interleukine-23, Interleukine-6, Lymphocytes, Souris, Lymphocytes T auxiliaires, Facteur de croissance transformant bêta |
C’est à la fin des années 1980 qu’il a été montré que les lymphocytes T CD4 auxiliaires ou helper (TH) étaient hétérogènes quant à leur capacité à produire des cytokines effectrices. Des clones nommés TH1 (T helper 1) produisaient préférentiellement de l’Interféron (IFN)-γ et d’autres clones nommés TH2 produisaient de l’Interleukine (IL)-4. Ce paradigme s’est confirmé dans des modèles in vitro utilisant des lymphocytes T naïfs primaires ainsi qu’in vivo aussi bien chez l’homme que chez la souris. Cette hétérogénéité des profils cytokiniques est associée à une dichotomie fonctionnelle. Les lymphocytes TH1 sont particulièrement importants pour produire des réponses cytotoxiques dans le cadre d’infections à germes intracellulaires, tels que Toxoplasma gondii, Leishmania major, Listeria monocytogenes ou Mycobacterium tuberculosis, alors que les lymphocytes TH2 induisent préférentiellement une réponse humorale importante dans les infections à germes extracellulaires, comme les helminthes [
1]. Lorsque ces réponses T sont exagérées ou non contrôlées, elles peuvent être associées à certaines pathologies, notamment les maladies auto-immunes pour les réponses TH1 et les maladies allergiques pour les réponses TH2 [1]. Bien que l’IFN-γ et l’IL-4 caractérisent toujours aujourd’hui la signature d’un profil TH1 et TH2, respectivement, un nombre croissant de cytokines potentiellement produites par les lymphocytes T a été identifié au cours des dernières années et a accru la complexité des profils cytokiniques T CD4. Le TNF-α et l’IL-10, par exemple, peuvent être produites aussi bien lors de réponses TH1 que TH2 et définissent respectivement un profil « inflammatoire » et un profil « régulateur » [
2,
3]. |
L’identification des lymphocytes produisant de l’interleukine 17 ou TH17 En 2005 une étape majeure dans la caractérisation et la compréhension de cette complexité a été l’identification des lymphocytes TH17 capables de produire de l’IL-17 et dont les caractéristiques les distinguent des lymphocytes TH1 et TH2 [
4]. Il a été montré que les lymphocytes TH17 produisent de l’IL-17A et IL-17F ainsi que d’autres cytokines qui sont plus ou moins spécifiques de cette sous-population, incluant l’IL-21, l’IL-22, l’IL-26, le TNF-α et l’IL-10 [1,
5–
7]. L’IL-17 a pour cible essentielle les cellules épithéliales dans lesquelles elle induit la production de facteurs de croissance (G-CSF [granulocyte colony-stimulating factor] et stem cell factor), de chimiokines (CXCL1, CXCL2, CXCL5 et CXCL8) et de mucines au niveau des cellules épithéliales bronchiques. Dans certains modèles, l’IL-17A induit aussi la production de β-défensines et de CCL20 [1]. Les lymphocytes TH17 participent ainsi au niveau des épithéliums à la défense contre les bactéries extracellulaires, notamment Klebsiella pneumoniae [1]. Cependant, les réponses TH17 sont aussi associées à des maladies auto-immunes, dont la sclérose en plaques, le psoriasis et la maladie de Crohn [1,
17]. |
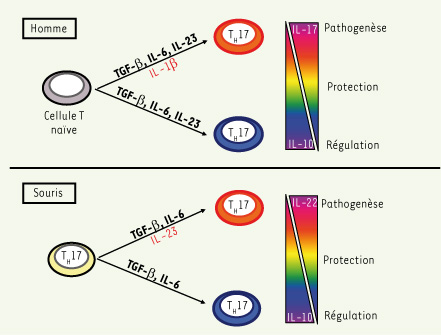
Contrôle de la différenciation des lymphocytes TH17 Un élément de controverse des dernières années a concerné les facteurs essentiels à la différenciation des lymphocytes TH17 à partir de lymphocytes CD4 naïfs. Chez la souris, plusieurs études ont confirmé que le TGF-β et l’IL-6 étaient nécessaires et suffisants à ce processus de différenciation [
8]. L’IL-21 est produite de façon autocrine au cours de la différenciation TH17 et joue également un rôle essentiel [8]. D’autres cytokines, IL-1β et TNF-α, peuvent augmenter la différenciation mais ne sont pas nécessaires [
9]. L’IL-23, cytokine de la famille de l’IL-12, n’influence pas la différenciation TH17 murine mais agit sur les lymphocytes TH17 différenciés – qui acquièrent l’expression du récepteur de l’IL-23 – en augmentant fortement leur expansion in vitro [9] et in vivo [
10]. Ce processus de différenciation TH17 apparaît donc plus complexe que celui qui gouverne la production des lymphocytes TH1 et TH2, respectivement dépendant de l’IL-12 et de l’IL-4 ; surtout un rôle central du TGF-β émerge. En effet, dans ces études murines, seul, le TGF-β est essentiel à la différenciation des lymphocytes T régulateurs (Treg), mais, lorsqu’il est associé à l’IL-6, il va orienter la différenciation vers la voie TH17 [8]. Les premiers travaux de différenciation TH17 chez l’homme [
6,
11] ont révélé des résultats surprenants en contradiction avec les données murines. Dans une étude, l’IL-1β était le facteur nécessaire et suffisant pour induire la différenciation TH17 alors que dans une autre, c’est l’IL-1 mais également l’IL-23, qui jouaient un rôle prédominant [6, 11]. Dans ces deux études, le TGF-β avait un effet inhibiteur sur la différenciation TH17 ce qui suggérait une différence majeure dans l’immuno-régulation chez l’homme comparée à celle décrite dans le système murin. Ces résultats n’ont cependant pas été reproduits par des études publiées très peu de temps après et montrant notamment que l’IL-1β était suffisante pour faire produire de l’IL-17 aux lymphocytes T CD4 mémoires, mais insuffisante pour générer une différenciation TH17 à partir de lymphocytes T naïfs [
12]. Récemment, 3 publications indépendantes, dont une de notre équipe, semblent aboutir à un consensus sur les facteurs nécessaires à la différenciation TH17 chez l’homme et montrent toutes un effet positif du TGF-β (Figure 1). Dans une première étude, les cytokines importantes pour la différenciation TH17 étaient le TGF-β, l’IL-6 mais également l’IL-23 [
13]. Par ailleurs, le facteur de transcription ROR-γt était nécessaire à la différenciation TH17, comme cela avait été montré par la même équipe chez la souris [13]. Cette étude a eu le mérite d’utiliser exclusivement des lymphocytes T naïfs purifiés à partir de sang de cordon ombilical pour l’ensemble des expériences, ce qui garantit leur caractère naïf. Dans une deuxième étude, nous avons montré que le TGF-β et l’IL-23 étaient deux cytokines essentielles à la différenciation TH17 chez l’homme, en association avec l’IL-1β et l’IL-6 qui jouaient un rôle similaire [7]. Nous avons aussi montré que chacune des cytokines inductrices de la différenciation TH17 avait un impact très différent sur le profil cytokinique TH17 global [7]. Par exemple, l’IL-1β favorise la production d’IL-17 mais inhibe la production d’IL-10, contrôlant donc l’équilibre entre ces deux cytokines (Figure 1). Nous proposons un modèle où son absence serait associée à un profil TH17 « régulateur », sa présence favorisant un profil « inflammatoire » (potentiellement pathogène) (Figure 1). Ce rôle pourrait être joué chez la souris par l’IL-23, qui inhibe la production d’IL-10 au profit de l’IL-22 [5] (Figure 1). Enfin, une troisième étude s’est concentrée sur le rôle de l’IL-21 et du TGF-β dans la différenciation TH17 et a montré que chez l’homme, ces deux cytokines sont essentielles au même titre que chez la souris [
14].
 | Figure 1.
Modèle de régulation des réponses TH17.
|
|
Un consensus récent sur le contrôle de la différenciation TH17 chez l’homme ? Il ressort de ces trois études que : (1) le TGF-β joue un rôle essentiel dans la différenciation TH17 chez l’homme comme chez la souris ; (2) l’IL-23 joue un rôle important dans la différenciation TH17 chez l’homme contrairement aux études menées chez la souris, différence pouvant avoir des conséquences physiopathologiques importantes ; (3) les cytokines inflammatoires IL-6 et IL-1β contribuent à la différenciation TH17 chez la souris et chez l’homme ; (4) l’IL-21 autocrine semble aussi importante chez l’homme que chez la souris ; (5) le facteur de transcription ROR-γt est une des molécules essentielles à la transcription du gène de l’IL-17, bien que les études chez la souris suggèrent que la régulation transcriptionnelle de la différenciation TH17 est beaucoup plus complexe et requière probablement plusieurs facteurs de transcription agissant de façon coordonnée [
15]. Ces résultats sont fondamentaux pour la compréhension des mécanismes physiopathologiques de certaines maladies, notamment auto-immunes, ainsi que pour guider le développement de certaines thérapeutiques qui pourraient cibler la voie TH17. Ils soulignent aussi la difficulté de travailler sur la différenciation T auxiliaire chez l’homme où la définition du caractère naïf des lymphocytes T CD4 repose sur des critères phénotypiques (expression de CD4, CD3, et CD45RA) qui peuvent être pris en défaut. Il apparaît essentiel de vérifier au minimum les résultats majeurs de chaque étude en utilisant des lymphocytes naïfs purifiés du sang de cordon et/ou de disposer d’une technique de purification garantissant non seulement un phénotype CD3+CD4+CD45RA+ mais également l’absence de toute cellule exprimant le CD45RO. En effet, certains lymphocytes mémoires peuvent coexprimer CD45RA et CD45RO [
16]. Les caractéristiques essentielles de la différenciation TH17 chez l’homme étant aujourd’hui plus clairement définies, il sera très important d’identifier des facteurs d’inhibition ou d’augmentation des réponses TH17, de préciser les mécanismes moléculaires de la différenciation et notamment l’implication de certains facteurs de transcription, et de tester sur ces modèles humains certaines approches pharmacologiques avant de les développer éventuellement en pathologie. |
1. Ouyang W, Kolls, JK, Zheng Y. The biological functions of T helper 17 cell effector cytokines in inflammation. Immunity 2008; 28 : 454–67. 2. Ito T, Wang YH, Duramad O, et al. TSLP-activated dendritic cells induce an inflammatory T helper type 2 cell response through OX40 ligand. J Exp Med 2005; 202 : 1213–23. 3. Trinchieri G. Interleukin-10 production by effector T cells : Th1 cells show self control. J Exp Med 2007; 204 : 239–43. 4. Harrington LE, Hatton RD, Mangan PR, et al. Interleukin 17-producing CD4+ effector T cells develop via a lineage distinct from the T helper type 1 and 2 lineages. Nat Immunol 2005; 6 : 1123–32. 5. McGeachy MJ, Bak-Jensen KS, Chen Y, et al. TGF-beta and IL-6 drive the production of IL-17 and IL-10 by T cells and restrain T(H)-17 cell-mediated pathology. Nat Immunol 2007; 8 : 1390–7. 6. Wilson NJ, Boniface K, Chan JR, et al. Development, cytokine profile and function of human interleukin 17-producing helper T cells. Nat Immunol 2007; 8 : 950–7. 7. Volpe E, Servant N, Zollinger R, et al. A critical function for transforming growth factor-beta, interleukin 23 and proinflammatory cytokines in driving and modulating human T(H)-17 responses. Nat Immunol 2008; 9 : 650–7. 8. Bettelli E, Korn T, Oukka M, Kuchroo VK. Induction and effector functions of T(H)17 cells. Nature 2008; 453 : 1051–7. 9. Veldhoen M, Hocking RJ, Atkins CJ, et al. TGFbeta in the context of an inflammatory cytokine milieu supports de novo differentiation of IL-17-producing T cells. Immunity 2006; 24 : 179–89. 10. Veldhoen M, Hocking RJ, Flavell RA, Stockinger B. Signals mediated by transforming growth factor-beta initiate autoimmune encephalomyelitis, but chronic inflammation is needed to sustain disease. Nat Immunol 2006; 7 : 1151–6. 11. Acosta-Rodriguez EV, Napolitani G, Lanzavecchia A, Sallusto F. Interleukins 1beta and 6 but not transforming growth factor-beta are essential for the differentiation of interleukin 17-producing human T helper cells. Nat Immunol 2007; 8: 942–9. 12. Van Beelen AJ, Zelinkova Z, Taanman-Kueter EW, et al. Stimulation of the intracellular bacterial sensor NOD2 programs dendritic cells to promote interleukin-17 production in human memory T cells. Immunity 2007; 27 : 660–9. 13. Manel N, Unutmaz D, Littman DR. The differentiation of human T(H)-17 cells requires transforming growth factor-beta and induction of the nuclear receptor RORgammat. Nat Immunol 2008; 9 : 641–9. 14. Yang L, Anderson DE, Baecher-Allan C, et al. IL-21 and TGF-beta are required for differentiation of human T(H)17 cells. Nature 2008; 454 : 350–2. 15. Sundrud MS. Rao A. Regulation of T helper 17 differentiation by orphan nuclear receptors : it’s not just ROR gamma t anymore. Immunity 2008; 28 : 5–7. 16. Sallusto F, Geginat J, Lanzavecchia A. Central memory and effector memory T cell subsets : function, generation, and maintenance. Annu Rev Immunol 2004; 22 : 745–63. 17. Peyrin-Biroulet L, Parmentier-Decrucq E, Branche J, Desreumaux P. L’IL-23R, un nouveau gène de susceptibilité dans les maladies inflammatoires chroniques intestinales. Med Sci (Paris) 2007; 23 : 250–2. |