| |
| Med Sci (Paris). 2008 November; 24(11): 923–924. Published online 2008 November 15. doi: 10.1051/medsci/20082411923.CALHM1, nouvel acteur du processus physiopathologique de la maladie d’Alzheimer Jean-Charles Lambert,1* Fabien Campagne,2* and Philippe Marambaud3* 1Inserm, U744, Institut Pasteur de Lille, Université de Lille II, 59000 Lille, France 2HRH Prince Alwaleed Bin Talal Bin Abdulaziz Alsaud, Institute for Computational Biomedicine and Department of Physiology and Biophysics, Weill Medical College of Cornell University, New York, NY, États-Unis 3Litwin-Zucker Research Center for the Study of Alzheimer Disease, The Feinstein Institute for Medical Research, Manhasset, NY, États-Unis MeSH keywords: Maladie d'Alzheimer, Substitution d'acide aminé, Apolipoprotéine E4, Calcium, Canaux calciques, Perméabilité de la membrane cellulaire, Humains, Glycoprotéines membranaires, Modèles neurologiques, Polymorphisme génétique |
La maladie d’Alzheimer est un syndrome multifactoriel [
1] caractérisé au niveau histologique par la présence immuable de dégénérescences neurofibrillaires et de plaques séniles. L’étude génétique des formes familiales monogéniques a permis une meilleure compréhension de l’étiologie de la maladie, et ceci à travers l’identification de mutations dans des gènes impliqués dans les voies moléculaires associées à la formation des plaques séniles. Ces plaques sont formées à partir de l’agrégation d’un peptide de 40 à 42 résidus, appelé le peptide amyloïde ou Aβ. Ce peptide est issu de l’endoprotéolyse d’un précurseur protéique appelé APP (amyloid precursor protein), par l’action des enzymes β-sécrétase et γ-sécrétase. Des mutations dans les composants catalytiques de la γ-sécrétase – les présénilines 1 et 2 – et dans l’APP, ont été identifiées comme responsables de l’apparition de l’essentiel des formes monogéniques de la maladie [
2,
3]. Toutes ont pour conséquence de modifier le métabolisme de l’APP en faveur de la production des peptides Aβ et ces observations représentent encore les fondements de l’hypothèse de la cascade amyloïde [
4]. Comme toute théorie, cette hypothèse a été contestée. Une des critiques principales s’attarde sur le fait que ces formes familiales dues à des mutations des présénilines et de l’APP représentent moins de 1 % des cas et dès lors, ne seraient pas représentatives de l’ensemble des formes sporadiques de la maladie. D’autres hypothèses ont alors été proposées dont certaines suggérant que l’étiologie de la maladie d’Alzheimer trouve également sa source dans une dérégulation des voies de signalisation par le calcium intracellulaire [
5]. Cette hypothèse a suscité beaucoup d’intérêt car la signalisation calcique est un événement déterminant dans la mise en place des mécanismes transcriptionnels associés à la formation et à la persistance de la mémoire [
6]. |
Recherche de gènes candidats pour la maladie d’Alzheimer Le seul facteur de risque reconnu à ce jour pour les formes sporadiques de la maladie d’Alzheimer est la présence de l’allèle e4 du gène de l’APOE (apolipoprotéine E). Une dizaine de régions chromosomiques ont été identifiées comme contenant un ou plusieurs gènes de susceptibilité à des formes sporadiques de la maladie d’Alzheimer. Plusieurs centaines de gènes dans ces régions ont été proposés comme facteurs de susceptibilité mais sans succès [2]. Nous avons alors postulé que des gènes localisés dans des régions chromosomiques d’intérêt et exprimés dans des régions cérébrales particulièrement affectées par les processus neurodégénératifs, étaient des gènes candidats pour la maladie d’Alzheimer. En effet, un certain nombre de désordres dus à une dégénérescence neuronale résultent de mutations dans des gènes principalement exprimés dans le système nerveux central, comme cela a pu être décrit pour la maladie de Parkinson ou les démences fronto-temporales [
7,
8]. Dans la maladie d’Alzheimer, la première atrophie cérébrale observée se produit dans le lobe temporal médian, qui inclut l’hippocampe. Étant donné le rôle prépondérant de l’hippocampe dans la consolidation de la mémoire, nous avons choisi de sélectionner des gènes candidats exprimés dans l’hippocampe humain. Pour ce faire, nous avons utilisé les informations disponibles dans les bases de données dbEST et TissueInfo [
9]. Nous avons ainsi identifié une liste de plusieurs gènes exprimés faiblement dans l’hippocampe. Parmi les douze gènes identifiés, deux d’entre eux se sont avéré être localisés dans des régions chromosomiques associées aux formes tardives de la maladie d’Alzheimer. Nous avons décidé de concentrer nos efforts sur un gène de fonction alors inconnue. Ce gène appelé FAM26C est localisé sur le chromosome 10 (Figure 1), l’une des régions chromosomique d’intérêt les mieux caractérisées [
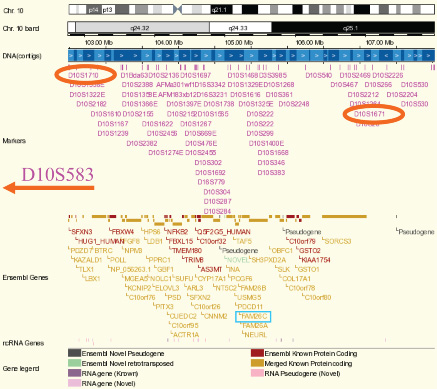
10].
 | Figure 1.
Région chromosomique située entre les marqueurs D10S1710 et D10S566. Cette région précédemment identifiée [ 10] contient un nombre important de gènes. L’approche bioinformatique utilisée a permis de réduire considérablement l’effort de génotypage des gènes candidats. |
|
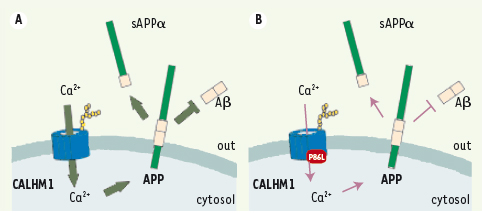
CALHM1, un nouveau canal calcique impliqué dans le métabolisme de l’APP Nous avons déterminé que FAM26C code pour une glycoprotéine transmembranaire principalement exprimée dans le cerveau adulte, et impliquée dans la régulation des concentrations intracellulaires de calcium. Nous avons donc appelé cette protéine CALHM1 pour calcium homeostasis modulator 1. Cette protéine présente, au sein de sa séquence peptidique, un motif similaire au filtre de sélectivité ionique du récepteur au NMDA. Un résidu asparagine localisé dans ce motif est d’ailleurs essentiel au contrôle des concentrations calciques par CALHM1. De plus, des expériences de co-immunoprécipitation ont indiqué que CALHM1 est capable de former des structures tétramériques, une propriété partagée par beaucoup de canaux ioniques pour former un pore fonctionnel. Enfin, le rôle potentiel de CALHM1 dans la perméabilité aux ions calcium a été directement étudié par des approches d’électrophysiologie. Ces approches ont démontré que l’expression de CALHM1 génère, à la surface cellulaire, un courant cationique sélectif aux ions calcium. Nous avons enfin montré que CALHM1 était directement impliquée dans le métabolisme de l’APP. Nous avons déterminé par des études de gain de fonction (par transfection transitoire) ou de perte de fonction (par interférence ARN) appliquées à des modèles cellulaires, que CALHM1 est un répresseur important de la production des peptides Aβ (Figure 2).
 | Figure 2.
Le polymorphisme P86L de CALHM1 réduit sa perméabilité au calcium et son contrôle du métabolisme de l’APP. A. CALHM1 sauvage. B. CALHM1 mutée à la position 86. |
|
CALHM1, un nouveau déterminant génétique de la Maladie d’Alzheimer Finalement, après séquençage du gène CALHM1, nous avons pu détecter un polymorphisme non synonyme au codon 86 correspondant au changement d’une proline (allèle P) en leucine (allèle L). Nous avons pu alors montrer, en étudiant 2 043 patients atteints de maladie d’Alzheimer et 1 361 individus indemnes de démences, que l’allèle L était associé à une augmentation de l’ordre de 44 % du risque de développer la pathologie. De façon remarquable, cet allèle L provoque une perte significative du contrôle de CALHM1 sur l’homéostasie du calcium avec pour conséquence une augmentation de la production des peptides Aβ. |
À travers une étude multidisciplinaire et multi-institutionnelle, nous avons mis en évidence une nouvelle famille de canaux ioniques cérébraux dont certains variants pourraient constituer des facteurs de susceptibilité génétique de la maladie d’Alzheimer [
11]. |
1. Helmer C, Pasquier F, Dartigues JF. Épidémiologie de la maladie d’Alzheimer et des syndromes apparentés. Med Sci (Paris) 2006; 22 : 288–96. 2. Lambert JC, Amouyel P. Genetic heterogeneity of Alzheimer’s disease : complexity and advances. Psychoneuroendocrinology 2007; 32 : S62–70. 3. Campion D, Hannequin D. La duplication du gène APP, cause de maladie d’Alzheimer associée à une importante angiopathie amyloïde. Med Sci
(Paris) 2006; 22 : 468–9. 4. Hardy J, Selkoe DJ. The amyloid hypothesis of Alzheimer’s disease : progress and problems on the road to therapeutics. Science 2002; 297 : 353–6. 5. LaFerla FM. Calcium dyshomeostasis and intracellular signalling in Alzheimer’s disease. Nat Rev Neurosci 2002; 3 : 862–72. 6. Thomas GM, Huganir RL. MAPK cascade signalling and synaptic plasticity. Nat Rev Neurosci 2004; 5 : 173–83. 7. Goedert M, Spillantini MG. Tau mutations in frontotemporal dementia FTDP-17 and their relevance for Alzheimer’s disease. Biochim Biophys Acta 2000; 1502 : 110–21. 8. Lee VM., Trojanowski JQ. Mechanisms of Parkinson’s disease linked to pathological alpha-synuclein : new targets for drug discovery. Neuron 2006; 52 : 33–8. 9. Skrabanek L, Campagne F. TissueInfo : high-throughput identification of tissue expression profiles and specificity. Nucleic Acids Res 2001; 29 : E101–2.0 10. Myers A, Holmans P, Marshall H, et al. Susceptibility locus for Alzheimer’s disease on chromosome 10. Science 2000; 290 : 2304–5. 11. Dreses-Werringloer U, Lambert JC, Vingtdeux V, et al. A polymorphism in CALHM1 influences Ca2+ homeostasis, Abeta levels, and Alzheimer’s disease risk. Cell 2008; 133 : 1149–61. |