| |
| Med Sci (Paris). 2008 November; 24(11): 897–899. Published online 2008 November 15. doi: 10.1051/medsci/20082411897.Le récepteur de la ryanodine de type I Un canal sous surveillance redox… Joël Lunardi,* Julien Fauré, Isabelle Marty, and Nicole Monnier Inserm U836, Institut des Neurosciences, Équipe Muscle et Pathologies, BP 170, 38042 Grenoble Cedex, France MeSH keywords: Animaux, Membrane cellulaire, Variation génétique, Humains, Souris, Mutation, Myofibrilles, Oxydoréduction, Phénotype, Canal de libération du calcium du récepteur à la ryanodine, Réticulum sarcoplasmique |
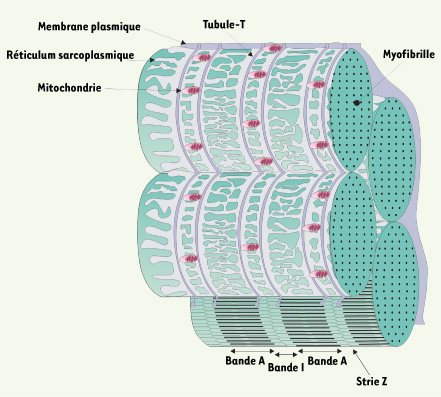
La contraction du muscle squelettique est causée par une brusque augmentation du Ca2+ myoplasmique résultant de la vidange du réticulum sarcoplasmique (RS). Elle est déclenchée par une dépolarisation membranaire causée par l’excitation nerveuse de la fibre musculaire. La dépolarisation se propage jusqu’à des invaginations de la membrane plasmique, les tubules transverses (TT) (Figure 1). À ce niveau, la première étape du couplage excitation-contraction (CEC) est l’activation du récepteur des dihydropyridines (DHPR), un canal calcique de la membrane des TT sensible au voltage. La sortie du Ca2+ du RS, nécessaire à l’étape suivante d’activation des unités contractiles, se fait grâce à un canal calcique exprimé au niveau de la membrane du RS, le récepteur de la ryanodine de type I (RYR1). Elle est déclenchée par une interaction mécanique directe entre le DHPR activé et RYR1.
 | Figure 1.
Structure d’une fibre musculaire.
|
|
RYR1 : un complexe macromoléculaire Le relâchement de Ca2+ du RS est réalisé par un homo-tétramère de sous-unités RYR1 (≈ 565 kDa par sous-unité) auquel sont associées de nombreuses protéines régulatrices (FKBP12, calmoduline, triadine, junctine, calséquestrine…). Chaque sous-unité RYR1 est formée d’une partie transmembranaire carboxy-terminale contenant le pore, et d’une large partie amino-terminale cytoplasmique impliquée dans la régulation de l’activité du canal. L’éventail des effecteurs endogènes de RYR1 s’étend d’ions et de petites molécules (Ca2+, Mg2+, adénine-nucléotides) à des polypeptides (calmoduline, FKBP12…) [
1]. |
RYR1 est une cible pour les espèces oxygénées réactives (ROS, reactive oxygen species) et les espèces azotées réactives (RNS, reactive nitrogen species) produites lors de l’activité physique physiologique. RYR1 contient un total de 100 résidus cystéinyls, la moitié se trouvant à l’état réduit dans le muscle au repos et 6-10 d’entre eux étant plus particulièrement réactifs. L’activation du canal RYR1 serait modulée par des modifications redox de ces thiols par oxydation, S-nitrosylation ou alkylation. Chaque sous-unité compte entre 38 et 48 thiols à l’état libre, sensibles à l’oxydation. L’état d’activation de RYR1 répond de manière biphasique à l’administration de doses croissantes d’oxydants, le maximum d’activation se situant pour un état impliquant 23 SH/RYR1 [
2]. L’oxyde nitrique NO est également considéré comme un modulateur physiologique de l’état redox de RYR1 par S-nitrosylation [
3]. Par ailleurs, l’état redox et l’activité de RYR1 seraient aussi contrôlés par la pression partielle en O2 [
4]. |
Un catalogue de mutations aux conséquences fonctionnelles variées Plus de 200 mutations du gène RYR1 responsables de pathologies ont été identifiées [
5]. L’hyperthermie maligne per anesthésique (HM) est une maladie pharmacogénétique dominante déclenchée par une exposition aux anesthésiques halogénés. La crise d’HM se caractérise principalement par une contracture musculaire généralisée, un emballement métabolique avec hypercapnie et une élévation très importante de la température centrale. En l’absence de traitement par un inhibiteur de RYR1, le dantrolène, l’issue de la crise est le plus souvent fatale. Les mutations HM sont principalement trouvées dans 2 domaines, MH1 et MH2, localisés dans les parties amino-terminale et centrale de RYR1. Un second groupe de maladies associées à des mutations de RYR1 sont les myopathies congénitales à cores. Il s’agit d’une famille de myopathies de sévérité variable, à transmission dominante ou récessive et caractérisées par la présence d’altérations morphologiques des fibres musculaires, les cores. Les cores sont des régions de désorganisation sarcomérique au sein desquelles on ne trouve plus de mitochondries. Le nombre de cores, leur taille et leur localisation dans la fibre musculaire peuvent varier et cette hétérogénéité a suscité l’établissement d’une nosologie histologique de ces myopathies: central core disease (CCD), multiminicore disease (MmD)… Les mutations des formes dominantes de ces myopathies sont surtout concentrées dans la partie carboxy-terminale du canal, celles des formes récessives sont retrouvées tout au long du gène. Les études fonctionnelles des différentes mutations du gène RYR1 ont montré que certaines mutations conduisent à un canal RYR1 « fuyant » entraînant une élévation du Ca2+ cytoplasmique au repos, et d’autres aboutissent à une perte du couplage fonctionnel entre le DHPR et RYR1 ; un petit nombre enfin affecte la quantité de molécules RYR1 présentes dans le RS. Divergence phénotypique souris/homme pour la mutation p.Y522S de RYR1 L’équipe de Susan Hamilton a récemment créé un modèle murin knock-in pour la mutation p.Y522S de RYR1 [
6]. Cette mutation avait été initialement identifiée dans une famille française atteinte d’HM chez laquelle les sujets porteurs de la mutation, susceptibles à l’HM, ne présentaient aucun symptôme hormis la présence de quelques « cores » dans les muscles de 2 des 3 patients HM [
7]. La souris hétérozygote p.Y522S présente une sensibilité accrue à la caféine et à l’halothane avec un relâchement excessif du Ca 2+ du RS, en accord avec le phénotype « hyperthermie maligne » observé chez l’homme. À la différence de la pathologie humaine, aucun core n’a cependant été caractérisé et des altérations des mitochondries ont été observées dans les muscles de ces souris. Une autre différence importante observée chez l’animal est le développement de contractures généralisées et l’abaissement de la force musculaire en réponse à une augmentation de la température ambiante. De manière surprenante, les souris homozygotes pour la mutation sont caractérisées par une létalité embryonnaire ou néo-natale et une dysmorphie musculaire importante. Ceci n’a jamais été observé chez les patients homozygotes pour des mutations du gène RYR1 responsables de l’HM [
8]. Les auteurs suggèrent que chez cette souris, la présence à l’état hétérozygote de la mutation p.Y522S serait associée à une fuite de Ca 2+ du RS responsable d’une activation de la nNOS ( nitric oxide synthase) [
9]. Les RNS produits entraîneraient une S-nitrosylation de la Cys 3635 de RYR1 se traduisant par une augmentation de l’activation du canal muté à des températures supra-physiologiques. La fuite de Ca 2+ du RS causée par la mutation p.Y522S serait par ailleurs responsable d’un stress oxydatif chronique générateur d’altérations mitochondriales, elles-mêmes susceptibles d’amplifier le stress oxydatif et d’enclencher un cycle délétère stress-dommages (Figure 2). Il est cependant à noter qu’aucune altération significative des mitochondries n’a été observée dans les muscles des patients porteurs de la mutation p.Y522S, ni décrite dans les muscles de nombreux autres patients porteurs de mutations de type HM.
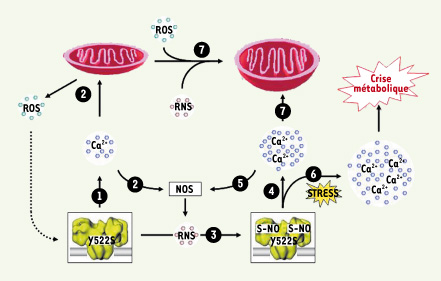
 | Figure 2.
Modèle de dysrégulation de l’homéostasie calcique par modification redox du récepteur de la ryanodine RYR1 porteur d’une mutation de type « canal fuyant ». 1. Le canal mutant s’ouvre plus facilement et entraîne une augmentation locale de la concentration en Ca2+ dans la fibre au repos. 2. Le niveau plus élevé de Ca2+ augmente la production de ROS/RNS via une action au niveau des mitochondries et des NO synthases (NOS). 3. Les ROS/RNS induisent la S-nitrosylation et S-glutathionylation de RYR1. 4. La S-nitrosylation augmente la sensibilité à la température de RYR1 et diminue sa sensibilité à l’inhibition par le Ca2+, ce qui augmente la sortie de Ca2. 5. La sortie de Ca2+ augmente la production de ROS/RNS. 6. La sortie de Ca2+ du canal mutant est fortement augmentée en réponse à un stress (thermique, oxydatif) et conduit à un emballement métabolique avec contraction des sarcomères et activation de systèmes protéolytiques. 7. Les niveaux élevés de ROS, RNS et Ca2+ peuvent être la cause de dommages mitochondriaux chroniques. |
|
Conclusions et perspectives Des travaux récents réalisés chez la souris et chez l’homme montrent qu’en réponse à un exercice physique intense, RYR1 serait le siège d’un important remodelage comportant d’une part une phosphorylation de la Ser 2843 dépendante de la PKA (protein kinase A) et une S-nitrosylation des Cys 3635 et 2327, et d’autre part une déplétion en FKBP12 [
10]. La fuite importante du Ca2+ du RS au travers de ces RYR1 « remodelés » pourrait être la cause de dommages musculaires via une activation de la calpaïne par le Ca2+ et être l’un des composants de la limitation à l’exercice des muscles squelettiques. Ces différentes données montrent que les modifications de l’état redox de RYR1 jouent un rôle important dans la modulation de son activité canal. Les différents événements impliqués dans le remodelage de RYR1 normal ou muté pourraient constituer des cibles thérapeutiques comme le suggère l’action du JTV519, une 1,4-benzothiazépine qui provoque la fixation de FKBP12 sur RYR1 et qui améliorerait la fonction musculaire squelettique dans un modèle d’infarctus post-myocardique chez le rongeur [10]. |
1. Lacampagne A, Fauconnier J, Richard S. Récepteur de la ryanodine et dysfocntionnement myocardique. Med Sci (Paris) 2007; 24 : 399–405. 2. Sun J, Xu L, Eu JP, et al. Classes of thiols that influence the activity of the skeletal muscle calcium release channel. J Biol Chem 2001; 276 : 15625–30. 3. Aghdasi, B, Reid MB, Hamilton SL. Nitric oxide protects the skeletal muscle Ca2+ release channel from oxidation induced activation. J Biol Chem 1997; 272 : 25462–7. 4. Eu JP, Sun J, Xu L, et al. The skeletal muscle calcium release channel: coupled O2 sensor and NO signaling functions. Cell 2000; 102 : 499–509. 5. Monnier N, Kozak-Ribbens G, Krivosic-Horber R, et al. Correlations between genotype and pharmacological, histological, functional and clinical phenotypes in malignant hyperthermia susceptibility. Hum Mutat 2005; 26 : 413–25. 6. Chelu MG, Goonasekera SA, Durham WJ, et al. Heat- and anesthesia-induced malignant hyperthermia in an RyR1 knock-in mouse. FASEB J 2006; 20 : 329–30. 7. Quane KA, Keating KE Healy JMS, et al. Mutation screening of the RYR1 gene in malignant hyperthermia: detection of a novel Tyr to Ser mutation in a pedigree with associated cores. Genomics 1994; 23 : 236–9. 8. Monnier N, Krivosic-Horber R, Payen JF, et al. Presence of two different genetic traits in malignant hyperthermia families. Anesthesiology 2002; 97 : 1067–74. 9. DurhamWJ, Aracena-Parks P, Long C, et al. RyR1 S-nitrosylation underlies environmental heat stroke and sudden death in Y522S RyR1 knockin mice. Cell 2008; 133 : 53–65. 10. Bellinger AE, Reiken S, Dura M, et al. Remodeling of ryanodine receptor complex causes leaky channels: a molecular mechanism for decreased exercise capacity. Proc Natl Acad Sci USA 2008; 105 : 2198–2202. |