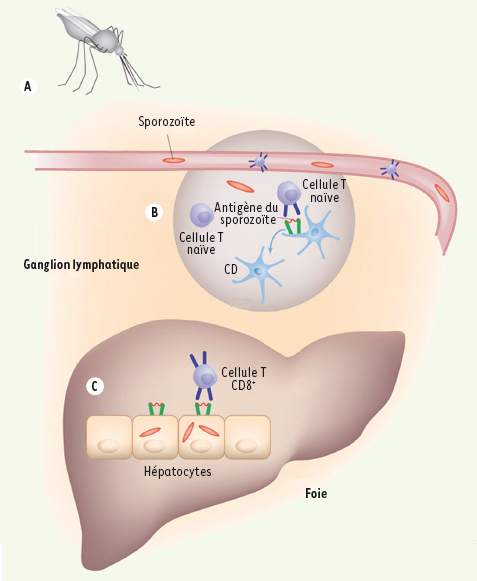
L’identification d’une stratégie de lutte efficace contre le paludisme constitue un des Graals de l’infectiologue en ce début de siècle. Une des pistes les plus étudiées à l’heure actuelle est celle d’un vaccin dirigé contre la forme sporozoïte du parasite qui est celle inoculée par le moustique avant de migrer vers le foie, où va se développer la forme sanguine responsable des signes cliniques. Les sporozoïtes intra-hépatiques sont la cible d’une réponse T cytotoxique CD8+ vigoureuse et efficace, sans que l’on sache jusqu’à présent comment ces lymphocytes sont primo-activés, si ils reconnaissent des antigènes parasitaires présentés par des hépatocytes infectés ou par des cellules dendritiques ayant phagocyté ces hépatocytes, ni comment la faible quantité de sporozoïtes inoculés par une anophèle (<20) peut induire une réponse aussi puissante. Dans une étude récemment publiée dans Nature Medicine [ 1], une équipe américaine vient de répondre de manière très élégante à ces trois questions. Les auteurs se sont appuyés sur un modèle murin de paludisme à Plasmodium yoelii dans lequel les animaux subissaient d’abord un transfert passif de cellules T CD8+ spécifiques de l’antigène immuno-dominant du sporozoïte avant d’être immunisés ou infectés. L’activation des cellules T spécifiques après immunisation survenait exclusivement dans le ganglion lymphatique de drainage cutané du site de la piqûre et conférait une réponse immunitaire protectrice. La résection de ce ganglion de drainage avant immunisation réduisait considérablement le nombre de cellules T spécifiques dans le foie ainsi que la réponse immunitaire protectrice. La résection de la rate ou d’autres ganglions, y compris les ganglions cœliaques de drainage hépatique n’altérait pas cette réponse. Seules les cellules dendritiques de ces ganglions de drainage étaient capables d’activer les cellules T CD8+ spécifiques. En utilisant des souris chimériques dont les cellules dendritiques présentatrices d’antigène possédaient un CMH-I différent de celui des hépatocytes, les auteurs ont enfin démontré que les cellules T activées reconnaissaient des antigènes de sporozoïte présentés par les cellules parenchymateuses (probablement hépatiques) et non par les cellules hématopoïétiques (probablement dendritiques). Ces données permettent de reconstituer le scénario suivant : après inoculation dermique au cours d’une piqûre de moustique, les sporozoïtes migreraient dans le ganglion lymphatique de drainage, où ils seraient présentés par des cellules dendritiques à des lymphocytes T CD8+ naïfs, permettant leur activation. Ces cellules activées migreraient alors dans la circulation et le foie où elles seraient alors capables de reconnaître des antigènes parasitaires présentés directement par l’hépatocyte, et non plus par une cellule présentatrice d’antigène professionnelle. Bien que la réponse immunologique induite ne soit pas complète, elle pourrait permettre de contenir l’infection parasitaire [ 2]. Ces données nouvelles vont certainement avoir des conséquences déterminantes sur la façon de concevoir la vaccination antipalustre. Elles constituent un argument supplémentaire pour une approche vaccinale fondée sur l’inoculation intradermique de parasites entiers ou tout du moins d’antigènes présentés à la fois sur le sporozoïte et sur le foie infecté.
| Figure 1.
Migration des sporozoïtes après inoculation. Les sporozoïtes du Plasmodium sont drainés du site d’inoculation sur la peau (A) vers les ganglions lymphatiques (B) pour induire la réponse cellulaire T dirigée contre l’hépatocyte infecté (C) par le parasite (d’après [2]). |