| |
| Med Sci (Paris). 2007 August; 23(8-9): 751–755. Published online 2007 August 15. doi: 10.1051/medsci/20072389751.Le GABA Un transmetteur pionnier pour la construction du cerveau Yehezkel Ben-Ari* INMED, Inserm U29, Parc Scientifique et Technologique de Luminy, 163, route de Luminy, 13273 Marseille Cedex 9, France |
Dans le système nerveux adulte, les réseaux de neurones connectés par quelque 1015 connexions synaptiques chez l’homme engendrent des patrons de décharge et des oscillations du signal électrique qui se traduisent en états (vigilance, sommeil) et en comportements. Cette genèse nécessite de mettre en avant certaines populations de neurones alors que d’autres sont en veille. Cela se fait par l’intermédiaire d’un équilibre entre l’activité des deux principaux transmetteurs : le glutamate et le GABA (acide γ-amino-butyrique) si l’on se limite aux récepteurs ionotropiques. Le premier excite les neurones par l’intermédiaire d’un récepteur perméable aux cations, essentiellement sodium, potassium et parfois aussi calcium. Le second a une action plus complexe mais qui aboutit souvent à une inhibition car son récepteur principal est perméable au chlore qui, suivant son gradient électrochimique, va entraîner une augmentation du potentiel de membrane et donc contribuer à empêcher la genèse de potentiels d’action. Les neurones qui libèrent le GABA – les interneurones GABAergiques - sont bien moins nombreux que les cellules glutamatergiques (de l’ordre de 10 % à 20 % des neurones) mais exercent un rôle crucial sur les activités du cerveau. Ainsi, les neurones GABAergiques synchronisent la décharge des réseaux et génèrent par ces mécanismes des oscillations essentielles notamment à l’apprentissage et, d’une façon générale, à l’intégration des informations. Un interneurone innerve des centaines de cellules principales et contrôle leur décharge, ce qui explique en partie pourquoi le blocage de l’inhibition cérébrale engendre des crises d’épilepsies et pourquoi plusieurs anti-convulsivants, somnifères, anxiolytiques et analgésiques sont aussi de puissants activateurs des récepteurs GABA. En résumé, le GABA exerce un rôle clé chez l’adulte dans la genèse d’activités cohérentes. Il y a une vingtaine d’années, nous avons découvert que contrairement à son action sur les neurones adultes, le GABA excite les neurones immatures centraux de rongeurs car ceux-ci ont une concentration très élevée de chlore intracellulaire [Cl-]i [
1]. Depuis, ces observations ont été confirmées dans toutes les espèces animales et les structures cérébrales étudiées [
2], suggérant que cette propriété a été préservée au cours de l’évolution. |
Dans la formation hippocampique de rongeurs, nous avons observé que le GABA, comme l’activation des synapses GABAergiques par des stimulations électriques, dépolarisent les neurones immatures [1,
3]. Cette dépolarisation peut aboutir à la genèse de potentiels d’actions sodiques et calciques. Ainsi chez le jeune, bloquer les récepteurs GABA réduit au silence l’activité électrique alors que cela engendre des crises épileptiques chez l’adulte. Comme l’ont montré depuis d’autres travaux utilisant des techniques d’enregistrements plus appropriées - comme le patch clamp perforé et l’enregistrement de canaux individuels GABA qui, pour le premier, ne perturbe pas la concentration intracellulaire de chlore ([Cl-]i) et, pour le second, n’affecte pas le milieu intracellulaire - la concentration intracellulaire de chlore est beaucoup plus élevée chez le jeune que chez l’adulte, passant de plus de 25-30 mM in utero à 6-7 mM [
4,
5]. Chez les jeunes, l’activation des récepteurs GABA va induire une sortie de chlore et une dépolarisation ayant de profonds effets sur la décharge neuronale. Ainsi, il a été montré par des techniques d’imagerie et d’enregistrements électriques, que la dépolarisation induite par le GABA est suffisante pour activer des canaux calciques, et même pour lever le blocage par les ions Mg++ des récepteurs NMDA (N-méthyl D-aspartate), entraînant ainsi une entrée massive de calcium et des effets sur la maturation cérébrale. La concentration intracellulaire de chlore, déterminant in fine les effets inhibiteurs ou excitateurs du GABA, est quant à elle contrôlée par l’expression de 2 co-transporteurs du chlore : NKCC1, qui importe du chlore, est plus présent pendant le développement tandis que le KCC2, qui l’exporte, s’exprime plus tardivement (Figure 1) [
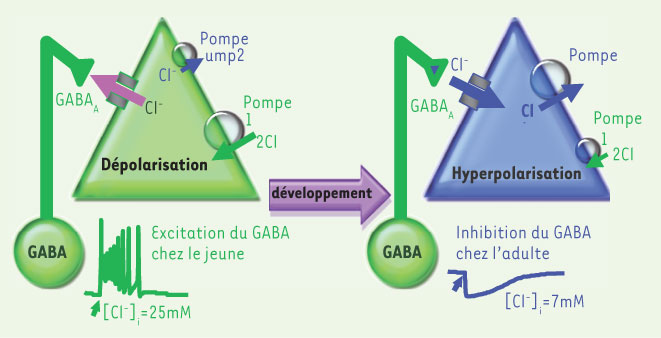
6]. 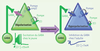 | Figure 1.
Régulation des concentrations de chlore intracellulaire [Cl-]i au cours du développement. Dans les neurones immatures, le co-transporteur qui importe le chlore est opérationnel alors que celui qui l’exporte ne l’est pas. En conséquence, [Cl -] i est plus élevé chez les jeunes et les flux de chlore lors de l’activation des récepteurs GABA seront différents. Le GABA va exciter les neurones jeunes et engendrer des potentiels d’action et au contraire produire une légère hyperpolarisation dans les neurones adultes [ 2]. |
Cette régulation développementale de [Cl-]i a pu être retrouvée dans toutes les espèces de mammifères étudiées jusqu’ici, y compris l’homme, où NKCC1 et KCC2 s’expriment successivement à une phase précoce et plus tardive. Pourquoi cette propriété a t-elle été préservée au cours de l’évolution ? On ne peut ici qu’émettre des hypothèses liées à l’implication du chlore dans la régulation de l’eau et du volume cellulaire, un processus hautement conservé dans la lignée des mammifères. |
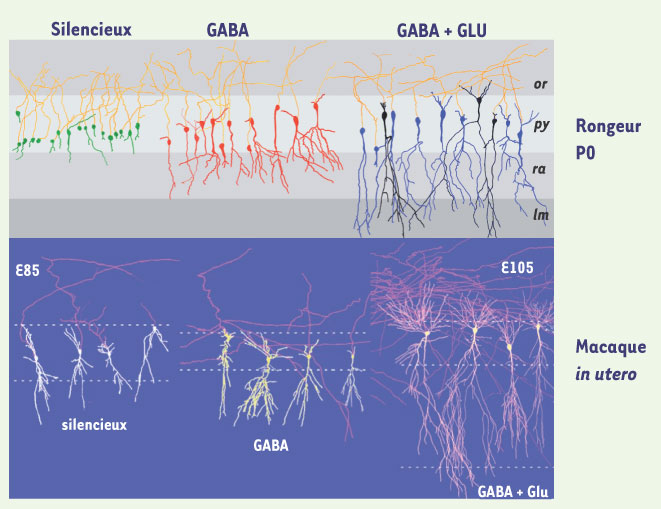
Implications et conséquences fonctionnelles La régulation développementale de [Cl-]i ne constitue d’ailleurs qu’une pièce d’un puzzle plus complexe. En effet, nous avons observé que, dans l’hippocampe et d’autres structures cérébrales, les neurones et les synapses GABAergiques deviennent fonctionnelles avant leurs homologues glutamatergiques (Figure 2) [
7–
9]. Une étude morpho-fonctionnelle au cours de laquelle des centaines de cellules pyramidales glutamatergiques et d’interneurones GABAergiques ont été enregistrés et reconstruits à la naissance, montre clairement que la maturation des interneurones GABAergiques intervient en premier : ainsi à la naissance, 80 % des interneurones et seulement 20 % des cellules pyramidales de la région Ca1 de l’hippocampe ont des synapses fonctionnelles. Les premières activités du circuit en formation sont de type GABAergiques, les interneurones contrôlant la décharge de réseau d’emblée. Rappelons aussi que dans un travail au cours duquel nous avons, pour la première fois, enregistré des neurones centraux de primates in utero, nous avons confirmé cette séquence de maturation qui semble donc avoir été préservée au cours de l’évolution.  | Figure 2.
Cinétique de développement des synapses GABA. Les synapses GABA sont opérationnelles avant les synapses glutamate dans l’hippocampe de rongeur et de primate. Des neurones ont été enregistrés dans des tranches d’hippocampe de rat (à la naissance, figure supérieure) et de primates (in utero, figure inférieure) puis reconstruits pour l’analyse morphologique. On notera que les neurones sont soit silencieux - pas de réponses synaptiques - soit possèdent des synapses fonctionnelles GABA mais pas glutamate soit des synapses GABA et glutamate. Les cellules silencieuses sont petites et possèdent peu ou pas de dendrites alors que les neurones avec des synapses GABA ont des dendrites apicales mais pas développées. Enfin, les neurones ayant les deux types de synapses ont des dendrites bien développées y compris des dendrites basales. Il n’y a pas de neurones possédant des synapses fonctionnelles glutamate sans avoir de synapses GABA. |
En conséquence, ce sont ces neurones et synapses GABAergiques qui vont fournir l’essentiel de l’excitation à une phase précoce du développement. Cette formation en premier des synapses GABAergiques implique qu’elle va se faire sur des cibles post-synaptiques moins matures alors que la formation de synapses glutamatergiques nécessite des cibles plus développées. En d’autres termes, un neurone immature avec peu d’arborisations établira des synapses GABAergiques dès qu’il entrera en contact avec des terminaisons de neurones GABAergiques, en revanche il lui faudra attendre d’être plus développé afin d’établir des synapses avec des terminaisons glutamatergiques. Cette séquence n’est pas due à une arrivée tardive des afférents GABAergiques ou glutamatergiques car celles-ci sont présentes dans le neuropile1. Par ailleurs, bien avant la formation de synapses, certains transmetteurs dont le GABA en particulier, semblent impliqués dans une forme de communication paracrine influençant le développement cérébral. Dans le cerveau comme en périphérie, les récepteurs sont formés avant les synapses et vont répondre aux taux circulants du GABA libéré par les éléments neuronaux en phase de croissance [
10,
11]. La libération de GABA par les éléments neuronaux, qui n’est pas de type vésiculaire, va se traduire par une augmentation du calcium et d’autres signaux intracellulaires. Elle va moduler des fonctions essentielles à la maturation neuronale : croissance, migration neuronale, formation de synapses etc. Ces effets distaux du GABA vont être facilités par la cinétique de maturation des transporteurs chargés de réguler les taux circulants de GABA et de glutamate. En effet, les transporteurs chargés d’évacuer le GABA maturent tardivement alors que les transporteurs du glutamate sont opérationnels bien avant la naissance. Par conséquent, le GABA va pouvoir diffuser et avoir des actions de type paracrine plus facilement tandis que les concentrations de glutamate extracellulaire sont finement contrôlées d’emblée afin d’empêcher une toxicité. En effet, des molécules bloquant les transporteurs GABA ont peu d’effets sur la décharge alors même que celles qui bloquent les transporteurs glutamate engendrent des crises d’épilepsie et produisent des lésions. Les conséquences fonctionnelles et cliniques de cette « neurotrophicité » du GABA ne sont pas neutres. En effet, de nombreuses molécules utilisées en clinique - agents antiépileptiques, anxiolytiques, etc. - agissent sur les récepteurs GABA. Selon le degré de maturité des neurones, on peut s’attendre à des effets très différents sur la migration des neurones et la construction de réseaux neuronaux. Ainsi, l’activation des synapses GABA immatures aura des effets très différents voire opposés chez la femme enceinte et le fœtus : elle inhibe les uns et excite les autres. Ainsi, certaines molécules anti-épileptiques qui agissent sur les récepteurs GABAergiques exercent des effets délétères sur la migration neuronale, et, in vitro et in vivo, retardent la migration chez les rongeurs [11,
12]. Nous avons ainsi pu montrer récemment que l’administration à des rates gestantes de certaines molécules anti-épileptiques entraînent des taux sériques identiques à ceux observés chez des femmes épileptiques enceintes, aboutit chez le fœtus à des lésions et à la formation de foyers hétérotopiques. Ces amas de neurones déplacés sont associés à bon nombre de maladies neurologiques. Même si les données chez l’homme sont peu élaborées, des effets délétères spécifiques au cerveau en développement impliquent le développement d’une pharmacopée spécifique pour la grossesse. |
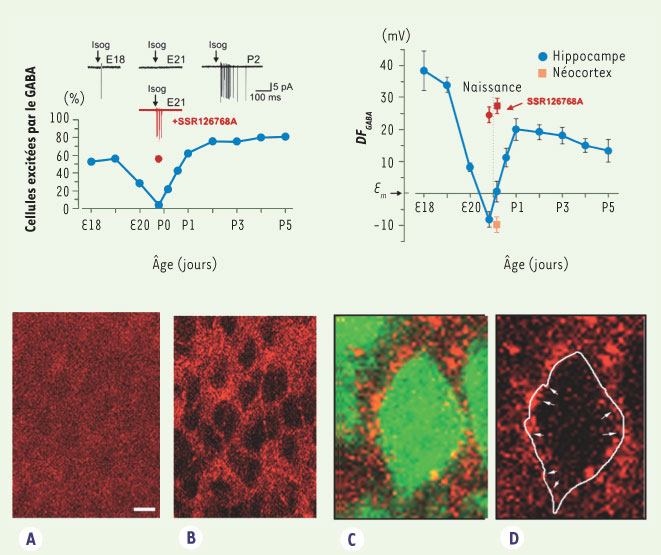
GABA et accouchement : une illustration pratique de l’importance de ces courbes de maturation Chute de chlore intracellulaire et d’ocytocine à l’accouchement Dans nos travaux précédents, nous avions observé une chute progressive du chlore intracellulaire du stade embryonnaire à l’adulte. Cependant, au cours d’un travail centré sur l’examen plus détaillé de la cinétique d’expression du chlore intracellulaire au cours de la maturation, nous avons découvert une chute brutale et transitoire du chlore juste avant, pendant et après la naissance [ 5]. Le chlore intracellulaire s’effondre et atteint en quelques heures 4mM - valeur qui n’est jamais atteinte avant ou après cette phase - et le GABA exerce des effets inhibiteurs puissants. Cette chute brutale et transitoire se produit dans l’hippocampe et le néocortex qui se trouvent à des stades différents de leur maturation, excluant un mécanisme intrinsèque. Nous avons donc cherché un mécanisme extrinsèque qui pourrait causer une telle baisse de [Cl -] i [ 5]. On sait que le travail est déclenché par la libération, par l’hypothalamus maternel, de différents facteurs et notamment de l’hormone ocytocine qui, en se liant à des récepteurs utérins, activent l’accouchement. Nous avons constaté que si l’on administre à la mère un antagoniste des récepteurs de l’ocytocine et de la vasopressine tel que l’atosiban - utilisé en clinique pour retarder le travail précoce et empêcher une naissance prématurée - la chute du [Cl -] i et le passage à un GABA fortement inhibiteur dans les neurones du fœtus ne se produisent pas (Figure 3). Fait encore plus étonnant, si l’ocytocine est administrée pendant la période néonatale, elle ne provoque pas cette modification phénotypique, contrairement à l’antagoniste, suggérant que les récepteurs de l’ocytocine sont saturés par la concentration d’hormone circulante. D’autres observations confirment encore l’origine maternelle et non fœtale de l’hormone. Ainsi, les neurones du foetus ne semblent pas produire de façon significative l’ocytocine (déterminée par immunocytochimie) alors qu’ils expriment une forte densité de récepteurs à l’hormone. Ainsi, par ce mécanisme, la mère prévient donc en quelque sorte le fœtus de l’imminence de la naissance. Quels peuvent être les buts d’une telle préparation et quelles en sont les implications fonctionnelles et cliniques ? 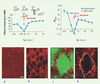 | Figure 3.
Interactions entre le GABA et l’hormone ocytocine. Sous l’influence de l’hormone, le GABA inhibe les neurones dans la période néonatale. Les effets de l’application d’un analogue du GABA ont été enregistrés dans des tranches de différents âges. On note que les neurones sont excités à E18, E21 et P2 ; en revanche à E21-la veille de la naissance, le GABA n’engendre pas de potentiel d’action. La courbe décrivant les modifications de la force éléctromotrice du GABA montre (à gauche) une baisse brutale juste avant la naissance correspondant à une baisse du [Cl–]i. Cela est vrai pour des neurones néocorticaux et hippocampiques. L’administration in vivo à la mère avant la naissance d’un antagoniste des récepteurs de l’ocytocine élimine cette baisse transitoire. Partie basse de la figure : les récepteurs de l’ocytocine - mais pas l’hormone - sont présents dans les neurones hippocampiques immatures (approche immunocytochimique). A. Marquage avec des anticorps à l’ocytocine. B. Marquage avec des anticorps des récepteurs de l’ocytocine. C-D. Détails du marquage avec des récepteurs de l’ocytocine montrant la localisation des récepteurs sur les membranes des neurones et non à l’intérieur de ceux-ci. |
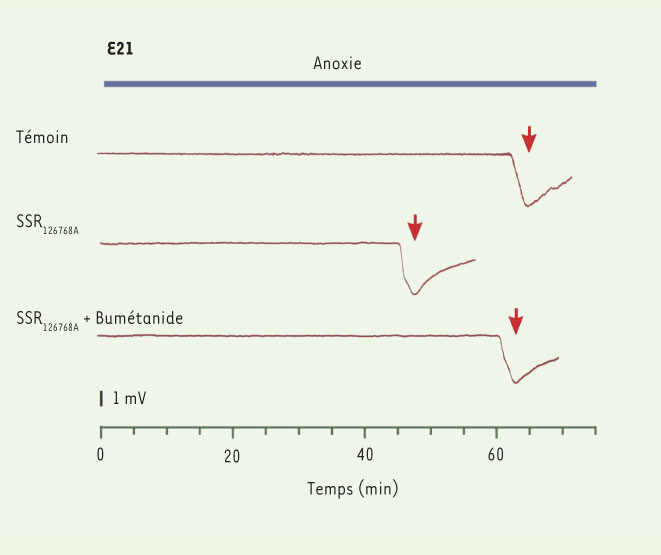
Ocytocine et anoxie fœtale Nous avons dans ce but testé les effets de l’ocytocine sur les réponses neuronales à des épisodes d’anoxie (Figure 4). Nous avons observé que la durée requise pour produire une dépolarisation terminale signalant la mort des neurones est réduite de 25 %-30 % en présence d’un antagoniste des récepteurs à l’ocytocine. Ces données suggèrent que la libération de l’hormone par la mère aura pour conséquence de renforcer la protection des neurones centraux du fœtus à des épisodes d’anoxie. Nous avons aussi pu montrer que ces effets passent en partie par une réduction de l’activité du co-transporteur responsable de l’influx de chlore (le NKCC1). Ainsi, un même signal - l’hormone maternelle qui déclenche le travail - va prévenir le fœtus de l’imminence de la naissance et le préparer aux séquelles éventuelles en réduisant sa vulnérabilité par l’intermédiaire d’une baisse de [Cl -] i.  | Figure 4.
Le blocage des récepteurs de l’ocytocine rend les neurones moins résistants à des épisodes anoxo-ischémiques. Des épisodes anoxiques ont été évoqués par la perfusion avec un milieu dépourvu d’oxygène pendant près d’une heure. Les neurones contrôles résistent plus d’une heure jusqu’à la dépolarisation terminale (voir flèche). En revanche, dans des tranches de cerveau prélevées après traitement de la mère avec un antagoniste des récepteurs à l’ocytocine, ce délai est plus court indiquant une plus grande vulnérabilité à l’anoxie. Le blocage du co-transporteur du chlore, responsable de l’augmentation de [Cl–]i empêche aussi ces effets, indiquant que l’hormone agit par l’intermédiaire du co-transporteur et de [Cl–]i
|
Quelles sont les implications cliniques de ces observations ? Certes, les différences majeures entre les rongeurs et l’homme en termes de degré de maturité cérébrale à la naissance rendent la comparaison difficile. La baisse progressive de [Cl-]i a bien lieu chez l’homme mais vraisemblablement plus tôt - encore que les taux du co-transporteur qui évacue le chlore semblent aussi être faibles à la naissance. On peut penser que dans bon nombre de structures cérébrales, le switch chez l’homme se fait au cours du troisième trimestre. Par ailleurs, dans les pays développés, les anoxies fœtales ne sont plus la cause principale des complications liées à l’accouchement. Reste que le mécanisme relayé par l’ocytocine - et d’autres hormones libérées pendant l’accouchement- exerce un effet neuro-protecteur en baissant encore plus le chlore que chez l’adulte. Cela va exercer une action générale sur l’activité nerveuse qui peut être qualifiée de quasi anesthésique et s’accompagne peut-être d’effets de type analgésiant. L’utilisation de molécules qui bloquent les récepteurs centraux - par exemple pour retarder un travail prématuré - peut avoir des conséquences négatives. Il devient important de développer des antagonistes des récepteurs qui bloquent les récepteurs utérins sans empêcher leur action bénéfique sur les neurones centraux du fœtus. |
L’ensemble des séquences de maturation aura pour conséquence de favoriser le développement des récepteurs, neurones et synapses GABAergiques avant celui des structures utilisant le glutamate. Le GABA est bien un transmetteur pionnier dont les actions excitatrices vont exercer un rôle trophique sur bon nombre de fonctions essentielles à la maturation cérébrale et à la construction de réseaux neuronaux. Quels sont les avantages de ces séquences qui justifient le retard du développement des synapses glutamate ? À l’évidence, on ne peut à ce stade qu’élaborer des propositions spéculatives. Il n’est pas anodin de rappeler que les synapses GABA ont des propriétés uniques qui leur permettent de passer d’une polarité à une autre par l’intermédiaire d’une modification des concentrations de [Cl-]i. De plus, malgré cette excitation, le GABA exerce toujours une inhibition partielle (de type shunt qui tend à maintenir le potentiel de membrane au niveau du potentiel d’équilibre du chlore et donc empêche une excitation excessive). Ainsi, le GABA est dans une position unique de fournir sans danger l’excitation et les augmentations de calcium requises pour la croissance, sans avoir d’effets potentiellement excito-toxiques. En revanche, le glutamate exerce des effets excito-toxiques quand ses actions ne sont pas limitées et contrôlées dans le temps. Nous proposons par conséquent que ces séquences de maturation ont pour but de permettre au système nerveux de fournir une excitation suffisante pour permettre la croissance tout en respectant un équilibre entre excitation et inhibition et en empêchant des effets excito-toxiques de synapses glutamate non contrôlées. Quelle que soit l’explication à l’origine de cette séquence, ces observations impliquent de réexaminer l’utilisation de molécules pendant la grossesse en tenant compte que le cerveau en développement n’est pas un petit cerveau adulte ! |
Ces travaux ont été financés par l’Inserm, la FRC, le Rotary, la FRM, l’UE et le Conseil Régional PACA.
|
Footnotes |
1. Ben-Ari Y, Cherubini E, Corradetti R, et al. Giant synaptic potentials in immature rat CA3 hippocampal neurones J Physiol (Lond) 1989; 416 : 303–25. 2. Ben-Ari. Excitatory actions of GABA during development : the nature of the nurture. Nat Rev Neurosci 2002; 3 : 728–39. 3. Cherubini E, Rovira C, Gaiarsa JL, et al. GABA mediated excitation in immature rat CA3 hippocampal neurons. Int J Dev Neurosci 1990; 8 : 481–90. 4. Tyzio R, Ivanov A, Bernard C, et al. Membrane potential of CA3 hippocampal pyramidal cells during postnatal development. J Neurophysiol 2003; 90 : 2964–72. 5. Tyzio R, Cossart R, Khalilov I, et al. Maternal oxytocin triggers a transient inhibitory switch in GABA signaling in the fetal brain during delivery. Science 2006; 314 : 1788–92. 6. Rivera C, Voipio J, Payne JA, Ruusuvuori E, et al. The K+/Cl- co-transporter KCC2 renders GABA hyperpolarizing during neuronal maturation. Nature 1999; 397 : 251–5. 7. Tyzio R, Represa A, Jorquera I, et al. The establishment of GABAergic and glutamatergic synapses on CA1 pyramidal neurons is sequential and correlates with the development of the apical dendrite. J Neurosci 1999; 19 : 10372–82. 8. Khazipov R, Esclapez M, Caillard O, et al. Early development of neuronal activity in the primate hippocampus in utero. J Neurosci 2001; 21 : 9770–81. 9. Hennou S, Khalilov I, Diabira D, et al. Early sequential formation of functional GABAA and glutamatergic synapses on CA1 interneurons of the rat foetal hippocampus. Eur J Neurosci 2002; 16 : 197–208. 10. Demarque M, Represa A, Becq H, et al. Paracrine intercellular communication by a Ca2+ and SNARE independent release of GABA and glutamate prior to synapse formation. Neuron 2002; 36 : 1051–61. 11. Manent JB, Demarque M, Jorquera I, et al. A noncanonical release of GABA and glutamate modulates neuronal migration. J Neurosci 2005; 25 : 4755–65. 12. Manent JB, Jorquera I, Ben-Ari Y, et al. Glutamate acting on AMPA but not NMDA receptors modulates the migration of hippocampal interneurons. J Neurosci 2006; 26 : 5901–9. |