| |
| Med Sci (Paris). 2007 May; 23(5): 497–501. Published online 2007 May 15. doi: 10.1051/medsci/2007235497.Pollution atmosphérique et maladies respiratoires Un rôle central pour le stress oxidant Armelle Baeza* and Francelyne Marano* Laboratoire de Cytophysiologie et Toxicologie Cellulaire (LCTC) Université Paris 7 Denis-Diderot 75251 Paris Cedex 05, France |
Les effets de la pollution atmosphérique sur la santé sont reconnus depuis l’épisode tragique du smog londonien de décembre 1952 où plus de quatre mille décès supplémentaires ont été associés à l’augmentation excessive, pendant cinq jours, de deux polluants atmosphériques majeurs, le SO2 (dioxyde de soufre) et les fumées noires. Depuis, de nombreuses études épidémiologiques ont corrélé les niveaux de certains polluants, à l’extérieur mais aussi à l’intérieur des locaux, à l’aggravation de pathologies respiratoires telles que l’asthme et la broncho-pneumopathie chronique obstructive ou BPCO [
1]. Parmi ces polluants, deux ont été tout particulièrement étudiés, l’ozone, du fait des fréquents épisodes de pollution photo-oxydante pendant l’été, et les particules fines (particules dont le diamètre aérodynamique est inférieur à 2,5µm) et ultrafines (diamètre aérodynamique inférieur à 0,1µm), associées essentiellement au trafic automobile. Par ailleurs, un intérêt grandissant se développe pour les nanoparticules (dont la taille est identique à celle des particules ultrafines) utilisées dans le domaine des nanotechnologies et dont on connaît encore mal les impacts sur la santé. |
Le rôle central du stress oxydant Une abondante littérature a mis en évidence ces dernières années un point commun à ces différents types de polluants : ils induisent un stress oxydant qui déclenche une suite d’événements moléculaires et cellulaires aux conséquences multiples : réponse inflammatoire, modulation de la prolifération et de la différenciation cellulaires, voire induction de la mort cellulaire. Le stress oxydant pourrait donc avoir une responsabilité importante dans les cascades de signalisation qui conduisent à la sécrétion des médiateurs impliqués dans l’asthme et la BPCO. La production excessive d’espèces réactives de l’oxygène (ERO) est à l’origine du stress qui, selon son intensité, peut conduire à des réponses cellulaires progressives et des lésions plus ou moins importantes. Cela a été démontré sur des macrophages traités par des particules Diesel [
2] (Figure 1). Une faible production d’ERO induit l’activation des systèmes antioxydants cellulaires. Si cette protection est insuffisante, l’augmentation du stress oxydant provoque une réponse inflammatoire. Lorsque dans une dernière étape toutes les défenses sont débordées, il peut conduire à la mort cellulaire par apoptose (mort cellulaire programmée) ou par nécrose. Cette hiérarchisation de la réponse est directement liée à la balance pro-oxydants/antioxydants, qui, elle-même, varie d’un individu à l’autre. Le polymorphisme des systèmes enzymatiques antioxydants et des enzymes associées au métabolisme des xénobiotiques, en particulier les enzymes de phase 2, explique en grande partie cette variabilité individuelle. Ces différents systèmes enzymatiques sont utilisés par la cellule pour maintenir l’homéostasie redox, c’est-à-dire éliminer la production excessive d’ERO et la protéger vis-à-vis des dommages induits par les xénobiotiques électrophiles et les oxydants. La diminution d’expression ou l’altération de ces enzymes peut donc augmenter la sensibilité aux polluants et conduire à une aggravation, voire un déclenchement, des pathologies respiratoires. L’hypothèse du rôle central d’une perturbation de l’homéostasie redox est donc avancée pour expliquer la relation entre pollution atmosphérique et asthme [
3] ou BPCO [
4].  | Figure 1.
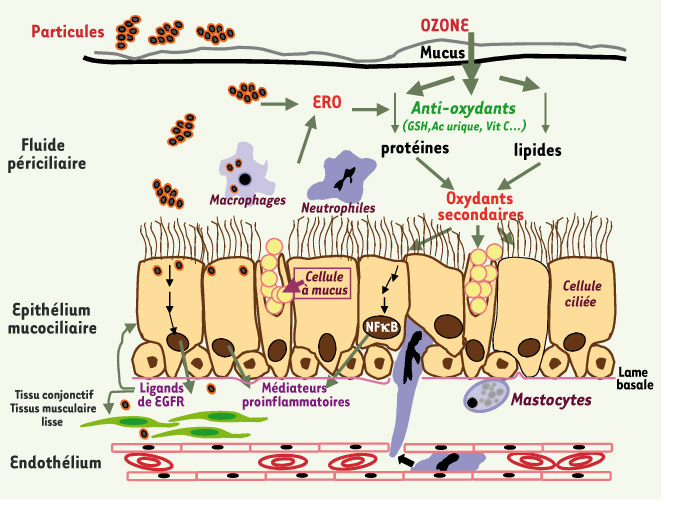
Mécanismes de toxicité de l’ozone et des particules atmosphériques dans les voies aériennes. L’ozone et les particules atmosphériques agissent par des mécanismes cellulaires et moléculaires voisins. L’ozone, peu hydrosoluble, réagit fortement avec les anti-oxydants présents en abondance dans le liquide périciliaire tels que la vitamine C (Vit C), l’acide urique (Ac urique) et le glutathion réduit (GSH) donnant du glutathion oxydé (GSSG). Cependant des réactions avec les enzymes sécrétées peuvent se produire, conduisant à leur inactivation, ainsi qu’avec des lipides polyinsaturés générant des espèces cytotoxiques et pro-inflammatoires. L’ozone favorise fortement la migration des polynucléaires neutrophiles à la surface de l’épithélium respiratoire par la synthèse de chimio-attractants qui résulte de l’activation de voies de signalisation cellulaires sensibles aux oxydants. L’activation des neutrophiles va conduire à la production d’espèces réactives de l’oxygène (ERO) qui vont affaiblir davantage les défenses anti-oxydantes du fluide périciliaire et provoquer un stress cellulaire associé à la réponse pro-inflammatoire. Le transport mucociliaire et la phagocytose par les macrophages sont les principaux mécanismes de protection vis-à-vis des particules atmosphériques (PM). Cependant, leur réactivité de surface et la présence de métaux de transition peuvent être à l’origine de la production extracellulaire d’ERO. Au contact de l’épithélium, ces particules peuvent être phagocytées et, éventuellement, traverser la barrière par transcytose. Dans la cellule, les voies de signalisation impliquées dans la réponse pro-inflammatoire sont les mêmes que pour l’ozone. Cependant, une spécificité du stress particulaire concerne l’activation du récepteur à l’EGF (EGFR) et la synthèse de ses ligands à l’origine du remodelage bronchique. |
|
L’ozone et les particules atmosphériques peuvent engendrer, par des mécanismes différents, un stress oxydant dans l’appareil respiratoire L’ozone (O3) est un gaz oxydant extrêmement réactif formé par réaction photochimique dans l’air à partir d’oxydes d’azote (NOx) et de composés organiques volatiles (COV). Il est peu soluble dans l’eau, et ses effets sur le tissu pulmonaire se situent essentiellement au niveau distal, en particulier bronchiolaire et alvéolaire. En raison de sa forte réactivité chimique, l’ozone n’atteint pas directement les membranes des cellules épithéliales et n’y pénètre pas, mais il interagit avec les composés du fluide périciliaire qui recouvre l’épithélium mucociliaire des voies aériennes et du surfactant qui tapisse les alvéoles pulmonaires. Ces fluides possèdent des propriétés anti-oxydantes dues, en particulier, à la sécrétion d’anti-oxydants par les cellules épithéliales. Ils assurent une première ligne de protection qui, lorsqu’elle est dépassée, va permettre à l’ozone, grâce à ses deux électrons libres, d’oxyder directement des molécules biologiques du fluide périciliaire. Il peut s’agir des acides gras polyinsaturés tels que l’acide arachidonique, dont la peroxydation conduit à la formation de radicaux libres comme le radical hydroxyl, et donne des produits de réactions stables comme H2O2, des aldéhydes, des hydroperoxydes lipidiques et des produits d’ozonation des lipides. Ces dérivés peuvent créer un stress oxydant au niveau de l’épithélium sous-jacent. Les produits de dégradation de l’acide arachidonique sont de puissants attractants et favorisent fortement la migration des polynucléaires neutrophiles à la surface des voies respiratoires. Lorsque ces cellules sont activées, elles sont à l’origine d’une nouvelle vague de stress oxydant qui réduira davantage les défenses anti-oxydantes et induira des lésions cellulaires. Les protéines du fluide périciliaire sont aussi la cible d’oxydations sur les groupements fonctionnels (sulfhydryls, aminés…) qui conduisent à l’inactivation de certaines enzymes comme les anti-protéases (Figure 2).  | Figure 2.
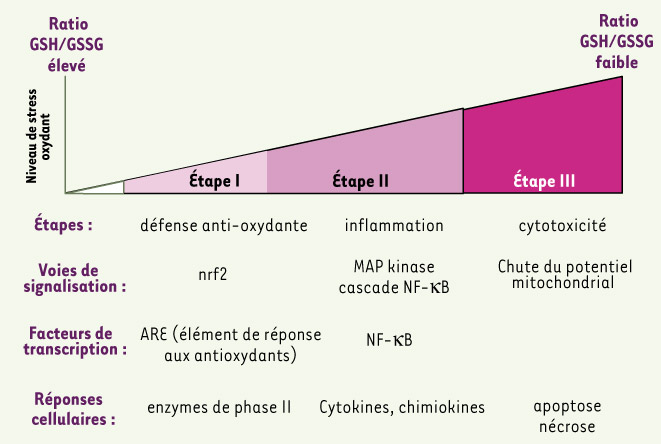
Le modèle de stress oxydant : les différentes étapes. À un faible niveau de stress oxydant (étapeI), la transcription des enzymes anti-oxydantes est induite via l’activation de l’élément de réponse aux antioxydants (ARE) par le facteur de transcription Nrf2 afin de restaurer l’homéostasie redox de la cellule. À un niveau intermédiaire de stress oxydant (étapeII), l’activation de la cascade des MAP-kinases et du facteur de transcription NF-κB induit la réponse pro-inflammatoire. À un niveau élevé de stress oxydant (étapeIII), le programme d’apoptose est activé par la voie mitochondriale, le stress le plus élevé conduisant à la nécrose (modifié d’après [ 2]). |
La capacité qu’ont les particules atmosphériques (PM pour particulate matter) de produire des ERO dépend de leur taille et de leur composition chimique. En milieu urbain elles sont principalement constituées de suies issues de processus de combustion, comme celles provenant des échappements Diesel caractérisées par un cœur carboné sur lequel sont adsorbés des composés organiques. Ces particules de taille nanométrique s’agglutinent entre elles pour former des grappes de diamètre égal ou inférieur à 1 µm. Au cours de leur vieillissement dans l’atmosphère, d’autres composés s’y associent comme des métaux, des allergènes, des endotoxines. On y trouve également des particules plus grosses issues de phénomènes d’érosion ou d’usure. La taille des PM, définie par leur diamètre aérodynamique, joue un rôle déterminant dans la production d’un stress oxydant. Plus le diamètre des particules est faible, plus le nombre de particules collectées par unité de masse est important et plus la surface spécifique (c’est à dire l’aire développée totale par unité de masse) augmente. Cela s’accompagne d’une augmentation de la réactivité de surface qui se traduit par la production d’espèces radicalaires provenant de la dissociation de l’oxygène. Par exemple, en condition acellulaire, des particules ultrafines de carbone produisent davantage d’ERO responsables de cassures au niveau de molécules d’ADN que ne le font des particules fines [
5,
6]. Récemment, l’accumulation de PM ultrafines a été observée par microscopie électronique dans les mitochondries de macrophages en culture. L’altération du fonctionnement de ces organites cellulaires contribuerait à la production du stress oxydant induit par les particules [
7]. La composition chimique des particules, faites de métaux et de composés organiques, joue également un rôle important dans la production des ERO. Les métaux sont connus pour être des catalyseurs de lésions oxydatives touchant les macromolécules biologiques. Les métaux de transition, fer, cuivre et vanadium, subissent des cycles d’oxydoréduction au cours desquels ils produisent le radical hydroxyl, très réactif. Les composés organiques induisent une production d’ERO spécifiquement dans des macrophages [
8] et dans des cellules épithéliales bronchiques humaines [
9] par l’intermédiaire des quinones, capables de générer des radicaux libres au cours de cycles rédox [
10], et des hydrocarbures aromatiques polycycliques (HAP) dont la métabolisation conduit également à la formation d’ERO. |
L’ozone et les particules atmosphériques sont à l’origine d’une réponse inflammatoire associée au stress oxydant L’inflammation de l’appareil respiratoire est largement associée à l’hypersécrétion de médiateurs proinflammatoires par les cellules épithéliales et les macrophages alvéolaires, médiateurs qui vont ensuite attirer des cellules de l’inflammation. Ainsi, l’ozone (0,1 ppm, 1 µmol/mol= 1 ppm) induit la sécrétion de cytokines [IL (interleukine)-8, IL-6, GM-CSF (granulocyte-macrophage colony-stimulating factor)…] chimio-attractantes pour les neutrophiles, par les cellules nasales et bronchiques, et les cellules provenant de sujets asthmatiques sont plus réactives. Les populations de lymphocytes et de mastocytes sont aussi augmentées et la capacité de phagocytose des macrophages est diminuée [
11]. Cette sécrétion de médiateurs par les cellules épithéliales respiratoires est liée à l’induction de voies de signalisation sensibles aux oxydants, généralement celles des MAP-kinases, qui contrôlent l’activation de certains facteurs de transcription sensibles au stress oxydant dont NF-βB [
12]. NF-ΚB, après sa migration vers le noyau, se lie au promoteur de gènes cibles dont ceux de cytokines proinflammatoires (Figure 1, étape II). Les mécanismes de la réponse inflammatoire (sécrétion d’ IL-1β, de TNFα, d’IL-8, d’IL-6, de GM-CSF …) induite par les particules atmosphériques sont très comparables bien que d’origine différente. Le rôle de la taille des particules a été démontré à l’aide de particules modèles comme les particules de noir de carbone [
13].Les particules ultrafines (≤ 100 nm) provoquent l’effet pro-inflammatoire le plus clair, sans doute en raison de la plus grande réactivité de surface créée par ces particules. Le rôle de la fraction métallique soluble a été mis en évidence en utilisant des extraits aqueux de particules très riches en métaux récupérées dans la vallée de l’Utah avant, pendant et après la fermeture transitoire d’une usine sidérurgique. L’inflammation pulmonaire consécutive à l’instillation de ces extraits par des volontaires sains a été corrélée à la teneur en métaux des extraits [
14]. Enfin, les composés organiques, dont les HAP, sont extraits des particules de combustion comme les Pdi (particules Diesel), sans doute après leur phagocytose, et sont ensuite métabolisés. Ils induisent l’expression et l’activité du cytochrome P450 1A1 (CYP 1A1), enzyme de métabolisation de phase I [
15]. Les ERO produites par l’activité propre de l’enzyme, ainsi que par les métabolites, contribuent à l’activation de facteurs de transcription sensibles au stress oxydant dont NF-ΚB mais aussi Nrf2 [9], qui participe à l’activation de l’élément de réponse aux anti-oxydants (ARE). Celui-ci contrôle les gènes de métabolisation d’enzymes de phase II et d’enzymes à activité anti-oxydante telles que l’hème oxygénase. Ces réponses pourraient jouer un rôle dans le renforcement de la protection antioxydante qui se produit au cours de la première phase de l’agression particulaire (Figure 1, étape I) [
16]. |
L’agression oxydante conduit-elle au remodelage bronchique ? Les cellules épithéliales qui tapissent l’appareil respiratoire sont, avec les macrophages, les premières cellules à réagir aux agressions. Les épithéliums bronchique et alvéolaire jouent un rôle de barrière dynamique en participant au processus inflammatoire induit par le stress oxydant. Il en résulte des changements fonctionnels sur les tissus environnants, induits via un effet paracrine des sécrétions épithéliales (cytokines et facteurs de croissance). Néanmoins, on ne peut exclure que les particules les plus fines aient un effet direct sur les tissus voisins par transcytose, au travers des épithéliums [
17]. Une exacerbation et/ou un dérèglement des fonctions épithéliales associés à une exposition répétée aux polluants environnementaux, ozone et PM, peuvent être à l’origine d’une inflammation chronique et d’un remodelage bronchique caractérisé par l’épaississement du tissu musculaire lisse, une métaplasie muqueuse et une fibrose péribronchique [
18]. Ces modifications s’observent aussi chez des patients atteints de BPCO et d’asthme. Lorsque l’agression est trop importante, la sévérité des lésions cellulaires ne permet pas la mise en place des mécanismes d’adaptation et s’engage alors un processus de mort cellulaire par apoptose voire par nécrose (Figure 1, étape III). L’induction de l’apoptose a été observée spécifiquement pour les macrophages alvéolaires en réponse au stress oxydant induit par les particules fines et ultrafines. Celles-ci peuvent s’accumuler dans les mitochondries et provoquer des dommages mitochondriaux associés à l’augmentation des ERO. La cascade proapoptotique est alors déclenchée par la chute du potentiel transmembranaire de la mitochondrie et la libération cytosolique du cytochrome c. Les macrophages, sans doute parce qu’ils ont une plus grande capacité de phagocytose, sont plus sensibles que les cellules épithéliales à l’induction de l’apoptose [
19]. Cette constatation est importante pour expliquer la persistance des particules dans le poumon profond (zones alvéolaires) associée à l’inflammation chronique et au remodelage bronchique [18]. La découverte récente que les PDi à faible concentration pouvaient, par contre, inhiber l’apoptose dans la lignée alvéolaire humaine A549 en provoquant la baisse d’expression de la protéine p21, particulièrement importante dans le contrôle du cycle cellulaire, pose la question de leur rôle à long terme sur la prolifération cellulaire et l’hyperplasie [
20]. Le rôle du récepteur de l’EGF Le récepteur à l’EGF (EGFR) (epidermal growth factor) et ses ligands jouent un rôle déterminant dans ces réponses. En effet ils participent à l’homéostasie tissulaire, notamment en régulant la croissance et la différenciation des cellules épithéliales et conjonctives dans le poumon [
21]. Ils sont fortement exprimés chez les patients asthmatiques, ce qui conduit à la surproduction de mucus et à un épaississement de la membrane basale. Les particules riches en métaux [
22], les PM2,5 et les PDi provoquent la sécrétion de cytokines en réponse à l’activation de l’EGFR, qui pourrait survenir en l’absence de ligands spécifiques, par un mécanisme dit de « transactivation » lié à des ERO [
23]. Cette activation peut aussi résulter, plus classiquement, de la fixation de ligands par l’établissement d’une boucle autocrine. En effet, PM2,5 et PDi sont aussi à l’origine de l’augmentation de la sécrétion de l’amphiréguline, un des ligands du récepteur à l’EGF fortement impliqué dans le remodelage bronchique [
24,
25]. Par ailleurs, cette sécrétion, essentiellement basolatérale [
26], peut expliquer un effet paracrine sur les tissus voisins, conjonctif et muscle lisse. Il est donc probable qu’existe une interaction entre l’épithélium agressé et les tissus adjacents par l’intermédiaire de signaux moléculaires émis par les cellules épithéliales et susceptibles de moduler la physiologie des cellules voisines, décenchant ainsi les processus physiopathologiques qui peuvent aboutir au remodelage bronchique. |
Le stress oxydant joue un rôle clé dans les réponses cellulaires induites par les polluants atmosphériques majeurs que sont l’ozone et les particules fines et ultrafines. Ces mécanismes sont globalement communs aux deux types de polluants même si l’origine des ERO est sensiblement différente. Par ailleurs, des réponses spécifiques peuvent être définies en fonction du niveau de l’agression oxydante (Figures 1 et 2). L’ozone induit des effets à court terme, potentiellement réversibles, lors des épisodes de pollution alors que les particules atmosphériques peuvent franchir les barrières et s’accumuler dans le poumon. La taille et la composition des PM jouent un rôle essentiel. Plus elles sont petites, plus elles sont chargées en molécules organiques (quinones, HAP) ou inorganiques (métaux de transition) et plus elles sont dangereuses. En effet, non seulement elles engendrent un stress oxydant plus important, mais leur biopersistance conduit à une inflammation chronique responsable de l’aggravation progressive des maladies respiratoires. Les PM sont actuellement mesurées dans l’atmosphère en fonction de leur masse, ce qui ne rend pas compte des particules ultrafines dont la masse est négligeable. Un critère à considérer dans le cadre des procédures réglementaires de protection des individus exposés pourrait être la détermination du potentiel oxydant de ces particules. Enfin, les individus sont soumis à des expositions multiples et il est très vraisemblable que l’ozone et les PM agissent en synergie pour accentuer le stress oxydant dans l’appareil respiratoire. |
1. Annesi-Maesano I, Dab W. Air pollution and the lung: epidemiological approach. Med Sci (Paris) 2006; 22 : 589–94. 2. Xiao GG, Wang M, Li N, et al. Use of proteomics to demonstrate a hierarchical oxidative stress response to Diesel exhaust particle chemicals in a macrophage cell line. J Biol Chem 2003; 278 : 50781–90. 3. Li N, Hao M, Phalen RF, et al. Particulate air pollutants and asthma. A paradigm for the role of oxidative stress in PM-induced adverse health effects. Clin Immunol 2003; 109 : 250–65. 4. MacNee W, Donaldson K. Mechanisms of lung injury caused by PM10 and ultrafine particles with special reference to COPD. Eur Respir J 2003; 21 : 47–51. 5. Wilson MR, Lightbody JH, Donaldson K, et al. Interactions between ultrafine particles and transition metals in vivo and in vitro. Toxicol Appl Pharmacol 2002; 184 : 172–9. 6. Donaldson K, Brown DM, Mitchell C, et al. Free radical activity of PM10: iron-mediated generation of hydroxyl radicals. Environ Health Perspect 1997; 105 : 1285–9. 7. Li N, Sioutas C, Cho A, et al. Ultrafine particulate pollutants induce oxidative stress and mitochondrial damage. Environ Health Perspect 2003; 111 : 455–60. 8. Hiura TS, Kaszubowski MP, Li N, Nel AE. Chemicals in diesel exhaust particles generate reactive oxygen radicals and induce apoptosis in macrophages. J Immunol 1999; 163 : 5582–91. 9. Baulig A, Garlatti M, Bonvallot V, et al. Involvement of reactive oxygen species in the metabolic pathways triggered by diesel exhaust particles in human airway epithelial cells. Am J Physiol Lung Cell Mol Physiol 2003; 285 : L671–9. 10. Squadrito GL, Cueto R, Dellinger B, Pryor W. Quinoid redox cycling as a mechanism for sustained free radical generation by inhaled airborne particulate matter. Free Rad Biol Med 2001; 31 : 1132–8. 11. Krishna MT, Chauhan AJ, Frew AJ, Holgate ST. Toxicological mechanisms underlying oxidant pollutant-induced airway injury. Rev Environ Health 1998; 13 : 59–71. 12. Nichols BG, Woods JS, Luchtel DL, et al. Effects of ozone exposure on nuclear factor-kappaB activation and tumor necrosis factor-alpha expression in human nasal epithelial cells. Toxicol Sci 2001; 60 : 356–62. 13. Gilmour PS, Ziesenis A, Morrison ER, et al. Pulmonary and systemic effects of short-term inhalation exposure to ultrafine carbon black particles. Toxicol Appl Pharmacol 2004; 195 : 35–44. 14. Ghio AJ, Devlin RB. Inflammatory lung injury after bronchial instillation of air pollution particles. Am J Respir Crit Care Med 2001; 164 : 704–8. 15. Bonvallot V, Baeza-Squiban A, Baulig A, et al. Organic compounds from Diesel exhaust particles elicit a proinflammatory response in human airway epithelial cells and induce cytochrome p450 1A1 expression. Am J Respir Cell Mol Biol 2001; 25 : 515–21. 16. Li N, Nel E. Role of the Nrf2-mediated signalling pathway as a negative regulator of inflammation: implications for the impact of particulate pollutants on asthma. Antiox Redox Signal 2006; 8 : 88–98. 17. Nemmar A, Hoet PH, Vanquickenborne B, et al. Passage of inhaled particles into the blood circulation in humans. Circulation 2002; 105 : 411–4. 18. Churg A, Brauer M, del Carmen Avila-Casado M, et al. Chronic exposure to high levels of particulate air pollution and small airway remodeling. Environ Health Perspect 2003; 111 : 714–8. 19. Hiura TS, Li N, Kaplan R, et al.The role of a mitochondrial pathway in the induction of apoptosis by chemicals extracted from Diesel exhaust particles. J Immunol 2000; 165 : 2703–11. 20. Bayram H, Ito K, Issa R, et al. Regulation of human lung epithelial cell numbers by diesel exhaust particles. Eur Respir J 2006; 27 : 705–13. 21. Bonner JC. The epidermal growth factor receptor at the crossroads of airway remodeling. Am J Physiol Lung Cell Mol Physiol 2002; 283 : L528–30. 22. Wu W, Samet JM, Ghio AJ, Devlin RB. Activation of the EGF receptor signalling pathway in airway epithelial cells exposed to Utah valley PM. Am J Physiol Lung Cell Mol Physiol 2001; 281 : L483–9. 23. Carpenter G. Employment of the epidermal growth factor receptor in growth factor-independent signaling pathways. J Cell Biol 1999; 146 : 697–702. 24. Blanchet S, Ramgolam K, Baulig A, Marano F, Baeza-Squiban A. Fine particulate matter induces amphiregulin secretion by bronchial epithelial cells. Am J Respir Cell Mol Biol 2004; 30 : 421–7. 25. Lemjabbar H, Li D, Gallup M, et al. Tobacco smoke-induced lung cell proliferation mediated by tumor necrosis factor (alpha)-converting enzyme and amphiregulin. J Biol Chem 2003; 278: 26202–7. 26. Auger F, Gendron MC, Chamot C, et al. Responses of well-differentiated nasal epithelial cells exposed to particles: role of the epithelium in airway inflammation. Toxicol Appl Pharmacol 2006; 215 : 285–9 |