L’homéostasie des lymphocytes au cours de la réponse immunitaire est un mécanisme soumis à une régulation fine. C’est un équilibre permanent entre la prolifération des cellules activées et leur apoptose (ou mort cellulaire programmée). Chez l’homme, des défauts de l’homéostasie lymphocytaire peuvent conduire à de nombreuses maladies comme les lymphomes, les syndromes d’activation lymphocytaire et macrophagique (ou syndrome hémophagocytaire) ou les maladies auto-immunes. Le syndrome de Purtilo, ou syndrome lymphoprolifératif lié à l’X (XLP), est une immunodéficience primaire rare, caractérisée par une sensibilité accrue des patients à l’infection par le virus Epstein-Barr [ 1]. Cette maladie atteint environ un garçon pour un million. La plupart du temps, les patients souffrent d’une mononucléose infectieuse sévère qui est fréquemment associée à un syndrome hémophagocytaire (SH) similaire à celui observé dans les formes héréditaires causées par des défauts des fonctions cytotoxiques des lymphocytes [ 2]. Le SH est caractérisé par une réponse immunitaire exacerbée au cours de laquelle les lymphocytes sont fortement activés, prolifèrent et sécrètent de grandes quantités d’IFN-γ qui stimulent secondairement les macrophages. Ceux-ci phagocytent les éléments figurés du sang et infiltrent les organes en produisant des quantités importantes de cytokines pro-inflammatoires. Dans ce contexte, on observe une nécrose massive des tissus qui peut entraîner la mort du patient. Chez certains patients, on note aussi l’apparition d’hypogammaglobulinémies et de lymphomes. Le gène responsable du XLP a été identifié en 1998, il s’agit du gène SH2D1A (ou SAP) codant une petite protéine adaptatrice de signalisation SAP (SLAM-associated protein) qui régule les fonctions des récepteurs de la famille SLAM (signaling lymphocyte activation molecule) [1, 3]. Cependant, ce gène n’est responsable que de 60 à 80 % des cas de syndromes lymphoprolifératifs liés à l’X. Au cours de ces dernières années, nous avons cherché à identifier l’origine moléculaire des syndromes XLP qui ne sont pas causés par des mutations dans le gène SAP [ 4]. Au sein d’une cohorte de 18 familles diagnostiquées comme ayant un syndrome XLP, trois familles ne présentant aucune mutation dans le gène SAP ont été identifiées et étudiées. Le phénotype clinique des individus atteints issus de ces 3 familles était très proche de celui des patients présentant un défaut en SAP, mis à part l’apparition d’une splénomégalie comme première manifestation clinique de leur maladie avant infection par l’EBV (Tableau I). La similitude des phénotypes suggérait que ces patients pouvaient partager un certain nombre de défauts fonctionnels avec les patients déficients en SAP. Dans le déficit en SAP, les réponses cytotoxiques des cellules NK (natural killer) et T CD8+ vis-à-vis des cellules infectées par l’EBV sont altérées en raison d’une perte de fonction des récepteurs de la famille SLAM, 2B4 et NTB-A [ 5– 7]. Il est proposé que ce défaut contribue à la physiopathologie du XLP. Chez les patients sans mutation de SAP, aucun défaut fonctionnel du récepteur 2B4 n’a pu être mis en évidence. Nous avons récemment établi que SAP est nécessaire au développement des lymphocytes NKT (natural killer T) et que les patients déficients en SAP en sont dépourvus [ 8, 9]. Ces cellules représentent une sous-population particulière de lymphocytes T possédant un TCR invariant composé des segments V24α/Vβ11 qui reconnaît le CD1d, une molécule de classe I du CMH monomorphe qui présente des antigènes de nature glycosphingolipidique. Fonctionnellement, les cellules NKT se distinguent par leur capacité à être activées très rapidement au début de la réponse immunitaire et à sécréter de grandes quantités de cytokines telles que l’IL-4 et l’IFN-γ. La présence des lymphocytes NKT parmi les PBL issus des patients sans mutation de SAP a été recherchée. Comme pour les patients déficients en SAP, nous avons observé que ces patients présentaient un déficit en lymphocytes NKT.
| Figure 1.
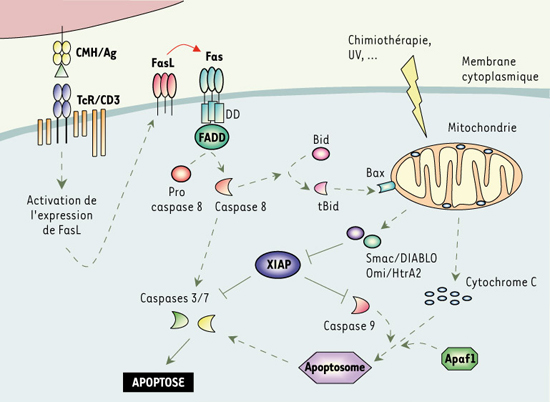
Rôle de XIAP dans la régulation de l’apoptose. Dans un lymphocyte T pré-activé, la stimulation antigénique (Ag) du récepteur de l’antigène (TCR/CD3) conduit à l’expression de la molécule Fas-ligand à la surface de ce lymphocyte. Celui-ci en s’associant au récepteur de mort Fas entraîne le recrutement et l’association de FADD aux domaines de mort (DD) du récepteur. La procaspase 8 est ensuite clivée en caspase 8 active, qui va à son tour activer directement les caspases 3 et 7. Elle va aussi activer la voie d’amplification mitochondriale en clivant la molécule Bid. XIAP joue un rôle central dans la régulation de l’apoptose en inhibant à la fois les caspases 3, 7 et 9. La molécule XIAP est elle aussi soumise à une régulation puisqu’elle est inhibée par Smac et HtrA2 lors de leur relargage par la mitochondrie. |
| Tableau I.
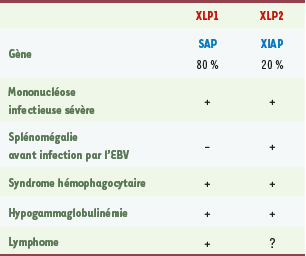
Manifestations cliniques des patients atteints de XLP. Les phénotypes cliniques des patients déficients en SAP (XLP1) et des patients déficients en XIAP (XLP2) sont similaires. Dans les deux cas, on observe chez une majorité d’entre eux (~ 60 %) un syndrome hémophagocytaire consécutif à l’infection par le virus Epstein-Barr. On observe aussi l’apparition d’hypogamma-globulinémie dans 40 % des cas environ. La différence majeure entre les patients SAP et les patients XIAP réside dans la survenue chez ces derniers d’une splénomégalie avant infection par l’EBV, comme première manifestation clinique de leur maladie (~ 50 % des patients XLP2). On note aussi l’apparition de lymphomes chez les patients XLP1 (~ 30 % des patients XLP1). Chez les patients XLP2, ce phénotype n’a pas été observé jusqu’à présent. Il est possible que l’absence de XIAP protége contre l’apparition de lymphomes en raison du rôle anti-apoptotique de XIAP. |
Parallèlement à ces études, une localisation génétique a été entreprise afin d’identifier le défaut moléculaire à l’origine du syndrome XLP chez les patients sans mutation de SAP. L’analyse de marqueurs génétiques polymorphiques sur le chromosome X de plusieurs individus (atteints et non atteints) des trois familles nous a permis d’identifier une région de 3,7 Mb coségrégeant avec la maladie. De façon étonnante, le gène SAP est retrouvé dans cette région qui comprend onze gènes que nous avons séquencés. Chez les patients atteints issus des trois familles, nous avons identifié des mutations dans le gène XIAP (X-linked mamalian inhibitor of apoptosis protein) (ou BIRC4), constitué de 6 exons codant pour une protéine anti-apoptotique de 57 kDa. Ces mutations sont délétères puisqu’elles conduisent à une absence totale d’expression de XIAP dans les cellules des patients.
XIAP appartient à la famille des protéines inhibitrices de l’apoptose (IAP) qui comprend huit membres et dont la structure est fortement conservée entre les espèces [ 10]. XIAP, dont l’expression est ubiquitaire, est caractérisée par la présence de trois domaines BIR (baculovirus IAP repeats) et d’un domaine RING finger possédant une activité ubiquitine ligase de type E3. Ces deux types de domaines permettent à XIAP d’interagir avec d’autres protéines dont les caspases 3, 7 et 9. Il a été établi que la fonction principale de XIAP est d’inhiber les caspases en interagissant directement avec leur site catalytique bloquant ainsi leur activité. Cependant, le rôle de XIAP ne semble pas uniquement limité à la régulation de l’apoptose. En effet, XIAP a aussi été impliquée dans l’homéostasie du cuivre, dans la signalisation du récepteur au TGF-β et dans l’activation de NF-κB [10].
La mort cellulaire programmée ou apoptose, déclenchée par le récepteur de mort Fas (CD95) est une voie importante du contrôle de l’homéostasie lymphocytaire. Ainsi, l’absence de Fas chez l’homme est responsable du syndrome lymphoprolifératif auto-immun (ALPS) [ 11]. Nous avons analysé l’apoptose induite par les récepteurs de mort Fas et TRAIL dans des cellules T et B issues de patients déficients en XIAP. Dans ces cellules, nous avons observé une forte augmentation de la sensibilité à l’apoptose relayée par Fas ou TRAIL comparée à l’apoptose obtenue dans les cellules provenant d’individus sains. Des résultats similaires ont été observés dans les lymphocytes T des patients après stimulation par un anticorps anti-CD3 qui déclenche un processus d’apoptose appelé activation-induced cell death (AICD). Celui-ci dépend de l’interaction de Fas avec son ligand (Fas-Ligand) qui est exprimé à la surface des lymphocytes activés par la stimulation du complexe CD3-TCR. Dans les lymphocytes déficients en XIAP, le défaut en XIAP est bien responsable de l’augmentation de l’apoptose puisque l’expression d’une forme sauvage de XIAP dans ces lymphocytes restaure leur capacité à résister à l’AICD.
Malgré l’excès de sensibilité à l’apoptose que nous avons mis en évidence dans les lymphocytes de patients déficients en XIAP, ces derniers ne présentent pas de lymphopénie particulière hormis un déficit en lymphocytes NKT. Il est donc vraisemblable que XIAP soit une molécule essentielle à la survie et/ou au développement des cellules NKT. En effet, il semble que ces cellules soient particulièrement sensibles à l’apoptose lors de la réponse anti-virale [ 12]. Nos observations indiquent que les défauts en SAP et en XIAP ont en commun une absence de cellules NKT chez des patients dont le trait clinique principal est une grande sensibilité à l’infection par le virus EBV. Cela suggère que les cellules NKT joueraient un rôle particulièrement important dans la réponse immunitaire contre l’EBV. Enfin, la proximité, sur le chromosome X, des gènes SAP et XIAP qui ne sont séparés que par 0,4 Mb, est troublante. Elle indique que ces deux gènes sont peut-être directement ou indirectement liés constituant un cluster fonctionnel. Les réponses à ces interrogations suscitées par nos observations devraient à long terme aider à une meilleure compréhension de la biologie des lymphocytes NKT et de la réponse immunitaire contre l’EBV.