| |
| Med Sci (Paris). 2007 February; 23(2): 205–209. Published online 2007 February 15. doi: 10.1051/medsci/2007232205.Résistances de Mycobacterium tuberculosis
Dominique Labie* Département de génétique, développement et pathologie moléculaire, Institut Cochin, 24, rue du Faubourg Saint-Jacques, 75014 Paris, France |
Les deux dernières décennies ont vu une remontée du nombre de cas de TB, majoritairement en Asie, en Afrique, mais aussi en Europe de l’Est. Il s’agissait souvent de rechutes après un traitement mal suivi ou insuffisant dans sa prescription ou sa durée. L’étude de ces cas révélait une implication et une information incomplète des praticiens. C’est dans ces circonstances qu’en 1993 l’OMS déclare la tuberculose « Urgence Mondiale », puis, en 1995, lance la stratégie DOTS (directly observed treatment short course strategy), nom déposé définissant une stratégie globale de traitement de courte durée et sous surveillance de toutes les personnes atteintes de tuberculose qui se présentent dans les services de soin de santé primaires. Les pays (119 en 1998) s’engageaient à une standardisation du dépistage, de la chimiothérapie et de l’enregistrement, stratégie devant augmenter le taux de guérison, diminuer la transmission de l’infection et prévenir le développement de tuberculoses pharmacorésistantes. Le rapport coût/efficacité en fait une mesure économique lourde de conséquences. En dépit des progrès notables, elle rencontre des difficultés : (1) cliniques, les malades ne prenant pas leurs médicaments régulièrement ou commettant des erreurs dans l’auto-administration ; (2) logistiques : équipement défectueux, défaut d’approvisionnement ; et (3) politiques, enfin, par manque d’implication des pouvoirs publics, déficience des infrastructures de santé publique et mauvaise gestion des ressources. Dans de nombreux pays, l’épidémie de tuberculose apparaît comme un problème spécifique des classes défavorisées. Parmi les pays les plus touchés, seuls le Pérou et le Vietnam, et à un moindre degré, le Cambodge, le Kenya et la Tanzanie, ont atteint leurs objectifs [
1]. Le lancement en 1999, par l’OMS, de l’initiative Halte à la tuberculose a cherché à remédier à ces problèmes et à sensibiliser tous les états membres. La réunion à Amsterdam, les 22-24 mars 2000, d’une « Conférence ministérielle sur la tuberculose et le développement durable » réunissant 20 pays représentant à eux seuls 80 % de la morbidité par TB dans le monde, souligne la nécessité d’accélérer l’action contre la tuberculose et formalise des engagements [
2]. Ces efforts n’ont pu, malheureusement, empêcher l’apparition dans de nombreux pays d’une pharmacorésistance, conséquence de l’échec des systèmes de santé, encore plus démunis face à l’évolution de la maladie. L’effet de synergie entre la tuberculose et le VIH produit un effet d’activation mutuelle de leur propagation. La tuberculose est la première cause de décès parmi les personnes séropositives pour le VIH, et elle est responsable d’un tiers des décès dus au Sida. Dans de nombreux pays au sud du Sahara, le nombre de malades a quadruplé ces dernières années. |
L’apparition de souches résistantes date des années 1990, et la première utilisation du terme MDR-TB (multidrug resistant tuberculosis) de 1992 [
3]. À cette époque, un rapport du CDC (Center for Disease Control) d’Atlanta essaie de faire un recensement des cas de résistance aux États-Unis, de leurs causes et de leurs modalités, et de mesurer le défi qu’ils posent en termes de santé publique [
4]. L’étude porte sur les deux médicaments de première instance les plus efficaces, l’isoniazide (INH) et la rifampicine (RIF). Les auteurs notent qu’au début de 1991, on relève 13,3 % d’échantillons résistant à l’un des deux produits et 3 % aux deux (MDR). Plusieurs foyers apparaissent entre 1990 et 1992 dans des hôpitaux, des consultations externes, avec une fréquence particulière en milieu carcéral et parmi les sans-abri. Les causes sont toujours les mêmes : traitement mal suivi ou mal prescrit, retard au diagnostic par les médecins traitants. Deux origines possibles de cette résistance étaient envisagées : résistance acquise chez le malade, ou contamination par un bacille déjà résistant. La notion d’émergence d’une résistance au cours des années précédant l’enquête se retrouve en différents lieux : à New York, dans le Mississipi, à Boston, en Floride et dans le New Jersey, sans qu’il y ait de liens entre eux. L’incidence semble particulièrement élevée chez des immigrants. L’obligation de recourir à des médicaments de seconde instance (SLD, second line drugs) tels que les aminoglycosides, fluoroquinones1, cyclosérine, acide para-aminosalicylique posait un défi à la communauté médicale. Le traitement par les SLD est plus long (deux ans), beaucoup plus onéreux, éventuellement toxique. Les études systématiques en Europe sont postérieures [
5]. En 1997, puis 1999, les taux de résistance observés en Europe de l’Ouest sont faibles : 0-9 % à l’INH, 0,2-1 % à la RIF, 0 à 2,1 % de TB MDR, observés essentiellement chez des personnes d’origine étrangère (90 %) et souvent chez des sujets traités antérieurement. En France, une étude faite en 2003 montre que les taux de résistance et de multirésistance restent faibles, malgré une augmentation dans la région parisienne, là encore dans des populations immigrées [
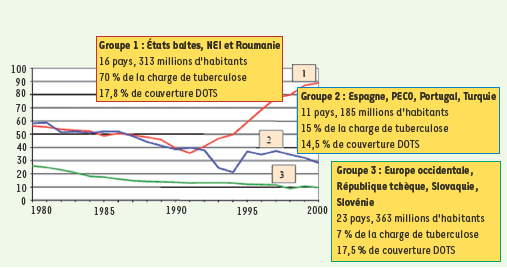
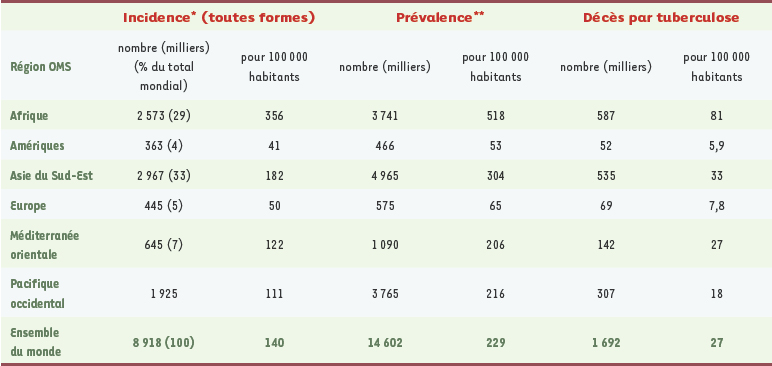
6]. En Europe Centrale, l’incidence de la TB est plus fréquente dans les pays de l’ex-Union Soviétique, particulièrement élevée dans les Pays baltes (environ 15 %) (Figure 1). En Israël, 100 % des patients recensés étaient nés à l’étranger. Le caractère inquiétant de ces données indiquait l’urgence des mesures à prendre et la nécessité d’inclure les études de résistance dans le protocole de surveillance de la maladie. Il soulignait aussi l’urgence à trouver d’autres médicaments efficaces. Une étude statistique de l’OMS menée dans les différentes régions en 2004, a montré une incidence maximale de la maladie et des décès qu’elle entraîne en Asie du Sud-Est [
7]. Mais, rapportée à la population (100 000 habitants), cette incidence était encore bien supérieure en Afrique subsaharienne (Tableau I). Dans tous les pays étudiés, on a la preuve de l’existence de souches résistantes chez les malades traités par une monothérapie.  | Figure 1.
Taux de notification de tuberculose dans la Région européenne de l’OMS (1985-2000). NEI : nouveaux états indépendants ; PECO : pays de l’Europe centrale et orientale (d’après [ 5]). |
 | Tableau I.
É
tude de l’incidence, de la prévalence et de la mortalité dans les différentes régions du monde en 2004 (d’après [ 7]). *incidence : nouveaux cas survenant pendant une période déterminée ; **prévalence : nombre de cas existant dans la population à un moment déterminé. |
|
Y a-t-il une base moléculaire à la résistance ? La résistance naturelle de Mycobacterium tuberculosis aux antituberculeux est rare, et la sélection de souches résistantes aux médicaments résulte presque toujours de traitements inadéquats. On sait que les mutations sont aléatoires et spontanées dans le chromosome bactérien, se produisant à un rythme lent, mais constant. La probabilité qu’une mutation entraîne une pharmacorésistance est directement proportionnelle à l’importance de la population bactérienne chez le patient. Elle est de l’ordre de 1 pour 106 pour INH, 1 pour 108 pour RIF, elle serait donc de 1 pour 1014 pour la résistance combinée aux deux médicaments, ce qui excède de beaucoup la population bactérienne d’une cavité pulmonaire (109 bactéries). C’est donc le plus souvent une monothérapie ou un traitement insuffisant qui aura permis l’émergence de souches MDR. L’observation d’une série de sujets traités sans succès en seconde intention, et chez lesquels on a pu comparer des prélèvements faits avant et après l’échec de ce traitement, a montré de façon constante l’acquisition, au cours du traitement, de résistance à un médicament supplémentaire au moins [
8]. En étudiant les mécanismes de résistance à la pyrazinamide chez des malades de l’État de Gauteng en Afrique du Sud, est apparue une concordance entre cette résistance et des mutations du gène pncA codant la pyrazinamidase [
9]. On doit cependant faire une mention particulière pour le génotype Beijing. Considéré comme le deuxième par sa fréquence mondiale, ce génotype a été mis en évidence dans de nombreux pays et il est fréquemment associé à une pharmacorésistance [
10]. Il avait été responsable, à New York, d’une épidémie de cas résistant au traitement [
11]. Or, une étude du génome de la bactérie a révélé des polymorphismes de séquence caractéristiques [
12]. La famille de la souche Beijing a pu être subdivisée en quatre sous-groupes, mais une délétion caractéristique (RD105) est observée dans toutes les souches. Elle peut être un marqueur utile et faciliter une étude d’épidémiologie moléculaire. Ces souches sont largement répandues et hypervirulentes. Dans une recherche récente effectuée dans deux hôpitaux de Ho Chi Minh Ville, au Vietnam [
13], les auteurs ont mis en évidence une association significative de la souche Beijing avec l’infection par le VIH et l’occurrence de méningites tuberculeuses résistantes à tous les traitements. |
L’émergence de souches résistantes aux médicaments de seconde intention, appelées XDR (extensive or extreme drug resistant tuberculosis), est notée dans une première enquête du CDC (Centers for Disease Control and Prevention) en mars 2006 [
14]. Des cas ultrarésistants sont décrits dans de nombreux pays. Afin d’évaluer la fréquence et la distribution de ces souches, un réseau international de laboratoires a, à l’initiative de l’OMS et du CDC, testé entre 2000 et 2004 les résistances de 17 690 isolats à l’INH et à la RIF, ainsi qu’à six médicaments de seconde ligne (aminoglycosides, polypeptides, fluoroquinones, cyclosérine, acide para-aminosalicylique). En définissant comme XDR les souches résistant à trois des produits de seconde ligne au moins, on trouvait 20 % de souches MDR, 2 % de souches XDR. Des résultats précis furent obtenus, concernant la proportion de souches XDR dans trois pays : États-Unis (4 %), Lettonie (19 %), Corée du Sud (15 %). En valeur absolue, c’est en Corée du Sud qu’a été identifié le plus grand nombre de ces souches (1 289), suivie par les pays d’Europe de l’Est et d’Asie de l’Ouest (ex-Union Soviétique). L’urgence s’imposait de trouver les moyens d’éviter la propagation de formes mortelles de tuberculose. Parallèlement, des épidémies moins massives ont été décrites en Iran, 113 cas MDR, dont 12 cas XDR [14], en Norvège, 2 284 cas MDR, dont 37 cas XDR [
16], à Lisbonne (Portugal) [
17] et au Pérou [
18]. Mais surtout, une flambée de formes mortelles de tuberculose en Afrique du Sud était signalée en août 2006 à Toronto durant le 16e Congrès international sur le Sida [
19] (dont les détails furent publiés ultérieurement dans le Lancet [
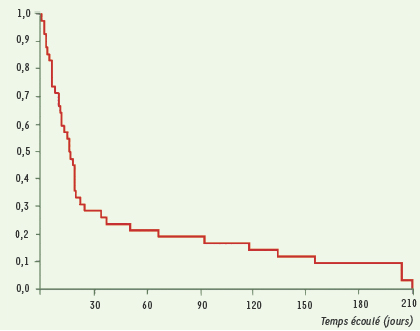
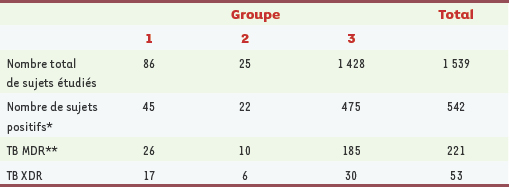
20]). Les faits avaient été observés dans la province rurale du KwaZulu Natal, dont 40 % de la population est séropositive pour le VIH. Malgré l’application du programme DOTS, de nombreuses formes actives de TB étaient observées : 1 539 patients, dont 221 étaient MDR et XDR (53 XDR) (Tableau II). Parmi ces derniers, 26 n’avaient jamais été traités auparavant, 28 avaient été récemment hospitalisés, et 44 au moins étaient co-infectés par le VIH ; 70 % des malades sont morts dans les 30 jours qui ont suivi le prélèvement (Figure 2). L’étude génotypique de la souche a montré, chez 39 d’entre eux, un génotype identique. L’étude rétrospective montre que cette prévalence est récente, de même que la résistance massive aux SLD. Le traitement standard appliqué dans ce pays comporte pendant deux mois une polythérapie (INH, RIF, éthambutol, pyrazinamide), puis deux médicaments pendant les quatre mois suivants. En fonction des résultats, les auteurs proposent un classement en trois catégories selon que les souches sont sensibles à tous les médicaments, résistantes à INH et RIF ou multirésistantes. Parmi les malades du groupe 3 (voir légende du Tableau II), il y avait deux membres de l’équipe soignante, alors que les autres provenaient de localités dispersées. Les hospitalisations récentes, l’atteinte du personnel soulèvent donc l’hypothèse d’une infection nosocomiale.  | Figure 2.
Survie des malades atteints de tuberculose XDR (n + 42) (d’après [ 20]). |
L’infection n’est pas restreinte à la population du Natal. Une publication du 18 octobre 2006 signale sa présence dans toutes les provinces de l’Afrique du Sud : 78 nouveaux cas au Natal, dont 74 dècès, soit 94, 8 % ; 9 cas dans le Gauteng, état le plus peuplé qui inclut Johannesburg et Prétoria ; 10 dans la province du nord-ouest ; 6 dans les provinces de l’Est, 3 au Limpopo [
21]. Au mois de novembre, la presse quotidienne d’Afrique du Sud (Mail Guardian online) rapporte de nombreux nouveaux cas XDR-TB, et, le 16 novembre, un cas létal est confirmé à Johannesburg même [
22]. 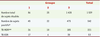 | Tableau II.
Répartition des formes de TB MDR et XDR en Afrique du Sud sur un total de 1539 patients. Les groupes de patients 1, 2 et 3 sont définis de la façon suivante : 1 539 patients ont été inclus entre janvier 2005 et mars 2006 et subdivisés en 3 groupes. Groupe 1 : tous les patients examinés pour lesquels une recherche bacillaire a été effectuée entre janvier et mai 2005. Ce groupe inclut des patients ayant une TB récurrente et la présence répétée de bacilles à l’examen cytologique des crachats. Groupe 2 : tous les patients hospitalisés pour TB et examinés en un seul jour de février 2005. Groupe 3 : tous les patients externes ou hospitalisés examinés entre juin 2005 et mars 2006 qui présentaient des symptômes cliniques de TB. Les catégories MDR et XDR sont définies, quant à elles, selon la sensibilité de la mycobactérie aux antibiotiques (testée in vitro). 1. Sensibilité ou résistance à un seul médicament de première ligne (non MDR). 2. Souches résistantes à l’INH et à la RIF (MDR). 3. Souches résistantes à l’INH et le RIF, ayant aussi une résistance aux fluoroquinones et soit aux aminoglycosides (amikacine, kanamycine), soit à la capréomycine, ou même aux deux (XDR) (d’après [ 20]). * Positivité déterminée par la recherche du bacille après culture des crachats. ** Les 221 patients atteints de TB MDR incluent les 53 cas de TB XDR. |
|
Réactions et perspectives L’ensemble de ces faits a justifié la réunion d’urgence en Afrique du Sud, les 6 et 7 septembre 2006, d’une conférence internationale avec participation de l’OMS et des représentants des différents pays africains affectés, puis au siège de l’OMS. Puis une conférence s’est tenue à Genève les 9 et 10 octobre 2006, où a été constituée The First Global XDR-TB Task Force dans le but de limiter l’expansion des souches XDR et de développer une réponse rapide à l’émergence d’un drame [
23]. L’examen critique des résultats de laboratoire, plus ou moins fiables selon les médicaments, a amené les participants à une révision partielle de la définition d’une souche XDR. Désormais sera appelée XDR TB la souche de M. tuberculosis résistante à l’INH, la RIF, une fluoroquinone, et à un au moins des trois autres produits injectables (amikacine, kanamycine, ou capréomycine). L’ensemble de ces données a été résumé au siège du CDC le 31 octobre 2006 lors de la 37e Conférence Mondiale de Pathologie Pulmonaire, sous le titre « From DOTS to DOTS Strategy. Extensively drug-resistant TB (XDR TB) Summary report » [
24]. Un rappel précis et détaillé des standards internationaux de traitement de la tuberculose a par ailleurs été publié par des responsables de San Francisco, de Montréal et de l’OMS [
25]. Enfin, le rappel du problème et de son extrême gravité, en même temps que les faits les plus importants, font l’objet d’un éditorial récent du Lancet afin que, si possible, nul n’en ignore… [
26]. |
Footnotes |
1. OMS. 53e Assemblée de l’Organisation Mondiale de la Santé, 5 mai 2000. Initiative Halte à la tuberculose. Rapport du Directeur général. Geneva : WHO, 2000. 2. Déclaration d’Amsterdam visant à faire barrage à la tuberculose, 24 mars 2000. Amsterdam (Pays-Bas), 2000. 3. Dooley SW, Jarvis WS, Martone WJ, Snider DE. Multidrug-resistant tuberculosis (éditorial). Ann Intern Med 1992; 117 : 257–8. 4. Villarino ME, Geiter LJ, Simone PM. The multidrug-resistant tuberculosis challenge to public health efforts to control tuberculosis. Center for Disease Control, Atlanta. Publ Health Rep 1992; 107 : 616–25. 5. OMS. Lutte contre la tuberculose dans la Région européenne de l’OMS. Aide-mémoire 07/02, Copenhague, 17 septembre 2002. 6. Bouvet E. Quels sont les problèmes posés par la tuberculose en France en 2003 ? Med Sci (Paris) 2003 : 19 : 1146–51. 7. OMS. Tuberculose. Centre des médias. Infection et transmission. Aide-mémoire n° 104, révisé en mars 2006. 8. Han LL, Sloutsky A, Canales R, et al. Acquisition of drug resistance in multidrug resistant Mycobacterium tuberculosis during directly observed empiric retreatment with standardized regimens. Int J Tuberc Lung Dis 2005; 9 : 818–21. 9. Bishop KS, Blumberg L, Trollip AP, et al. Characterisation of the pncA gene in Mycobacterium isolates from Gauteng, South Africa. Int J Tuberc Lung Dis 2001; 5 : 952–7. 10. European concerted action on new generation genetic markers and techniques for the epidemiology and control of tuberculosis. Emerg Infect Dis 2006; 12 : 736–43. 11. Hunsiff SS, Nivin B, Sacajiu G, et al. Persistence of a highly resistant strain of tuberculosis in New York City during 1990-1999. J Infect Dis 2003; 188 : 356–63. 12. Tsolaki AG, Gagneux S, Pym AS, et al. Genomic deletions classify Beijing/W strains as a distinct genetic lineage of Mycobacterium tuberculosis. J Clin Microbiol 2005; 43 : 3185–91. 13. Beijing genotype of Mycobacterium tuberculosis is significantly associated with human immunodeficiency virus infection and multidrug resistance in cases of tuberculous meningitis. J Clin Microbiol 2006; 44 : 3934–9. 14. MMWR (CDC). Emergence of Mycobacterium tuberculosis with extensive resistance to second-line drugs : worldwide, 2000-2004. Weekly 2006; 55 : 301–5. 15. Masjedi MR, Farnia P, Sorooch S, et al. Extensively drug-resistant tuberculosis : 2 years of surveillance in Iran. Clin Infect Dis 2006; 43 : 841–7. 16. Dahle UR. Extensively drug resistant tuberculosis. Beware patients lost in follow-up. Br Med J 2006; 333 : 7570–5. 17. Hannan MM, Peres H, Maltez F, et al. Investigation and control of a large outbreak of multi-drug resistant tuberculosis at a central Lisbon hospital. J Hosp Infect 2001; 47 : 91–7. 18. Campos PE, Suarez PG, Sanchez J, et al. Multi-drug resistant tuberculosis in HIV-infected persons, Peru. Emerg Infect Dis 2002; 9 : 1571–8. 19. Ghandi NR, Moll A, Pawinski R, et al. High prevalence and mortality from extensively-drug resistant (XDR) TB in TB/HIV coinfected patients in rural South Africa. Abstracts of the 16th international AIDS conference, 13-18 August 2006. Toronto, Canada : International Aids Society, 2006 (abstract THLB0210.) 20. Ghandi NR, Moll A, Sturm AW, et al. Extensively drug-resistant tuberculosis as a cause of death in patients co-infected with tuberculosis and HIV in a rural area of South Africa. Lancet 2006; 368 : 1575–80. 21. Deadly TB found in all nine provinces of SA. Business Day (Johannesburg) 18 octobre 2006. 22. Jenkins R. Case of extremely drug resistant TB confirmed in Johannesburg. Health News 14 septembre 2006. 23. MMWR (CDC). Notice to readers: revised definition of extensively drug-resistant tuberculosis. Weekly 2006; 55 : 1176. 24. From DOTS to DOTS strategy. 37th Union World Conference on Lung Health, 31 octobre 2006. Extensively drug-resistant TB (XDR) Summary report by Castro KG, for the first global XDR TB task force. 9-10 octobre 2006, Geneva, Switzerland. Atlanta : Center for Disease control and prevention. US Department of health and human services. 25. Hopewell PC, Pal M, Maher D, et al. International standards for tuberculosis care. Lancet Infect Dis 2006; 6 : 710–25. 26. The tuberculosis X factor. Lancet Infect Dis 2006; 6 : 679. |