| |
| Med Sci (Paris). 2007 February; 23(2): 151–160. Published online 2007 February 15. doi: 10.1051/medsci/2007232151.Hématopoïèse humaine : des cellules CD34 aux lymphocytes T Marina Cavazzana-Calvo,1* Emmanuelle Six,1 Isabelle André-Schmutz,1 and Laure Coulombel2 1Département de Biothérapie, Hôpital Necker-Enfants-Malades, Inserm U768, 149, rue de Sèvres, 75015 Paris, France 2Inserm U602, Hôpital Paul-Brousse, 12, avenue Paul Vaillant Couturier, 94800 Villejuif, France |
De la moelle osseuse au thymus : caractéristiques phénotypiques des précurseurs lymphoïdes humains Il est aujourd’hui établi que les CSH donnent naissance à toutes les lignées sanguines au cours d’un processus de différenciation qui s’accompagne d’une perte graduelle de leur multipotentialité et de leur capacité d’autorenouvellement. Appliquer ce schéma à la différenciation lymphocytaire T revient à poser un certain nombre de questions portant sur la ségrégation précoce entre lignées myéloïdes (érythroïde, mégacaryocytaire et granulomacrophagique) et lymphoïdes, sur la nature du (des) progéniteur(s) issu(s) du foie fœtal ou de la moelle osseuse qui colonise(nt) le thymus et devrai(en)t donc être retrouvé(s) dans la circulation et, enfin, sur les variations possibles de ces processus au cours de l’ontogenèse, ainsi que sur les modifications de l’engagement des CSH dans la voie T avec le veillissement de l’individu. Chez la souris, les travaux publiés par le groupe de Weissman l’ont conduit à proposer un modèle de ségrégation précoce entre spécification myéloïde et lymphoïde qui, si elle fait autorité, ne fait pas l’unanimité, des données récentes suggérant que d’autres voies de différenciation d’une CSH vers les lignées lymphoïdes existent. Ce groupe a identifié dans la moelle osseuse de souris adulte, et isolé sur des critères phénotypiques, un progéniteur myéloïde commun appelé CMP1 [
1] et un progéniteur lymphoïde commun nommé CLP [
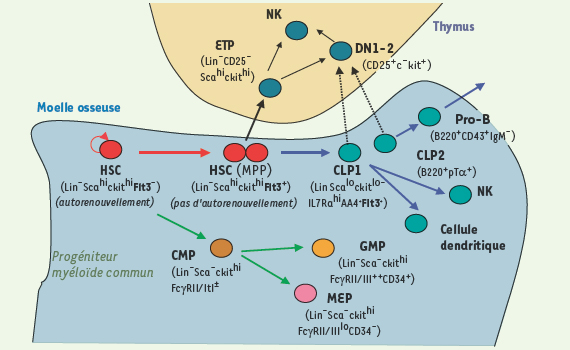
2]. Le potentiel du premier est restreint aux lignées myéloïdes, tandis que le second se différencie uniquement en lymphocytes T, B et NK (Figure 1).  | Figure 1.
Différenciation hématopoïétique chez la souris. Chez la souris, l’analyse de l’expression de différents antigènes a permis d’isoler des populations distinctes de progéniteurs à partir de la moelle osseuse adulte. L’évaluation de leur fonction par des tests robustes réalisés aussi bien in vitro qu’in vivo a permis de proposer la hiérarchie schématisée ici. Dans le compartiment des cellules souches (rouge), on distingue 3 types de cellules selon qu’elles s’autorenouvellent ou pas et reconstituent ou non, à long ou à court terme, l’hématopoïèse. On distingue 2 populations de CLP (vert), CLP1 et CLP2, CLP2 étant isolé à partir des souris knock-in pour le gène pré-Tα. In vivo, ces populations n’ont pratiquement pas de potentiel T, alors que l’on peut le démontrer in vitro. Une controverse persiste sur la nature des cellules qui migrent dans le thymus (voir Figure 2). Les CMP (marron) donnent naissance aux progéniteurs granulomacrophagiques (GMP, orange) et mégacaryocytaires-érythroïdes (MEP, rose). |
Une telle analyse chez l’homme se heurte à de nombreux obstacles : nombre restreint de marqueurs de membrane, et donc d’anticorps monoclonaux reconnaissant les progéniteurs lymphoïdes, faible spécificité de l’antigène CD34, effectivement exprimé par tous les progéniteurs hématopoïétiques et, enfin, absence d’un test expérimental fiable capable d’évaluer la différenciation T à l’échelon clonal. Le groupe de Weissman a néanmoins caractérisé chez l’homme un progéniteur myéloïde commun (CD34+ IL-3R± CD45RA−) capable de donner naissance d’une part aux progéniteurs bipotents granulocytaires/monocytaires et, d’autre part, aux progéniteurs bipotents mégacaryocytaires/érythrocytaires. Ce progéniteur est dépourvu de tous les marqueurs précoces de la lignée T et incapable (ou seulement très faiblement) de donner naissance in vitro à des cellules B ou NK, le potentiel T n’ayant pas été étudié [
3]. De nombreuses équipes ont tenté de caractériser le compartiment des progéniteurs T humains et, outre l’antigène CD34, trois antigènes se sont révélés particulièrement utiles : CD45RA, CD7 et CD10 (ou CALLA, endopeptidase neutre). Aucun n’est, à lui seul, spécifique de progéniteurs T, mais leur combinaison peut identifier une fraction significativement enrichie. Ainsi, Galy a démontré que l’expression du CD45RA sur des cellules CD34+ de moelle osseuse adulte ou fœtale (20-23 semaines) était associée à la perte du potentiel de reconstitution hématopoïétique à long terme et du potentiel érythroïde [
4,
5], et que l’acquisition du CD10 définissait une fraction ayant un potentiel strictement lymphoïde, capable de produire in vitro, à l’échelon unicellulaire, des cellules B, NK et dendritiques et, in vivo, chez la souris immunodéficiente NOD/SCID greffée avec du tissu thymique humain, des lymphocytes T. Cette population (CD34+CD45RA+CD10+) présente des similitudes fonctionnelles avec celle décrite par Ryan et ses collaborateurs, qui exprime en plus la chaîne α du récepteur de l’IL-7 (IL-7Rα) [
6], et avec celle identifiée dans le sang de cordon par Hao et ses collaborateurs, qui présente le phénotype CD34+CD38-CD45RA+ HLADR+CD7+, mais n’exprime pas l’IL-7Rα. Si ce phénotype associé à la détection de transcrits codant pour des facteurs de transcription propres à la lignée lymphoïde suggère que l’on est bien en présence de progéniteurs lymphoïdes, le potentiel T n’a que rarement été détecté de façon convaincante [
7]. Plus récemment, l’analyse a été affinée par l’équipe de Canque, qui montre que l’expression du CD7+ sur les progéniteurs CD34+ du sang de cordon reflète un engagement vers la différenciation T/NK, contrairement au phénotype CD34+CD10+ indicateur, lui, d’un potentiel majoritairement lymphocytaire B [
8]. Aujourd’hui, il est donc acquis que les progéniteurs lymphoïdes de la moelle osseuse adulte et du sang de cordon ségrègent dans une fraction CD34+ CD45RA+, et que l’expression de combinaisons différentes des antigènes CD10, CD7 et IL-7Rα augmente l’enrichissement en progéniteurs B ou T. Toutefois, seule la population CD7+ a été retrouvée dans le thymus fœtal. On ne sait rien pour l’instant du potentiel de circulation et de colonisation thymique de ce progéniteur lymphoïde après la naissance. Il reste à définir plus précisément les différentes étapes de la lymphopoïèse humaine fœtale et adulte, la filiation entre les différents progéniteurs CD10+ et CD7+, à prouver à l’échelon unicellulaire la capacité de ces progéniteurs à donner naissance simultanément à des lymphocytes T, B et NK et, éventuellement, à des cellules dendritiques, au moins de type plasmacytoïde. Deux observations rendent optimistes quant à la progression rapide de nos connaissances. La première, d’ordre technique, consiste en la mise au point d’une méthode très reproductive d’obtention de lymphocytes T humain in vitro. En effet, grâce à l’utilisation d’une lignée stromale OP9 surexprimant le ligand de Notch, Delta 1, il est maintenant possible d’obtenir une différenciation lymphoïde T humaine in vitro à partir de cellules souches CD34+ du sang de cordon ou de la moelle osseuse [
9,
10]. Ce système de coculture constitue une avancée majeure, qui permet le suivi des étapes de la différenciation T et la production, au bout de 5 semaines, de lymphocytes T matures et fonctionnels. La seconde avancée est représentée par la découverte de nouvelles cytokines hématopoïétiques telles que l’IL -7, la TSLP et les interleukines 15 et 21, qui permettent de cloner certaines sous-populations lymphoïdes. |
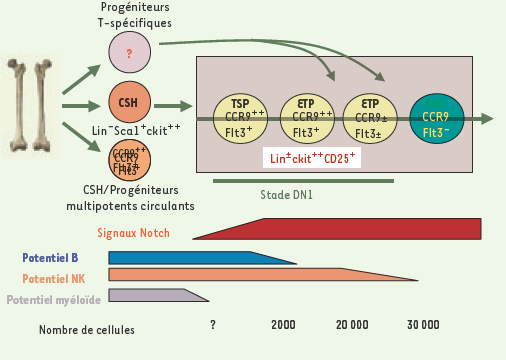
Développement des lymphocytes T humains : des progéniteurs médullaires colonisant le thymus aux cellules double-positives Colonisation thymique Nos connaissances des mécanismes contrôlant la migration des progéniteurs hématopoïétiques du foie foetal ou de la moelle osseuse au thymus et de la nature de ces progéniteurs sont encore très fragmentaires. On ignore en particulier si cette colonisation se fait au hasard ou spécifiquement en réponse à des signaux de guidage, et si elle concerne des progéniteurs encore multipotents ou déjà engagés dans la voie lymphoïde avant de pénétrer dans le thymus. Dans le cas où ces cellules ne seraient plus multipotentes, ce qui suggérerait que l’engagement lymphoïde T interviendrait dans la moelle osseuse ou très précocement dans le thymus, la question de sa reconnaissance reste ouverte (Figure 2). 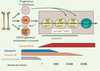 | Figure 2.
Colonisation et étapes très précoces du développement thymocytaire. Les résultats récents publiés dans la littérature n’ont pas déterminé de façon consensuelle la nature des cellules issues de la moelle osseuse qui colonisent le thymus : il pourrait s’agir de cellules souches véritables, de progéniteurs ETP, déjà engagés dans la voie T, ou de cellules d’une autre nature, dites TSP. À l’entrée dans le thymus, le potentiel B (et myéloïde résiduel) est rapidement perdu, conséquence de l’interaction des progéniteurs, exprimant Notch1, avec les ligands de Notch ; le potentiel NK persiste un peu plus longtemps. Seuls les événements initiaux du développement T, concernant des progéniteurs double négatifs DN1 (ckit ++, CD25 +, Lin −), sont indiqués. Des antigènes tels que CCR9 (récepteur de chimiokine) et Flt3 peuvent peut-être permettre de distinguer ces populations DN1 (d’après [
36]). |
L’étude du développement lymphoïde au cours de l’embryogenèse nous a appris plusieurs faits importants. Le principal est que la colonisation du thymus n’est pas un événement « continu », mais se déroule par vagues successives : une première vague survient avant l’établissement de la vascularisation thymique (avant J14 de la vie embryonnaire chez la souris et la 8e semaine de gestation chez l’homme), et une deuxième vague une fois la vascularisation thymique établie. La première phase de migration est assurée, chez la souris, par divers couples de récepteurs des chimiokines et leurs ligands : CCR9/CCL25 et CCL21/CCR7 [
11,
12], qui ont un rôle de premier plan, et CXCL11 et C3CL1, à un degré moindre ; en revanche, le rôle de CXCL12/CXCR4 dans ce processus ne serait que marginal. Une fois la vascularisation du thymus mise en place, différentes intégrines et molécules d’adhérence interviennent : le couple de molécules P-sélectine/PSGL-1, la première exprimée sur l’endothélium thymique et la seconde sur les progéniteurs circulants, semble indispensable à l’entrée des progéniteurs murins dans le thymus [
13]. Néanmoins, l’inhibition seulement partielle de la colonisation thymique par un anticorps anti-P-sélectine suggère que d’autres couples intégrines/ligands participent à ce processus : parmi eux, αLβ2/ICAM1 et α4β1/VCAM semblent participer à la colonisation thymique chez la souris [
14]. Moins nombreuses et souvent contradictoires sont les informations concernant les molécules impliquées dans ce processus chez l’homme. Chez ce dernier, les thymocytes fœtaux immatures semblent exprimer préférentiellement les récepteurs CXCR4 et, plus faiblement, CCR9 [
15], et il semble que l’acquisition du récepteur CXCR4 sur les cellules CD34+ de la moelle osseuse s’accompagne de la perte du potentiel myéloïde et d’une restriction du développement aux lymphocytes T et B [
16]. Ces données, concordantes avec celles obtenues par Haddad et ses collaborateurs sur les thymocytes fœtaux, sont en contradiction avec celles publiées par Hernandez-Lopez et ses collaborateurs [
17], qui montrent que les progéniteurs thymiques CD1a négatifs n’expriment pas ce récepteur. Il est intéressant de noter que les patients atteints de mutations du gène CXCR4 (syndrome WHIM) présentent une lymphopénie T, avec un nombre réduit de cellules T naïves, vraisemblablement due à une altération de la sortie des lymphocytes T matures du thymus. Cette voie ne semble pas modifier la migration du CLP dans le thymus [17–
19]. La connaissance détaillée de ce processus nous permettrait d’envisager l’utilisation in vivo de certaines de ces chimiokines pour améliorer la colonisation du thymus au décours, par exemple, d’une greffe allogénique. Le niveau de différenciation des progéniteurs qui colonisent le thymus reste controversé, et il semble que plusieurs populations puissent coloniser le thymus. Chez la souris, il s’agirait de CSH vraies, c’est-à-dire capables de reconstitution hématopoïétique à long terme in vivo, mais également de progéniteurs lymphoïdes précoces [12,
20–
22]. En revanche, un certain consensus existe sur le fait que, in vivo, le CLP ne colonise pas de façon majeure le thymus, son potentiel T s’exprimant surtout in vitro. Chez l’homme, le thymus pourrait également être colonisé par des progéniteurs multipotents [
18] ou par un progéniteur lymphoïde commun capable de donner naissance exclusivement à des cellules B, NK et dendritiques, comme cela a été montré pendant la période fœtale [15] et, d’une façon moins complète, dans le sang de cordon [7, 8] (Figure 2). Il n’existe cependant aucune information sur l’identité et la caractérisation des progéniteurs qui colonisent le thymus après la naissance et pendant la vie adulte, et leur présence simultanée dans la circulation et dans le thymus n’a jamais été démontrée. La description d’un tel progéniteur circulant nous permettrait de l’isoler et de l’amplifier dans un but thérapeutique, par analogie avec l’amplification des progéniteurs myéloïdes mobilisés après administration de G-CSF [19]. Différenciation intrathymique La dissection des sous-populations de progéniteurs thymiques immatures est également beaucoup plus précise chez la souris que chez l’homme : par exemple, on distingue 4 fractions de précurseurs thymiques immatures (doubles négatifs, DN) DN1-4 selon l’expression des antigènes CD25 et CD44, distinction qui n’existe pas chez l’homme, où ces antigènes ne sont pas exprimés selon cette hiérarchie. La population DN1 conserve un potentiel lymphoïde multiple et un potentiel myéloïde résiduel, tous deux s’éteignant aux stades DN2. Chez l’homme, c’est l’antigène CD1a qui distingue le passage d’un progéniteur thymique très immature (CD34 +CD38 -) à un progéniteur clairement engagé dans la voie T. Selon le schéma proposé par le groupe de Canque, la population thymique fœtale plus immature (CD34 + CD38 +/faible, CD1a -) est encore capable de se différencier en lymphocytes B, NK et en cellules dendritiques avec une très faible capacité myéloïde [ 15]. Cette population, dont le gène codant le récepteur T de l’antigène (TCR) n’est pas réarrangé, pourrait co-exprimer les antigènes CD10 et CD7 [ 7]. L’acquisition du CD1a est contemporaine de la perte de potentiels autres que lymphocytaire T. Le stade suivant correspond à l’expression de l’antigène CD4, stade immature simple positif (ISP-CD4), et peut être ultérieurement divisé en deux sous-populations selon l’intensité d’expression du CD1a ; elle donne naissance à des cellules doubles positives (DP, coexprimant CD4 et CD8) [
25–
27]. Chez l’homme, deux stades de développement DP sont reconnaissables (CD4 + CD8α +β- CD3 − ⇒ CD4 + CD8α +β+ CD3 −), qui précèdent l’expression membranaire du CD3 [ 20]. Pendant les étapes précoces du développement T, les locus du TCR réarrangent d’une manière séquentielle TCR δ>γ>β>α, sans que l’on puisse définir avec précision dans quels précurseurs ces événements ont lieu, plusieurs données suggérant que la sélection des réarrangements productifs du TCRβ et la β-sélection pourraient déjà commencer au stade ISP-CD4 et ne seraient pas étroitement associées à l’expression membranaire du CD4 ou CD8 [
21]. Si l’expression du CD1a est corrélée chez l’homme avec l’engagement T exclusif, la décision de devenir un lymphocyte αβ ou γδ ne se fait pas, comme chez la souris, au moment de la co-expression des antigènes CD4 et CD8. En effet, le potentiel de donner naissance à des lymphocytes γδ persiste au moins jusqu’au stade DP précoce (CD4+ CD8α+β- CD3−). Le développement en lymphocytes Tγδ chez l’homme se présente comme une voie de différenciation par défaut [22], et le développement αβ versus γδ est principalement influencé par la succession des réarrangements des gènes du TCR et par l’expression d’un TCR fonctionnel [22]. Les facteurs et les voies de signalisation impliqués dans l’accessibilité de ces différents locus du TCR sont, en revanche, encore à définir. |
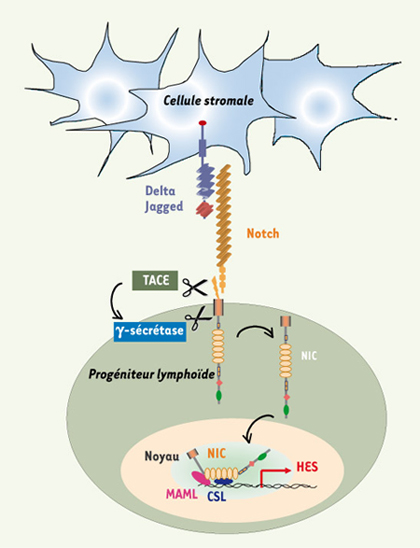
Contrôle moléculaire du développement lymphocytaire T humain La spécification des CSH en progéniteurs lymphoïdes est finement régulée par l’expression coordonnée dans le temps des facteurs de transcription, dont la fonction n’est pas seulement liée à la formation de complexes protéiques multimériques, mais également aux variations de dose de chaque facteur isolément. Certains, comme Ikaros, E2A ou PU.1, sont nécessaires à l’expression d’une potentialité lymphoïde sans que leur expression ne soit restreinte à l’une ou l’autre de ces lignées. D’autres, plus spécifiques, agissent en aval, restreignant la différenciation dans la lignée B (EBF et Pax5), ou T (GATA-3, TCF1, RORγ) (pour ne citer que les principaux). Ainsi, un schéma assez consensuel aujourd’hui distingue une première phase de « permissivité lymphoïde », réversible, et une seconde, au cours de laquelle le progéniteur s’engage dans une voie précise, restreignant ainsi son potentiel, et complète toutes les étapes jusqu’au lymphocyte fonctionnel. Ces facteurs de transcription sont eux-mêmes induits par des signaux de l’environnement, parmi lesquels les ligands de Notch occupent une place essentielle. En effet, ils ont un rôle déterminant dans l’orientation T versus B d’un progéniteur lymphoïde commun, et peut-être même d’une cellule souche. Quatre récepteurs Notch, codés par quatre gènes différents (Notch 1-4), et cinq ligands de Notch ont été caractérisés (Jagged 1, 2, Delta like 1, 3, 4). L’interaction entre Notch et son ligand induit deux coupures protéolytiques successives dans le récepteur Notch, la seconde (via un complexe ayant une activité γ-sécrétase) libérant un fragment intracytoplasmique qui migre dans le noyau, déplace les corépresseurs associés à CSL/RBP-Jk et recrute un troisième partenaire Mastermind. Ce complexe est un activateur transcriptionnel (Figure 3) dont les cibles principales sont les gènes Hes-1 (bHLH) et Deltex-1, chacun contrôlant en aval ses propres cibles. La nature du ligand et sa concentration sont deux paramètres importants de cette voie transcriptionelle. Jagged 1 et 2, par exemple, sont exprimés sur les cellules stromales de la moelle osseuse et du foie fœtal, ainsi que dans l’épithélium thymique et certaines sous-populations cellulaires du sytème lymphohématopoïétique. En revanche, les ligands Delta-1 et Delta-4 sont fortement et exclusivement exprimés dans le thymus. Cette distribution explique probablement en partie l’absence de différenciation T dans la moelle osseuse, car la signalisation Notch n’y est pas activée à un niveau suffisant pour engager ce processus ; en revanche, le développement B, qui est inhibé par un signal Notch fort, y est efficace. 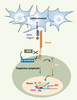 | Figure 3.
Cascade protéolytique déclenchée par l’interaction du récepteur Notch activé par son ligand. L’interaction entre le récepteur Notch et son ligand Delta ou Jagged induit deux clivages protéolytiques successifs : le premier réalisé par la métalloprotéase TACE, suivi par un deuxième clivage intramembranaire par l’activité γ-sécrétase. Ce dernier clivage libère la région intracellulaire du récepteur, NIC, transportée dans le noyau où elle forme un complexe activateur de la transcription avec les protéines CSL et MAML (Mastermind), activant la transcription des gènes cibles de la famille HES. |
La situation est inverse dans le thymus. Les données des modèles de surexpression des ligands ou de la forme activée de Notch1 dans les CSH, ainsi que celles provenant des modèles où Notch est inactivé dans le thymus, confirment le rôle primordial de cette voie de signalisation dans la dichotomie T/B. D’une façon générale, l’interaction Notch1/Delta-1/4 est essentielle aux stades initiaux de la thymopoïèse (stades DN), mais diminue ensuite à partir du stade DP et reste mal connue dans les étapes plus tardives (Figure 2). Curieusement, on sait très peu de choses des cibles directes de Notch activé, de CSL/RBPJ-k ou de leur gène cible Hes-1 dans le système lymphoïde. La coopération complexe entre le facteur de transcription E2A et Notch, décrite chez la souris pendant le développement fœtal, doit encore être validée chez l’homme à l’âge adulte [
23]. L’action de Notch dans le système hématopoïétique est ultérieurement compliquée par le fait que ce facteur de transcription n’agit pas seulement comme activateur du programme de différenciation T spécifique, mais également comme répresseur ou modulateur d’autres facteurs de transcription, induisant ainsi l’inhibition de la lymphopoïèse B, ainsi que celle de la myélopoïèse [
31–
33]. Un autre facteur de transcription clé dans le développement T est GAT A-3, membre de la famille des facteurs de transcription se liant au motif consensus GATA grâce à un domaine très conservé à doigt de zinc [
24]. Plusieurs travaux rapportent l’expression de GATA-3 exclusivement dans la lignée T. Chez l’homme, son expression à l’aide d’un rétrovirus dans un système de culture ex vivo a démontré que l’hyperexpression non régulée de GATA-3 augmente la différenciation précoce des thymocytes vers le stade DP, et entraîne une cellularité thymique réduite des précurseurs plus engagés, par augmentation de leur apoptose. Cette hypocellularité est à mettre en relation avec l’incapacité de ces précurseurs T à exprimer une chaîne TCRβ fonctionnelle à leur surface, soulignant à nouveau l’importance de la régulation précise de la dose de chaque facteur tout au long de la différenciation T [25]. Il reste à vérifier si ces résultats sont pertinents en physiologie humaine, car ils sont en contradiction avec les données recueillies chez la souris, qui plaident en faveur d’un rôle majeur du facteur de transcription GATA-3 dans l’expression du TCRβ et dans la signalisation via le pré-TCR. D’autres facteurs de transcription de la famille HOX semblent intervenir dans le développement T chez l’homme, comme cela a été indirectement prouvé par l’étude des translocations décrites dans certaines leucémies aiguës chez l’homme ; leur rôle physiologique reste cependant mal connu. |
Développement lymphocytaire T et pathologie humaine Déficits immunitaires primitifs Les déficits immunitaires combinés sévères (DICS) représentent un groupe hétérogène de pathologies caractérisées par un blocage précoce et profond du développement lymphocytaire T. Bien que l’absence des lymphocytes T matures s’accompagne invariablement d’un déficit de l’immunité humorale, seules 5 des 10 formes génétiquement caractérisées se traduisent par une absence ou une diminution importante, et exclusive, des lymphocytes T. Il s’agit des mutations de la chaîne α du récepteur de l’IL-7 (IL-7Rα), de mutations du gène CD45 et, enfin, des mutations des sous-unités de signalisation du complexe CD3 pré-TCR et CD3/TCR : CD3ε et δ. Les conséquences biologiques de ces mutations, aujourd’hui bien connues chez l’homme, définissent le rôle différent de ces molécules dans le développement T. Ainsi, les patients porteurs de défauts de l’IL-7Rα ont une absence complète de lymphocytes T, mais un nombre normal de lymphocytes B et NK. Ce constat plaide contre un effet majeur de l’IL-7 sur la survie et la prolifération du précurseur lymphoïde commun humain et sur la survie et la différenciation des cellules B immatures. Néanmoins, il ne permet pas d’exclure la présence de défauts quantitatifs du compartiment pro-B, que masque la prolifération des lymphocytes B matures. L’étude de la lymphopoïèse B humaine chez ces malades pourrait éclaircir ce point. L’IL-7, outre son action sur la survie et la prolifération des thymocytes DN, exerce un rôle direct dans l’induction des réarrangements de la chaîne γ du TCR : elle augmente l’acétylation des histones et l’accessibilité du locus [
26], et contribue également au réarrangement du locus [27]. D’une façon similaire, aucun rôle de la chaîne γ commune (γc) du récepteur des cytokines hématopoïétiques n’est attendu dans la formation du CLP chez l’homme, compte tenu de la présence dans la moelle osseuse des patients porteurs de mutations d’un pourcentage normal de précurseurs lymphoïdes CD10+ (Isabelle André-Schmutz, données non publiées). En revanche, cette chaîne joue un rôle majeur dans le développement lymphocytaire T et NK ; l’arrêt de la maturation lymphocytaire T est en effet dû à l’absence de signalisation via le récepteur spécifique de l’IL-7, formé des deux sous-unités α et γc [
28]. Leucémies aiguës lymphoblastiques de la lignée T (LAL-T) La leucémie lymphoblastique aiguë de type T (LAL-T) est une maladie hématologique maligne agressive qui affecte surtout les enfants, plus rarement les adultes, avec une incidence globale de 4/100 000, et 450 nouveaux cas chaque année en France. La transformation leucémique des thymocytes est un processus mutagénique multi-étapes, avec de nombreuses altérations génétiques conduisant, dans une cellule normale, à un événement transformant qui induit une croissance cellulaire non contrôlée, et donc une expansion clonale prédominante. L’événement leucémique pouvant survenir à différents stades de la différenciation thymique, le phénotype des LAL-T correspond à ces différents stades [
29]. L’analyse cytogénétique et le clonage moléculaire des points de cassure qui caractérisent les translocations chromosomiques propres aux LAL-T ont permis la découverte des protéines régulatrices de la transcription exprimées d’une façon anormale dans les blastes leucémiques. Parmi les altérations génétiques, une forte prévalence des mutations activatrices du gène Notch a été mise en évidence [
30]. Historiquement, Notch a été caractérisé grâce à l’identification du point de cassure impliqué dans la translocation (7 ; 9) (p 34 ; p 34.3), qui juxtapose un gène Notch 1 tronqué au locus TCRB et induit ainsi l’expression aberrante d’une forme intracellulaire continuellement active de Notch 1 [31]. Ce n’est que 15 ans plus tard que l’on a réalisé que des mutations activatrices du gène Notch étaient présentes chez plus de 50 % des patients ayant une LAL-T ou un lymphome, faisant ainsi de Notch l’oncogène à la prévalence la plus élevée dans la pathogenèse de cette maladie maligne, et confirmant les données expérimentales observées chez la souris lors de la surexpression de Notch activé dans les CSH. Plus généralement, la grande majorité des translocations décrites dans les LAL-T se caractérisent par la juxtaposition des promoteurs et des enhancers des gènes du TCR, avec un nombre relativement modeste de gènes codant pour des facteurs de transcription importants dans le développement, dont MYC, le groupe des gènes HOXA, HOX11, XO11L2, TAL1, TAL2, LYL1, LMO1 et LMO2. Parmi ceux-ci, seuls les gènes HOXA10 et HOXA11 sont exprimés dans les thymocytes au cours du développement, suggérant une fonction physiologique au cours du développement T. Les autres facteurs de transcription exercent leur fonction oncogénique en interférant avec l’expression des facteurs T spécifiques, une situation qui a été relativement bien décrite pour les translocations concernant TAL1 [
32] et LMO2 [33]. La fonction des gènes de la famille HOX au cours de ce processus doit encore être décrite. |
Applications thérapeutiques La description détaillée des nouvelles formes de DICS, la découverte du rôle clé joué par le récepteur Notch 1 dans l’engagement T et dans la physiopathologie des LAL de type T, ainsi que la description de la dynamique de colonisation du thymus sont autant de découvertes nous permettant d’espérer pouvoir utiliser, dans la pratique médicale, les progéniteurs lymphoïdes ou les molécules stimulant leur spécification/prolifération. Bloquer une activation excessive de la voie Notch La grande fréquence des mutations de Notch 1 dans les LAL-T fait de cette voie de signalisation une cible idéale pour une intervention pharmacologique. Théoriquement, cette voie de signalisation pourrait être utilisée à différents niveaux : interaction avec le ligand, endocytose, protéolyse ou activité transcriptionnelle. En pratique, des petites molécules inhibitrices du complexe γ-sécrétase qui inhibent la libération du fragment intracytoplasmique activé de Notch représentent l’approche thérapeutique la plus réaliste, étant donné les modalités disponibles d’administration des médicaments. Néanmoins, un certain nombre de problèmes liés à la spécificité de cette approche doivent encore être résolus, et ces molécules ne sont utiles que si les mutations n’aboutissent pas à un clivage spontané du récepteur [
34,
35]. Une molécule inhibitrice de la γ-sécrétase est en cours de développement clinique, et un essai de phase I a débuté aux États-Unis. Stimuler la reconstitution immune Un des moyens d’accélérer la reconstitution immunitaire après greffe de CSH allogéniques partiellement compatible consisterait à exposer des progéniteurs multipotents à un ligand de Notch de type Delta-1 ou Delta-4 pendant quelques jours, afin de forcer l’engagement lymphocytaire T de ces progéniteurs, et de réinjecter ces cellules par voie intraveineuse aux sujets greffés. Il est vrai qu’avant toute application clinique, il convient de démontrer que l’engagement T ne s’accompagne pas d’une perte de la capacité de migration de ces cellules dans le thymus, et de choisir un temps d’incubation suffisamment court pour éviter la sélection des cellules T porteuses de TCR pathologiques. Enfin, la connaissance détaillée de la niche lymphoïde pourrait permettre la mise au point de nouveaux conditionnements ciblés capables de la vider, ce qui permettrait d’éviter l’usage de la chimiothérapie et de la radiothérapie dans les protocoles de conditionnement précédant une greffe de CSH, prévenant ainsi la toxicité qui lui est associée. |
La caractérisation de précurseurs lymphoïdes humains et la découverte de l’action physiologique et pathologique de la voie Notch ouvrent la voie à des interventions thérapeutiques innovantes, qui devraient améliorer le pronostic des LAL et les résultats cliniques des greffes de CSH. Les progrès biologiques sont en train de transformer notre pratique médicale et de faire évoluer notre approche thérapeutique.

|
Nos remerciements vont à l’Action concertée « Biothérapie » de l’Inserm - U768 (AIP Cellules Souches - Appel à projets 2003 « Les progéniteurs lymphoïdes : de l’identification des mécanismes fondamentaux de leur génération et amplification aux applications thérapeutiques »), au département de Biothérapie, à l’Assistance publique-Hôpitaux de Paris et à Benedita Rocha et Alain Fischer pour les discussions scientifiques.
|
Footnotes |
1. Akashi K, Traver D, Miyamoto T, Weissman IL. A clonogenic common myeloid progenitor that gives rise to all myeloid lineages. Nature 2000; 404 : 193–7. 2. Kondo M, Weissman IL, Akashi K. Identification of clonogenic common lymphoid progenitors in mouse bone marrow. Cell 1997; 91 : 661–72. 3. Manz MG, Miyamoto T, Akashi K, Weissman IL. Prospective isolation of human clonogenic common myeloid progenitors. Proc Natl Acad Sci USA 2002; 99 : 11872–7. 4. Galy AH, Cen D, Travis M, et al. Delineation of T-progenitor cell activity within the CD34+ compartment of adult bone marrow. Blood 1995; 85 : 2770–8. 5. Galy A, Travis M, Cen D, Chen B. Human T, B, natural killer, and dendritic cells arise from a common bone marrow progenitor cell subset. Immunity 1995; 3 : 459–73. 6. Ryan DH, Nuccie BL, Ritterman I, Liesveld JL, et al. Expression of interleukin-7 receptor by lineage-negative human bone marrow progenitors with enhanced lymphoid proliferative potential and B-lineage differentiation capacity. Blood 1997; 89 : 929–40. 7. Hao QL, Zhu J, Price MA, et al. Identification of a novel, human multilymphoid progenitor in cord blood. Blood 2001; 97 : 3683–90. 8. Haddad R, Guardiola P, Izac B, et al. Molecular characterization of early human T/NK and B-lymphoid progenitor cells in umbilical cord blood. Blood 2004; 104 : 3918–26. 9. La Motte-Mohs RN, Herer E, Zuniga-Pflucker JC. Induction of T-cell development from human cord blood hematopoietic stem cells by Delta-like 1 in vitro. Blood 2005; 105 : 1431–9. 10. De Smedt M, Hoebeke I, Plum J. Human bone marrow CD34+ progenitor cells mature to T cells on OP9-DL1 stromal cell line without thymus microenvironment. Blood Cells Mol Dis 2004; 33 : 227–32. 11. Ara T, Itoi M, Kawabata K, et al. A role of CXC chemokine ligand 12/stromal cell-derived factor-1/pre-B cell growth stimulating factor and its receptor CXCR4 in fetal and adult T cell development in vivo. J Immunol 2003; 170 : 4649–55. 12. Liu C, Ueno T, Kuse S, et al. The role of CCL21 in recruitment of T-precursor cells to fetal thymi. Blood 2005; 105 : 31–9. 13. Rossi FM, Corbel SY, Merzaban JS, et al. Recruitment of adult thymic progenitors is regulated by P-selectin and its ligand PSGL-1. Nat Immunol 2005; 6 : 626–34. 14. Scimone ML, Aifantis I, Apostolou I, et al. A multistep adhesion cascade for lymphoid progenitor cell homing to the thymus. Proc Natl Acad Sci USA 2006; 103 : 7006–11. 15. Haddad R, Guimiot F, Six E, et al. Dynamics of thymus-colonizing cells during human development. Immunity 2006; 24 : 217–30. 16. Ishii T, Nishihara M, Ma F, et al. Expression of stromal cell-derived factor-1/pre-B cell growth-stimulating factor receptor, CXC chemokine receptor 4, on CD34+ human bone marrow cells is a phenotypic alteration for committed lymphoid progenitors. J Immunol 1999; 163 : 3612–20. 17. Hernandez-Lopez C, Varas A, Sacedon R, et al. Stromal cell-derived factor 1/CXCR4 signaling is critical for early human T-cell development. Blood 2002; 99 : 546–54. 18. Weerkamp F, Baert MR, Brugman MH, et al. Human thymus contains multipotent progenitors with T/B lymphoid, myeloid, and erythroid lineage potential. Blood 2006; 107 : 3131–7. 19. Reiffers J, Cailliot C, Dazey B, et al. Abrogation of post-myeloablative chemotherapy neutropenia by ex-vivo expanded autologous CD34-positive cells. Lancet 1999; 354 : 1092–3. 20. Hori T, Spits H. Clonal analysis of human CD4-CD8-CD3- thymocytes highly purified from postnatal thymus. J Immunol 1991; 146 : 2116–21. 21. Dick WA, Pike-Overzet K, Weerkampf F, et al. New insights on human T cell development by quantitative T cell receptor gene rearrangement studies and gene expression profiling. J Exp Med 2005; 201 : 1715–23. 22. Joachims ML, Chain JL, Hooker SW, et al. Human alpha beta and gamma delta thymocyte development : TCR gene rearrangements, intracellular TCR beta expression, and gamma delta developmental potential. Differences between men and mice. J Immunol 2006; 176 : 1543–52. 23. Rothenberg EV, Taghon T. Molecular genetics of T cell development. Annu Rev Immunol 2005; 23 : 601–49. 24. Orkin SH. GATA-binding transcription factors in hematopoietic cells. Blood 1992; 80 : 575–81. 25. Taghon T, De Smedt M, Stolz F, et al. Enforced expression of GATA-3 severely reduces human thymic cellularity. J Immunol 2001; 167 : 4468–75. 26. Schlissel MS, Durum SD, Muegge K. The interleukin 7 receptor is required for T cell receptor gamma locus accessibility to the V(D)J recombinase. J Exp Med 2000; 191 : 1045–50. 27. Muegge K, Vila MP, Durum SK. Interleukin-7 : a cofactor for V(D)J rearrangement of the T cell receptor beta gene. Science 1993; 261 : 93–5. 28. Gulino AV, Moratto D, Sozzani S, et al. Altered leukocyte response to CXCL12 in patients with warts, hypogammaglobulinemia, infections, myelokathexis (WHIM) syndrome. Blood 2004; 104 : 444–52. 29. Asnafi V, Buzyn A, Thomas X, et al. Impact of TCR status and genotype on outcome in adult T-cell acute lymphoblastic leukemia: a LALA-94 study. Blood 2005; 105 : 3072–8. 30. Weng AP, Ferrando AA, Lee W, et al. Activating mutations of Notch1 in human T cell acute lymphoblastic leukemia. Science 2004; 306 : 269–71. 31. Ellisen LW, Bird J, West DC, et al. TAN-1, the human homolog of the Drosophila
notch gene, is broken by chromosomal translocations in T lymphoblastic neoplasms. Cell 1991; 66 : 649–61. 32. Lecuyer E, Hoang T. SCL: from the origin of hematopoiesis to stem cells and leukemia. Exp Hematol 2004; 32 : 11–24. 33. McCormack MP, Rabbitts TH. Activation of the T-cell oncogene LMO2 after gene therapy for X-linked severe combined immunodeficiency. N Engl J Med 2004; 350 : 913–22. 34. Palomero T, Barnes KC, Real PJ, et al. CUTLL1, a novel human T-cell lymphoma cell line with t(7 ; 9) rearrangement, aberrant Notch1 activation and high sensitivity to gamma-secretase inhibitors. Leukemia 2006; 20 : 1279–87. 35. Grabher C, von Boehmer H, Look AT. Notch 1 activation in the molecular pathogenesis of T-cell acute lymphoblastic leukaemia. Nat Rev Cancer 2006; 6 : 347–59. 36. Zediak VP, Maillard I, Bhandoola A. Closer to the source: Notch and the nature of thymus-settling cells. Immunity 2005; 23 : 245–8. |