| |
| Med Sci (Paris). 2007 February; 23(2): 119–121. Published online 2007 February 15. doi: 10.1051/medsci/2007232119.La VE-cadhérine prend des chemins de traverse Julie Gavard* and J. Silvio Gutkind Oral and Pharyngeal Cancer Branch, National Institute of Dental and Craniofacial Research, National Institutes of Health, DHHS, Bethesda, Maryland 20892-4340, Etats-Unis MeSH keywords: Animaux, Antigènes CD, Cadhérines, Perméabilité capillaire, Vésicules tapissées de clathrine, Endocytose, Humains, Souris, Souris knockout, Modèles biologiques, Néovascularisation physiologique, Phosphorylation, Phosphosérine, Maturation post-traductionnelle des protéines, Protein-Serine-Threonine Kinases, Facteur de croissance endothéliale vasculaire de type A, Récepteur-2 au facteur croissance endothéliale vasculaire, p21-Activated Kinases |
L’angiogenèse est un processus développemental hautement régulé, qui correspond à la mise en place de nouveaux vaisseaux sanguins à partir de vaisseaux pré-existants, impliquant la croissance, la migration et l’organisation des cellules endothéliales, élément fondamental de la paroi vasculaire [
1]. Les VEGF (vascular endothelial growth factors) forment une famille unique de facteurs angiogéniques, la seule capable de provoquer une perte de l’étanchéité des vaisseaux sanguins (Figure 1). En effet, au-delà de son rôle essentiel au cours de l’angiogenèse, le VEGF a initialement été découvert comme un facteur de perméabilité vasculaire [
2]. Chez l’adulte, la dérèglement de l’expression du VEGF est impliquée dans une grande variété de conditions pathologiques, comme l’inflammation, les réactions thrombotiques, ainsi que la progression des cancers [
3]. Même si des progrès ont été réalisés dans la compréhension de la signalisation intracellulaire par laquelle le VEGF promeut la croissance, la survie et la migration endothéliale, comment le VEGF contrôle l’étanchéité vasculaire reste encore mal connu, plus de 20 ans après sa découverte [2]. Des études in vivo et in vitro avaient montré l’implication des tyrosine kinases de la famille Src dans l’augmentation de la perméabilité vasculaire par le VEGF, via la régulation des jonctions intercellulaires [
4–
6]. Parallèlement, l’ablation génétique de la VE-cadhérine ou l’inhibition de sa fonction adhésive augmente la perméabilité vasculaire [
7,
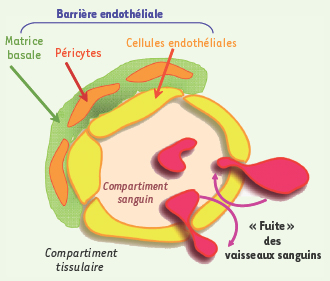
8]. Puisque la VE-cadhérine semble jouer un rôle clé dans le maintien de l’intégrité des vaisseaux sanguins, nous avons émis l’hypothèse selon laquelle l’augmentation de la perméabilité endothéliale pourrait résulter d’un démantèlement transitoire de l’adhérence dépendante de la VE-cadhérine.  | Figure 1.
Perméabilité vasculaire et conséquences pathologiques. La paroi vasculaire est formée par la barrière endothéliale, en interaction avec des cellules péricytes (par exemple: cellules musculaires lisses) et une matrice basale différenciée. L’augmentation de la perméabilité endothéliale participe à des fonctions physiologiques au cours de l’angiogenèse normale, du contrôle de réponses immunitaires ou de la pression vasculaire. Cependant, une grande variété de pathologies est associée à une perte de l’étanchéité de la barrière endothéliale permettant alors le passage non régulé de macromolécules, de fluides et de cellules depuis ou vers le compartiment sanguin, comme c’est le cas au cours de : œdème, hémorragies, angiogenèse tumorale, métastase, inflammation chronique ou aiguë, rétinopathies diabétiques… |
|
Quel est le devenir de la VE-cadhérine en réponse à la stimulation par le VEGF ? Nous avons suivi la localisation de la VE-cadhérine grâce à un anticorps capable de détecter son domaine extracellulaire lorsque celle-ci est exposée à la surface cellulaire, sans toutefois interférer avec sa fonction [
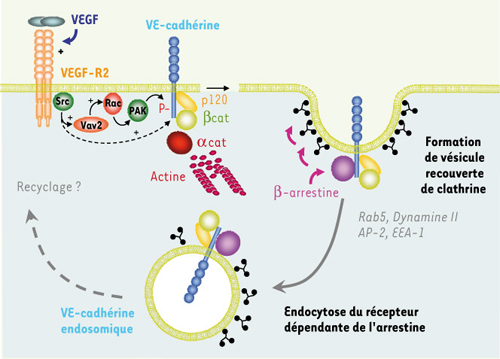
9]. Il s’avère que la VE-cadhérine est rapidement internalisée en réponse au VEGF dans des vésicules recouvertes de clathrine, et qui suivent le tri vésiculaire jusqu’à un compartiment de type endosome mature non lysosomal. En combinant l’utilisation de drogues pharmacologiques, de mutants et d’ARN interférants, nous avons pu décrypter la cascade de signalisation en aval du VEGF impliquée dans l’endocytose de la VE-cadhérine (Figure 2). De manière intéressante, cette voie est aussi requise dans l’augmentation de la perméabilité endothéliale induite par le VEGF, suggérant fortement que les deux événements sont corrélés.  | Figure 2.
Mécanismes moléculaires de l’endocytose de la VE-cadhérine. La stimulation du récepteur du VEGF (VEGF-R2) contrôle l’activation d’une pléthore de voies de signalisation intracellulaire. En particulier, la kinase Src est recrutée et activée par le VEGF-R2 et, à son tour, active Vav2 par phosphorylation sur tyrosine. Vav2 fonctionne comme une GEF ( G-protein exchange factor), c’est-à-dire une protéine d’échange du GDP en GTP capable d’augmenter l’activité de petites protéines G comme Rac. Rac actif contrôle alors la sérine/thréonine kinase, PAK ( p21 activated kinase). Cette cascade de signalisation aboutit à la phosphorylation par PAK de la VE-cadhérine sur un résidu conservé dans son domaine intracellulaire. Une fois phosphorylée, la VE-cadhérine recrute la β-arrestine, une protéine d’échafaudage des vésicules recouvertes de clathrine, entraînant ainsi la VE-cadhérine dans un compartiment endosomal. L’internalisation de la VE-cadhérine pourrait alors affaiblir l’adhérence des jonctions endothéliales, et par conséquent augmenter la perméabilité endothéliale (d’après [ 9]). |
|
L’endocytose de la VE-cadhérine est-elle un processus essentiel pour l’augmentation de la perméabilité vasculaire ? Nous avons identifié in silico la présence d’un site de phosphorylation par PAK (p21 activated kinase), unique et conservé, dans le domaine intracellulaire de la VE-cadhérine (sérine 665 de la séquence humaine) [9]. La construction de mutants ponctuels mimant la phosphorylation (S → D) ou au contraire l’abrogeant (S → V) révèle que l’endocytose de la VE-cadhérine est régulée par le statut de phosphorylation sur ce site. Enfin, dans un système de cellules endothéliales artificiellement dépourvues de VE-cadhérine, nous avons ré-exprimé soit la VE-cadhérine sauvage, soit les mutants de phosphorylation et étudié les propriétés de la barrière endothéliale. Il apparaît que l’absence de VE-cadhérine augmente per se la perméabilité de la barrière endothéliale, tandis que la ré-expression de la forme sauvage ou non-phosphorylable restaure son étanchéité [9]. L’expression du mutant constitutivement phosphorylable de la VE-cadhérine, en revanche, ne permet pas la formation d’une barrière endothéliale fonctionnelle. En conclusion, la régulation de l’endocytose de la VE-cadhérine par sa phosphorylation en position S665 influence directement les propriétés de perméabilité endothéliale, plaçant donc l’internalisation de la VE-cadhérine tôt dans la séquence d’événements conduisant à la perte d’intégrité des jonctions intercellulaires. |
Quels sont les mécanismes liant la phosphorylation de la VE-cadhérine à son endocytose ? Nous montrons désormais que la β-arrestine, plutôt caractérisée par son implication dans l’endocytose de récepteurs de signalisation activés [
10], est spécifiquement recrutée sur la VE-cadhérine lorsque celle-ci est phosphorylée sur sérine S665 par PAK [9]. En outre, l’absence expérimentale de β-arrestine réduit à la fois l’internalisation de la VE-cadhérine et l’augmentation de la perméabilité endothéliale, induites par le VEGF. Nous proposons alors le modèle dans lequel le VEGF contrôle la voie de signalisation Src/Vav2/Rac/PAK, entraînant la phosphorylation de la VE-cadhérine par PAK puis le recrutement de la β-arrestine (Figure 2). Cette cascade d’activation dirige alors la VE-cadhérine vers une voie d’endocytose, classiquement plutôt restreinte aux récepteurs de signalisation couplés aux protéines G hétérotrimériques [10]. Il nous appartient désormais de déterminer si d’autres facteurs que le VEGF peuvent induire le même type de signalisation vers la VE-cadhérine et quelles en sont les conséquences in vivo. Finalement, la découverte des mécanismes moléculaires par lesquels le VEGF induit la perméabilité via l’endocytose de la VE-cadhérine pourrait avoir des implications cliniques directes, et permettre l’identification de nouvelles cibles thérapeutiques pour le traitement de pathologies humaines impliquant la perte de l’étanchéité de la barrière endothéliale. |
Nous tenons à remercier Simone Gilgenkrantz et le Comité de rédaction de nous avoir offert l’opportunité de contribuer au journal Médecine/Sciences, la Fondation pour la Recherche Médicale (FRM) et le National Institutes of Health (NIH) pour les supports financiers, et aussi Lou Reed et Francis Cabrel pour l’inspiration.
|
1. Ferrara N, Gerber HP, LeCouter J. The biology of VEGF and its receptors. Nat Med 2003; 9 : 669–76. 2. Senger DR, Galli SJ, Dvorak AM, et al. Tumor cells secrete a vascular permeability factor that promotes accumulation of ascites fluid. Science 1983; 219 : 983–5. 3. Weis SM, Cheresh DA. Pathophysiological consequences of VEGF-induced vascular permeability. Nature 2005; 437 : 497–504. 4. Weis S, Shintani S, Weber A, et al. Src blockade stabilizes a Flk/cadherin complex, reducing edema and tissue injury following myocardial infarction. J Clin Invest 2004; 113 : 885–94. 5. Eliceiri BP. Selective requirement for Src kinases during VEGF-induced angiogenesis and vascular permeability. Mol Cell 1999; 4 : 915. 6. Weis S, Cui J, Barnes L, Cheresh D. Endothelial barrier disruption by VEGF-mediated Src activity potentiates tumor cell extravasation and metastasis. J Cell Biol 2004; 167 : 223–9. 7. Carmeliet P, Lampugnani MG, Moons L, et al. Targeted deficiency or cytosolic truncation of the VE-cadherin gene in mice impairs VEGF-mediated endothelial survival and angiogenesis. Cell 1999; 98 : 147–57. 8. Dejana E. Endothelial cell-cell junctions: happy together. Nat Rev Mol Cell Biol 2004; 5 : 261–70. 9. Gavard J, Gutkind JS. VEGF controls endothelial-cell permeability by promoting the beta-arrestin-dependent endocytosis of VE-cadherin. Nat Cell Biol 2006; 8 : 1223–34. 10. Lefkowitz RJ, Rajagopal K, Whalen EJ. New roles for beta-arrestins in cell signaling: not just for seven-transmembrane Receptors. Mol Cell 2006; 24 : 643–52. |