Malgré les progrès thérapeutiques récents, les complications de l’athérosclérose (infarctus du myocarde, mort subite, accidents vasculaires cérébraux) restent la première cause de mortalité dans les pays industrialisés. L’athérosclérose se caractérise par une infiltration progressive de la paroi des artères aboutissant au développement de plaques constituées d’un cœur athéromateux (mélange de dépôts lipidiques, nécrotiques et de cellules inflammatoires) recouvert d’une chape fibreuse. L’angiographie permet d’évaluer les plaques d’athérosclérose indirectement par le degré de rétrécissement de la lumière artérielle qu’elles engendrent. Cette technique permet de détecter les rétrécissements critiques des artères qui entraînent un défaut de perfusion des tissus myocardiques d’aval et, si besoin, de les traiter par une dilatation avec un ballon ou par un pontage coronaire. En revanche, elle ne permet pas de prédire le risque de survenue d’un infarctus du myocarde chez un patient. Une meilleure compréhension des mécanismes physiopathologiques aboutissant à un infarctus du myocarde a permis d’expliquer ce paradoxe.
En effet, de façon similaire à un abcès, une plaque d’athérosclérose peut se rompre brutalement dans la lumière artérielle [ 1]. La mise en contact du sang circulant avec le cœur athéromateux présent au sein des plaques va provoquer la formation d’un thrombus pouvant occlure l’artère et aboutir à un infarctus du myocarde. Les plaques d’athérosclérose rompues se caractérisent plus par leur contenu biologique que par le degré de rétrécissement artériel qu’elles engendrent [ 2]. Les plaques d’athérosclérose ayant les mêmes caractéristiques que ces plaques rompues sont considérées comme des plaques « à haut risque », susceptibles de se rompre et d’engendrer un infarctus du myocarde [ 3, 9]. Ces plaques « à haut risque » comportent le plus souvent un volumineux noyau athéromateux recouvert d’une fine chape fibreuse qu’accompagne une importante infiltration par des cellules inflammatoires, principalement des macrophages. Les macrophages semblent jouer un rôle important dans la rupture des plaques et dans la formation d’un thrombus [ 4]. En effet, ces cellules sécrètent d’importantes quantités d’enzymes protéolytiques capables de dégrader le collagène formant la chape fibreuse, ainsi que des facteurs pro-thrombotiques favorisant la formation d’un thrombus en cas de rupture [ 5]. Il serait d’un intérêt clinique majeur de détecter par imagerie ces plaques d’athérosclérose à haut risque évolutif afin de pouvoir identifier plus précocement les patients susceptibles de développer un infarctus du myocarde [ 6].
Le scanner à rayons X est actuellement la seule technique d’imagerie permettant d’atteindre les résolutions spatiale et temporelle nécessaires à l’imagerie des artères coronaires, et de détecter avec une précision croissante les plaques d’athérosclérose coronaires [ 7]. Il s’agit maintenant d’identifier, parmi ces plaques d’athérosclérose, celles qui présentent un risque de rupture. Les agents de contraste conventionnels sont de petites molécules solubles détectables au scanner grâce à leur contenu en iode qui absorbe les rayons X. Dans un travail récemment publié [ 8], nous avons évalué le N1177, un nouvel agent de contraste composé de nanoparticules de 150 à 400 nanomètres de diamètre formées de cristaux d’iode recouverts d’une couche de lipides (Figure 1A). Nous avons exploré, dans un modèle de plaques d’athérosclérose induites dans l’aorte de lapin, la capacité de ce nouvel agent de contraste à détecter en scanner les macrophages infiltrant ces plaques d’athérosclérose.
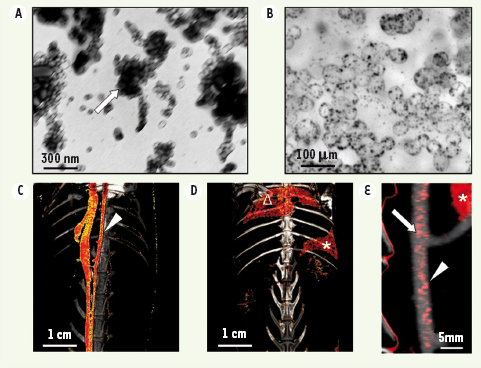
| Figure 1.
Composition du N 1177 et comportement in vivo.
A. En microscopique électronique, le N1177 apparaît composé d’un cœur formé de cristaux d’iode (flèche blanche) recouvert de lipides. B. Le N1177 est capté en grande quantité par les macrophages in vitro.
C. Cinq minutes après l’injection intraveineuse de N1177 chez un lapin normal, l’agent de contraste est localisé dans la lumière artérielle permettant d’obtenir une angiographie de l’aorte (pointe de flèche blanche) et de la veine cave inférieure en scanner. D. Deux heures après l’injection, le N1177 se concentre dans les organes riches en macrophages tels que la rate (*) et le foie (Δ). E. Chez un lapin présentant des plaques d’athérosclérose dans l’aorte, nous avons détecté l’accumulation de N1177 (flèche blanche) dans les plaques d’athérosclérose riches en macrophages de l’aorte (pointe de flèche blanche). |
Nous avons d’abord confirmé la capture du N1177 par les macrophages in vitro. Nous avons mesuré la quantité d’iode captée par les macrophages et déterminé que cette quantité était presque cent fois supérieure avec le N1177 à celle qui est captée avec un agent de contraste conventionnel (Figure 1B). Nous avons ensuite étudié la localisation du N1177 in vivo après son injection intraveineuse à des lapins. Cinq minutes après l’injection, le N1177 était localisé principalement dans la lumière des vaisseaux et permettait d’obtenir une angiographie artérielle et veineuse de très bonne qualité en scanner (Figure 1C). Deux heures après l’injection, le N1177 n’était plus détectable dans la lumière artérielle et avait été entièrement capté par les macrophages du foie et de la rate (Figure 1D). Nous avons donc choisi ce délai pour détecter la présence de macrophages dans les plaques d’athérosclérose. Nous avons ensuite induit des plaques d’athérosclérose dans les aortes de lapins par l’association d’un régime hyperlipidémique et d’abrasions endothéliales réalisées à l’aide d’un ballon. Ce modèle permet d’obtenir des plaques d’athérosclérose riches en macrophages et d’une taille proche des plaques d’athérosclérose coronaire chez l’homme. Deux heures après l’injection de N1177, nous avons détecté une augmentation significative du contraste dans les plaques d’athérosclérose en scanner qui correspondait à l’accumulation d’iode (Figure 1E). Ce rehaussement de contraste n’était pas détecté après injection d’un agent de contraste conventionnel. Nous avons ensuite visualisé par microscope électronique dans ces macrophages de nombreux cristaux d’iode identiques à ceux présents dans le N1177. Finalement nous avons confirmé par histologie que l’intensité du signal mesuré dans les plaques d’athérosclérose en scanner corrélait avec la présence de nombreux macrophages en histologie. Nous avons ainsi démontré dans ce travail la possibilité de détecter par le scanner les macrophages dans les plaques d’athérosclérose de lapins.