| |
| Med Sci (Paris). 2007 November; 23(11): 1034–1036. Published online 2007 November 15. doi: 10.1051/medsci/200723111034.PGC-1α régule la jonction neuromusculaire et améliore la dystrophie musculaire de Duchenne Anne-Sophie Arnold* Physiology Institute, Université de Zürich, Winterthurerstrasse 190, CH-8057 Zürich, Suisse MeSH keywords: Protéines du choc thermique, Humains, Maladies musculaires, Myopathie de Duchenne, Facteurs de transcription |
Le coactivateur 1α du récepteur γ activé par le proliférateur du peroxisome (PPARγ), ou PGC-1α, identifié par l’équipe de Christoph Handschin et Bruce Spiegelman, confère une spécificité transcriptionnelle à PPARγ [
1]. Ce facteur est en fait une plateforme protéique qui relie les facteurs de transcription au complexe d’initiation de la transcription et participe au traitement de l’ARN messager cible. La fonction principale de PGC-1α est de stimuler l’augmentation du nombre de mitochondries ainsi que le métabolisme oxydatif. Ce facteur est en effet très exprimé dans les tissus caractérisés par un métabolisme oxydatif intense, comme le cœur, le rein, le cerveau, le tissu adipeux brun, et le muscle squelettique [
2]. C’est en particulier au niveau de ce dernier tissu que PGC-1α semble jouer un rôle très important. La concentration en PGC-1α est plus forte dans les muscles riches en fibres de type I et II a, comme le muscle soléaire [
3], et l’expression de PGC-1α est favorisée par l’exercice, à la fois chronique et aigu [
4]. Il a été suggéré que ce facteur pourrait être le médiateur des effets anti-apoptotiques qu’exerce l’activité nerveuse sur la masse musculaire. |
PGC-1α et la jonction neuro-musculaire Ainsi, PGC-1α semble être un régulateur important dans le programme de la jonction neuromusculaire (JNM). La taille et la morphologie de la JNM évoluent pendant le développement, mais également selon le degré d’activité physique ainsi que la distribution des différents types de fibres musculaires présents. D’après Handschin et al., PGC-1α est très important dans le cadre de l’adaptation du muscle aux changements d’activité (exercice, modifications physiologiques), mais il n’a qu’un rôle modéré dans la régulation des fonctions musculaires de base. Les niveaux d’expression de PGC-1α sont également importants pour la formation des agrégats de récepteurs à l’acétylcholine dans les fibres musculaires isolées, une des étapes précoces de l’installation de la JNM. Les voies de signalisation de l’agrine et de la neuréguline 1 (NRG-1), deux acteurs essentiels dans la formation et la plasticité de la JNM, convergent toutes les deux vers le facteur de transcription GA binding protein (GABP), dont l’activité est régulée par PGC-1α [
5,
6]. Pour la première fois, il est montré que PGC-1α établit une réelle liaison physique avec GABP et la coactive. En fait, PGC-1α est nécessaire pour que la phosphorylation de GABP activée par NRG-1 (et par conséquent l’augmentation d’expression des gènes de la JNM) ait lieu. Cette interaction entre PGC-1α et GABP dépend étroitement de leur état de phosphorylation respectif. Les auteurs suggèrent que les modifications post-traductionnelles de GABP sont responsables du recrutement de PGC-1α par GABP. |
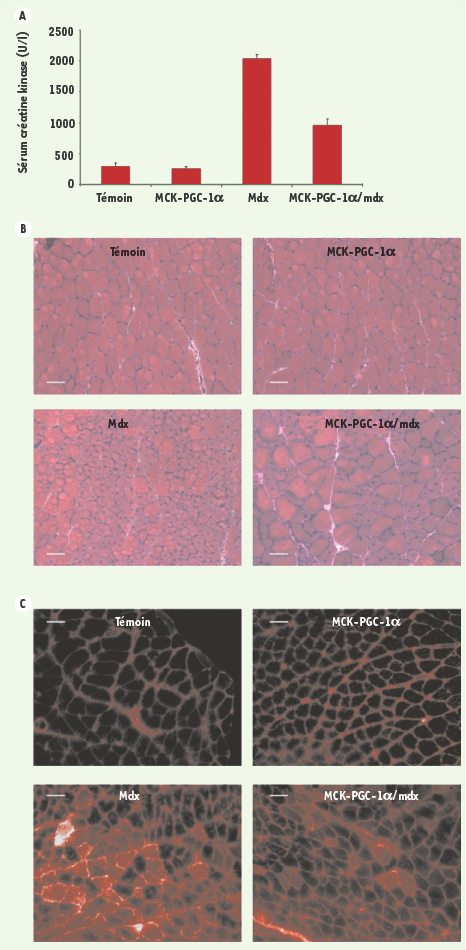
Action bénéfique de PGC-1α dans les myopathies Les auteurs de cette étude ont fait des observations très intéressantes chez des souris mdx (le modèle animal classique pour la myopathie musculaire de Duchenne ou DMD) transgéniques pour l’expression ciblée de PGC-1α uniquement dans le muscle. Il en résulte une amélioration nette du phénotype de ces souris qui se traduit par des niveaux plus bas de créatine kinase, une réduction du nombre de lésions nécrotiques, une moindre altération des fibres musculaires, et une amélioration des fonctions musculaires (Figure 1). Cet allègement de la dystrophie musculaire par PGC-1α chez les souris mdx requiert l’induction d’expression des transcrits et de la protéine utrophine. L’utrophine est depuis longtemps un candidat thérapeutique potentiel très sérieux pour se substituer à l’absence de dytrophine chez les patients DMD [
7].  | Figure 1.
PGC-1
α
améliore la dystrophie musculaire chez les souris mdx sédentaires. Les souris utilisées dans les expériences décrites dans cette figure sont des souris témoins âgées de 5 semaines, des souris transgéniques pour PGC-1α uniquement dans le muscle (MCK-PGC-1), des souris mdx, ainsi que des souris mdx transgéniques pour PGC-1α uniquement dans le muscle (MCK-PGC-1/mdx) (A). Les histogrammes représentent le niveau moyen de créatine kinase et les barres d’erreur représentent la déviation standard. B. Histologie des muscles gastrocnémiens après coloration à l’hématoxyline-éosine. C. Une solution de bleu Evans à 1 % est injectée en intrapéritonéal et les souris sont sacrifiées 16 h plus tard. L’incorporation du colorant par les fibres musculaires est observée par microscopie fluorescente (Reproduit de [ 1] avec l’autorisation de Genes & Development, Cold Spring Harbor Laboratory Press, 2007 ©). |
Mais les effets bénéfiques de PGC-1α vont très au-delà de la simple stimulation de la synthèse d’utrophine. (1) PGC-1α a un effet anti-apoptotique sur les fibres musculaires après dénervation (nerf sciatique). Cet effet passe, entre autres, par l’inhibition du facteur pro-apoptotique FoxO3 [
8]. (2) PGC-1α est un régulateur puissant de la biogenèse des mitochondries et du métabolisme oxydatif dans le muscle squelettique. Il est bien connu que les muscles squelettiques des souris mdx présentent des défauts au niveau de la phosphorylation oxydative et des fonctions mitochondriales. (3) PGC-1α est une cible directe de la voie calcium/calmoduline dans le muscle squelettique. Or, l’interruption de cette voie dans les souris mdx exacerbe le phénotype dystrophique [
9]. (4) L’effet qu’exerce PGC-1α sur les gènes de la JNM pourrait minimiser les défauts de morphologie de la JNM observés chez les souris mdx lors de la régénération de la fibre musculaire après une blessure. Enfin, la production de reactive oxygen species (ROS) pourrait être à l’origine des dommages musculaires observés chez la souris mdx. Or, pour se défendre contre la toxicité de ces espèces, l’organisme fait appel à un régulateur puissant des programmes génétiques, la protéine PGC-1α. |
Pour résumer, l’exposé des résultats cités ci-dessus prouve indubitablement que ce facteur PGC-1α ouvre la voie pour le développement de nouvelles cibles thérapeutiques dans le cadre de la DMD, ou de sa forme légère, la dystrophie musculaire de Becker, mais aussi pour d’autres maladies neuromusculaires. |
1. Handschin C, Kobayashi YM, Chin S, et al. PGC-1alpha regulates the neuromuscular junction program and ameliorates Duchenne muscular dystrophy. Genes Dev 2007; 21 : 770–83. 2. Handschin C, Spiegelman BM. Peroxisome proliferator-activated receptor gamma coactivator 1 coactivators, energy homeostasis, and metabolism. Endocr Rev 2006; 27 : 728–35. 3. Lin J, Wu H, Tarr PT, Zhang CY, et al. Transcriptional co-activator PGC-1 alpha drives the formation of slow-twitch muscle fibres. Nature 2002; 418 : 797–801. 4. Russell AP, Feilchenfeldt J, Schreiber S, et al. Endurance training in humans leads to fiber type-specific increases in levels of peroxisome proliferator-activated receptor-gamma coactivator-1 and peroxisome proliferator-activated receptor-alpha in skeletal muscle. Diabetes 2003; 52 : 2874–81. 5. Angus LM, Chakkalakal JV, Mejat A, et al. Calcineurin-NFAT signaling, together with GABP and peroxisome PGC-1{alpha}, drives utrophin gene expression at the neuromuscular junction. Am J Physiol Cell Physiol 2005; 289 : C908–17. 6. Briguet A, Ruegg MA. The Ets transcription factor GABP is required for postsynaptic differentiation in vivo. J Neurosci 2000; 20 : 5989–96. 7. Miura P, Jasmin BJ. Utrophin upregulation for treating Duchenne or Becker muscular dystrophy: how close are we ? Trends Mol Med 2006; 12 : 122–9. 8. Sandri M, Lin J, Handschin C, Yang W, et al. PGC-1alpha protects skeletal muscle from atrophy by suppressing FoxO3 action and atrophy-specific gene transcription. Proc Natl Acad Sci USA 2006; 103 : 16260–5. 9. Handschin C, Rhee J, Lin J, et al. An autoregulatory loop controls peroxisome proliferator-activated receptor gamma coactivator 1alpha expression in muscle. Proc Natl Acad Sci USA 2003; 100 : 7111–6. |