Les récepteurs couplés aux protéines G (RCPG) constituent la plus grande classe de récepteurs membranaires. Ils régulent un large éventail de processus physiologiques et représentent donc des cibles importantes pour le développement de médicaments. Les RCPG assurent la conversion de signaux extracellulaires en messages intracellulaires via des protéines G hétérotrimériques αβγ. Selon le modèle « collisionnel » généralement accepté et déduit d’expériences réalisées dans des systèmes reconstitués, l’activation de la protéine G passe par son recrutement par le RCPG occupé par l’agoniste, suivi de sa dissociation en sous-unités α et dimères βγ capables d’agir sur leurs effecteurs respectifs [ 1] (Figure 1A). Bien que différentes techniques biophysiques permettent d’appréhender les changements conformationnels du RCPG ou de la protéine G consécutifs à leur activation [ 2], la dynamique des réarrangements structuraux se produisant à l’interface des deux partenaires est à ce jour encore inconnue.
| Figure 1.
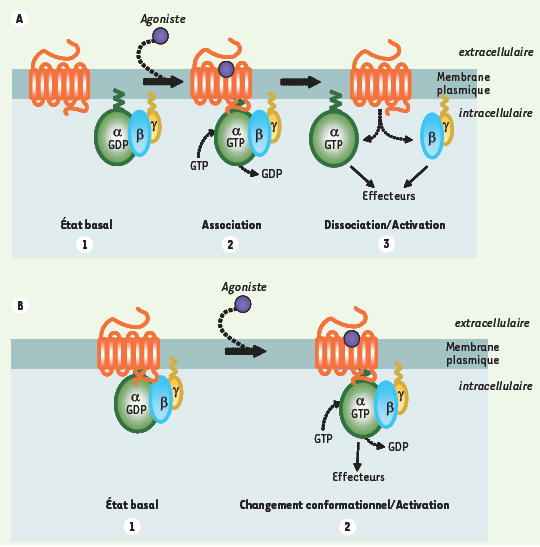
Modèles d’activation des protéines G hétérotrimériques par les RCPG. A. Modèle « collisionnel ». À l’état basal, la protéine G se trouve sous forme d’un hétérotrimère composé des sous-unités Gαβγ fortement associées entre elles et physiquement dissocié du récepteur (1). L’activation du récepteur par le ligand agoniste entraîne le recrutement de la protéine Gαβγ au récepteur avec pour conséquence, un échange GDP/GTP au niveau de la sous-unité Gα (2). Cet échange entraîne la dissociation du récepteur et des sous-unités Gα et Gβγ libres capables d’activer leurs effecteurs (3). B. Modèle « conformationnel ». À l’état basal, la protéine G hétérotrimérique est déjà associée au récepteur (1). La liaison d’un ligand agoniste induit un changement conformationnnel du récepteur au sein du complexe préexistant entraînant l’activation de la protéine G (2).
|
Nous avons récemment étudié les relations RCPG/protéine G et les mécanismes d’activation de celle-ci en tirant profit du principe biophysique de transfert d’énergie bioluminescente par résonance (BRET) [ 3]. Ce transfert d’énergie se produit entre une protéine donneuse d’énergie, la luciférase de Renilla reniformis, et une protéine acceptrice d’énergie, un variant de la protéine fluorescente verte, GFP [ 4] lorsque la distance entre partenaires est inférieure à 100Å. Il est très sensible à ce paramètre car son efficacité est fonction de la distance donneur/accepteur à la puissance 6, ce qui fait du BRET un outil de choix pour étudier les interactions protéine-protéine et les changements conformationnels. Ainsi, l’« étiquetage » de RCPG et de sous-unités des protéines G avec les partenaires BRET, nous a permis de mesurer pour la première fois l’interaction et les mouvements entre un RCPG et les protéines G en temps réel dans des cellules vivantes [3]. Ce premier travail, réalisé en utilisant le récepteur β2 adrénergique et les sous-unités Gβ1 ou Gγ2, nous a permis de valider l’utilisation des biosenseurs décrits plus haut pour mesurer l’engagement de la protéine G consécutif à l’activation du RCPG. L’activation du RCPG entraîne une augmentation du signal BRET, suggérant un rapprochement entre le RCPG et la protéine G compatible avec le modèle « collisionnel ». Toutefois, en l’absence de stimulation l’observation d’un signal BRET basal spécifique n’excluait pas la possibilité que l’augmentation du BRET reflète un réarrangement moléculaire local au sein d’un complexe RCPG-protéine G préexistant. Pour tester cette possibilité, nous avons multiplié « les yeux » de la protéine G en créant une série de sondes susceptibles de mieux rendre compte des changements moléculaires, procurant ainsi un plus grand nombre de « points de vue » [ 5]. Différents senseurs BRET ont été fusionnés aux sous-unités Gαi1, Gβ1 et Gγ2 permettant ainsi non seulement de mesurer l’interaction du RCPG avec les trois sous-unités de la protéine G, mais aussi les interactions entre Gα et Gβγ (Figure 2A). Des sondes ont également été introduites dans trois positions de la sous-unité Gαi1 rendant ainsi perceptibles les mouvements à partir de plusieurs points de référence dans la même protéine. Cette stratégie de multi-positionnement a permis d’observer des augmentations ou des diminutions du signal BRET en fonction de la position des sondes, et donc d’indiquer que les modulations du signal BRET induites par l’agoniste reflètent des changements conformationnels d’un complexe RCPG-protéine G préformé à l’état de base. La cinétique rapide des changements de BRET (t1/2~ 250 ms) est compatible avec cette hypothèse. Par ailleurs, la stabilité du signal durant les premières minutes d’activation est aussi difficilement conciliable avec le modèle « collisionnel » qui propose une dissociation rapide du complexe. En effet, une séparation du RCPG et des sous-unités Gα et Gβγ devrait conduire à une perte rapide du signal BRET, ce qui n’a pas été observé même en utilisant une protéine Gαi1 mutante déficiente en activité GTPasique qui, selon le modèle classique, devrait favoriser la dissociation. Ces données suggèrent donc que l’activation des protéines G résulte d’un réarrangement conformationnel d’un complexe RCPG-Gαβγ préformé sans dissociation rapide de ses composantes (Figure 1B). Au-delà d’un nouveau modèle opérationnel pour les RCPG, l’application de la stratégie de « multi-sondes BRET » au sein du complexe Gαβγ nous a permis de proposer un modèle structural d’activation du trimère Gαβγ compatible avec les données de cristallographie et de modélisation moléculaire [2, 6, 7]. Selon ce modèle (Figure 2B), l’activation de la protéine G par le récepteur induit un réarrangement relatif de la sous-unité Gα et du dimère Gβγ qui se traduit par une ouverture du domaine hélical de Gα requise pour l’échange GDP/GTP. Dans le même temps, une réorganisation de l’interface entre le domaine GTPasique de Gα et Gβγ permettrait l’engagement sélectif de leurs effecteurs propres.
| Figure 2.
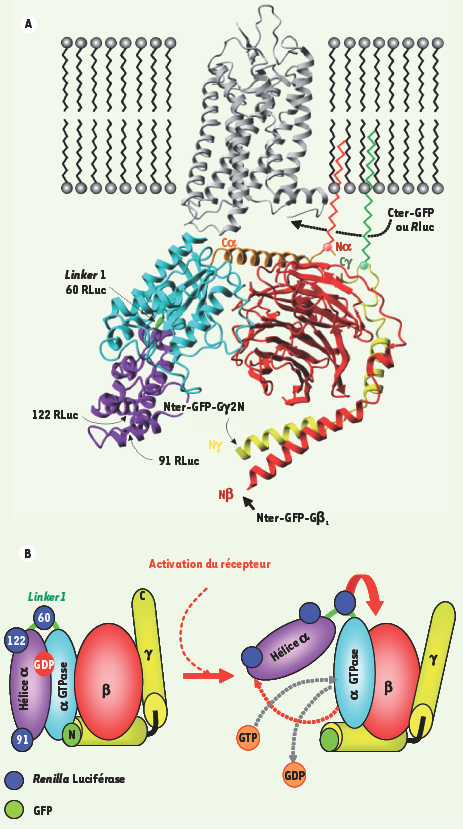
A. Sites d’insertion des bio-senseurs de BRET. Illustration de la structure tridimensionnelle du complexe Gαi1β1γ2 et de la rhodopsine au niveau de la membrane plasmique. Les positions des diverses sondes de BRET (Renilla luciférase, Rluc et protéine fluorescente verte, GFP) dans la structure du complexe sont indiquées par des flèches. Les insertions en position amino- et carboxy-terminale sont identifiées par Nter et Cter tandis que les insertions au cœur de la séquence sont identifiées par le numéro de l’acide aminé précédant le site d’insertion. B. Modèle structural d’activation des protéines G hétérotrimériques. Représentation des changements conformationnels accompagnant l’activation des protéines G hétérotrimériques tel que proposé par Cherfils et al. [6] et soutenus par les changements de BRET perçus par les diverses sondes de BRET représentées sur le schéma. |