| |
| Med Sci (Paris). 2007 November; 23(11): 991–996. Published online 2007 November 15. doi: 10.1051/medsci/20072311991.Immunité maternelle et transmission mère-enfant du VIH et du VHC Progrès récents et nouveaux défis Doris G. Ransy,1,2 Bertine S. Akouamba,1,2 Johanne Samson,3 Normand Lapointe,4 and Hugo Soudeyns1,5* 1Unité d’immunopathologie virale 2Départements de microbiologie et d’immunologie, Faculté de médecine, Université de Montréal (Québec), Canada 3Centre maternel et infantile sur le Sida, Centre de recherche du CHU Sainte-Justine, Montréal (Québec), Canada 4Département de pédiatrie, Faculté de médecine, Université de Montréal, Québec, Canada 5Unité d’immunopathologie virale. Départements de microbiologie, d’immunologie et de pédiatrie, Faculté de médecine, Université de Montréal Montréal (Québec), Canada. Unité d’immunopathologie virale, Centre de recherche, CHU Sainte-Justine, 3175, Côte Sainte-Catherine, local 6735, Montréal (Québec) H3T 1C5, Canada |
Dès le début des années 1980, quelques équipes suggéraient une possible transmission de la mère à l’enfant de l’agent étiologique du syndrome d’immunodéficience acquise (Sida) [
1,
2]. Mais ce n’est qu’en 1985, à l’Hôpital Sainte-Justine, que le Dr Normand Lapointe et son équipe confirment pour la première fois la transmission in utero de ce virus, alors appelé human T-cell lymphotropic virus type
III (HTLV-III) [
3]. Par la suite, le Centre maternel et infantile sur le Sida (CMIS), une unité hospitalière de recherche, d’enseignement et de soins sur le Sida (UHRESS), sera fondé à l’Hôpital Sainte-Justine (1988). Le CMIS deviendra la référence au Québec en matière de prévention de la transmission mère-enfant (TME) du VIH. Depuis ce temps, le HTLV-III a été rebaptisé virus de l’immunodéficience humaine (VIH) et, avec près de 40 millions de personnes vivant avec le VIH à travers le monde fin 2006, l’épidémie est devenue pandémie [
4]. Le virus de l’hépatite C (VHC), quant à lui, fut découvert en 1989 : sa propagation constitue toujours un problème de santé publique majeur avec près de 125 millions de personnes infectées à travers le monde [
5]. Partageant la même niche épidémiologique et les mêmes voies de transmission, le VIH et le VHC affectent des populations largement chevauchantes. En effet, dans les pays développés, on estime que 25 % à 35 % de la population porteuse du VIH est co-infectée par le VHC [
6]. |
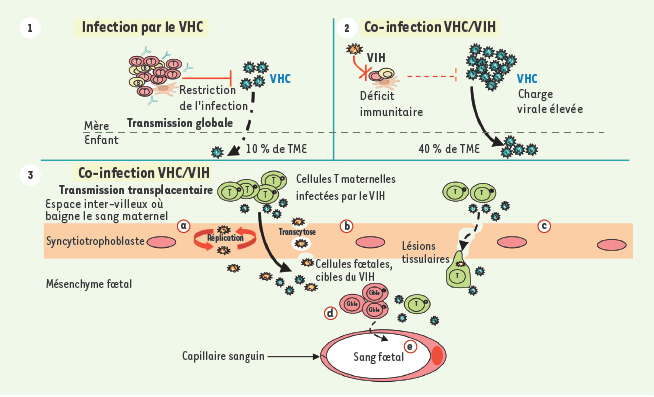
Mécanique de la transmission mère-enfant du VIH Il est désormais établi que le VIH peut être transmis à l’enfant en trois occasions. (1) Antepartum par passage transplacentaire [3]. Le mécanisme par lequel le VIH traverse le placenta est certes encore mal compris. La fusion/infection, la transcytose, c’est-à-dire le transport intravésiculaire du virus d’un pôle à l’autre de la cellule sans qu’il y ait d’échange avec le cytoplasme [
7], ainsi que la diffusion de cellules maternelles infectées à travers des brèches dans la barrière trophoblastique [
8] pourraient toutes y contribuer (Figure 1). (2) Intrapartum durant le travail et l’accouchement [
9]. Les sécrétions vaginales contiennent du VIH sous forme de cellules infectées et de particules virales libres au contact desquelles l’enfant risque de s’infecter lors d’un accouchement vaginal [
10], particulièrement par la voie oropharyngée [
11]. (3) Postpartum dans le contexte de l’allaitement maternel [
12]. La transmission lors de l’allaitement prolongé peut augmenter de près de 15 % l’incidence de la TME du VIH, et demeure problématique dans les pays en développement, où il n’est pas toujours possible de recourir à l’allaitement artificiel en raison de son coût élevé, du manque d’eau potable et des normes sociétales. Là encore, le risque de transmission par cette voie, qui croît en fonction de la durée de l’allaitement, est associé à la présence de virus libre mais également de cellules infectées dans le lait maternel [
13].  | Figure 1.
Conséquences de la co-infection sur la transmission mère-enfant du virus de l’hépatite C. L’infection par le VHC induit une réponse immunitaire humorale et cellulaire qui maintient la charge virale plasmatique à un bas niveau. Dans ces conditions, le VHC se transmet de la mère à l’enfant dans 10 % des cas (1). Dans le contexte de la co-infection, l’immunosuppression induite par le VIH affecte également l’immunité anti-VHC, ce qui augmente la charge virale plasmatique du VHC. L’incidence de la TME se trouve alors augmentée jusqu’à 4 fois (2). Le VIH pourrait traverser la barrière placentaire en infectant la couche trophoblastique (3a) ou encore par transcytose (3b), la présence du VIH induisant ou favorisant le passage transplacentaire du VHC par des mécanismes similaires. Enfin, la chorioamniotite, fréquente chez la femme séropositive pour le VIH, entraînerait l’apparition de lésions tissulaires, brèches à travers lesquelles les cellules infectées et les virions pourraient transiter du côté maternel vers le côté fœtal (3c). Ils pourraient alors infecter des cellules cibles(3d), accédant ensuite à la circulation fœtale (3e).
|
|
Prévention de la transmission mère-enfant du VIH Jusqu’au début des années 1990, les femmes enceintes infectées par le VIH ne recevaient aucun traitement antepartum ou intrapartum particulier visant à prévenir spécifiquement la TME du VIH. Ce n’est qu’en 1994 que l’étude PACTG076 démontra que l’administration de zidovudine (AZT ; analogue nucléosidique inhibiteur de la transcriptase inverse) à la femme enceinte et au nouveau-né réduisait de 25,5 % à 8,3 % les risques de TME du VIH chez les femmes qui n’allaitaient pas [
14]. À la fin des années 1990, la thérapie antirétrovirale à haute activité (HAART) s’est progressivement imposée comme le traitement de choix des patients infectés et il est de pratique courante d’en administrer certaines combinaisons durant la grossesse [
15]. La lamivudine (3TC), un antirétroviral dont l’activité anti-VIH fut mise en évidence au Québec en 1991 par l’équipe du Dr Mark Wainberg [
16], est maintenant administrée en combinaison avec l’AZT. Cette combinaison, associée ou non à des inhibiteurs de protéase et utilisée de concert avec la césarienne programmée, reste encore aujourd’hui la pierre angulaire du traitement antirétroviral chez la femme enceinte dans les pays industrialisés [15]. La thérapie combinée permet de diminuer la charge virale jusqu’à des taux indétectables, de maintenir un bon niveau de cellules T CD4+, et de réduire à moins de 2 % le risque de TME [
17]. En 1999, l’étude HIVNET 012 fait état de la réduction de l’incidence de la TME par un traitement simple dose à la névirapine (NVP), plus pratique et abordable que l’AZT et applicable en situation de ressources limitées [
18]. La combinaison nevirapine-AZT est également efficace [
19]. En Europe et en Amérique du Nord, une femme infectée non traitée a de 15 à 25 % de risques de transmettre l’infection à son enfant. Dans les régions où l’infection est endémique (Afrique et Asie), le taux de transmission passe de 25 à 40 %, élévation qui s’explique en grande partie par les différences dans la fréquence et la durée de l’allaitement maternel observées entre femmes selon les régions. Il n’en demeure pas moins qu’environ 75 % des enfants portés par une mère infectée par le VIH ne recevant pas de traitement antirétroviral ne contractent pas le VIH durant la grossesse et lors de l’accouchement, et ce en dépit de l’intimité et de la durée prolongée du contact materno-fœtal. |
Transmission mère-enfant du VIH et réponse immunitaire De nombreux travaux ont permis de révéler puis d’évaluer l’importance du rôle de la réponse immunitaire maternelle dans la prévention de la TME. On a observé depuis longtemps que la TME est associée à une charge virale maternelle élevée – le meilleur facteur prédictif du risque de transmission – et à un faible décompte de cellules T CD4+, deux robustes indicateurs d’immunodéficience : plus la maladie progresse, plus le décompte CD4 diminue et plus le risque de TME augmente [
20]. Comparées aux mères qui ne transmettent pas le virus, les activités cytotoxiques et suppressives des lymphocytes T CD8+ anti-VIH sont réduites chez les mères qui le transmettent [
21], bien que les variants VIH qui sont préférentiellement transmis à l’enfant soient ceux-là même qui échappent à la réponse cellulaire maternelle [
22] et aux anticorps neutralisants [
23]. On pense également que des facteurs génétiques associés à la réponse immunitaire, notamment la présence de l’allèle HLA-DR13, ainsi que la discordance entre les HLA de classe I de la mère et du fœtus protègeraient ce dernier contre la TME du VIH [
24]. Enfin, des réponses T cytotoxiques [
25] et des perturbations du répertoire immunitaire apparentées à des réponses antigène-spécifiques [
26,
27] ont été observées chez des enfants non infectés nés de mères infectées. L’environnement de la grossesse est donc loin de représenter un vide immunitaire pour le VIH, puisqu’il doit de fait composer avec la présence « non pas de un mais bien de deux » systèmes immuns distincts, systèmes qui semblent tous deux capables de contribuer de manière significative à la résistance de l’hôte contre l’infection. Les résultats de ces études ont également amené d’influents groupes de chercheurs et de cliniciens à considérer la vaccination ou l’immunoprophylaxie (c’est-à-dire anticorps monoclonaux) comme des stratégies valables susceptibles d’endiguer la TME du VIH, particulièrement dans les situations où les ressources sont limitées et où l’on ne peut que difficilement offrir de substitut à l’allaitement maternel [
28]. En effet, des études initialement prometteuses ont montré que l’immunisation passive à l’aide d’anticorps monoclonaux pouvait prévenir la TME d’un hybride des virus de l’immunodéficience simienne et humaine (SHIV) via le lait maternel chez le singe Rhésus [
29]. Toutefois, plusieurs anticorps monoclonaux dirigés contre des déterminants du VIH de sous-type B se sont montrés inefficaces à neutraliser des isolats de sous-type C, le sous-type dominant dans beaucoup de régions à haute endémicité [
30]. L’immunoprophylaxie passive demeure néanmoins une possibilité attrayante. Il reste à déterminer son efficacité à réduire la TME sur le terrain et à développer des anticorps à large spectre pouvant être administrés seuls ou en combinaison avec des agents antirétroviraux. En collaboration avec des chercheurs de l’université Johns Hopkins et de l’université Makere de Kampala, un essai clinique de phase I impliquant l’administration d’un vaccin canarypox recombinant exprimant certaines protéines du VIH (ALVAC-HIV ; vCP1521) a récemment été entrepris en Ouganda auprès de jeunes enfants nés de mères infectées, avec comme objectif la réduction chez ces enfants de l’incidence de la TME tardive associée à l’allaitement. |
Transmission mère-enfant du VHC On attribue au virus de l’hépatite C la majorité des cas d’hépatite virale chronique, avec pour suites fréquentes cirrhose et carcinome hépatique. Tout comme le VIH, le VHC se transmet de la mère à l’enfant, mais seulement dans près de 10 % des cas [
31]. Après l’introduction des tests de dépistage en 1990, la TME est à toutes fins pratiques devenue l’unique source d’infection par le VHC chez l’enfant. Or, dans plusieurs pays, dont le Canada, le dépistage de l’infection au VHC durant la grossesse n’est pas universellement offert à la femme enceinte, bien que la prévalence du VHC au sein de leur population soit beaucoup plus élevée que celle du VIH ; un dépistage fondé sur la perception des facteurs de risque lui est préféré [
32]. La TME du VHC diffère de celle du VIH en au moins deux points. (1) La voie de transmission in utero est plus importante dans le cas du VHC : de 30 à 50 % des cas de TME du VHC s’effectueraient par voie transplacentaire, contre une proportion de l’ordre de 20-25 % pour le VIH [
33] ; et (2) bien que le VHC puisse être détecté dans le lait maternel et le colostrum à de faibles niveaux, l’allaitement maternel n’est pas considéré comme un facteur de risque de transmission du VHC à l’enfant - il ne devrait donc pas être contre-indiqué pourvu que les mamelons de la mère ne présentent aucune blessure. |
Partageant la même niche épidémiologique, le VIH et le VHC affectent des populations largement chevauchantes. C’est ainsi que la prévalence de la co-infection VIH-VHC est particulièrement élevée chez les utilisateurs de drogues injectables (UDI). Or non seulement la TME du VIH est-elle plus fréquente chez les femmes porteuses des deux virus que chez les femmes infectées uniquement par le VIH, mais en plus, nombre d’études ont démontré qu’une telle co-infection chez la femme enceinte pouvait jusqu’à « quadrupler » le taux de transmission du VHC à l’enfant [31]. Plusieurs mécanismes pourraient potentiellement expliquer ce phénomène (Figure 1). (1) Les femmes co-infectées présentent des charges virales VHC « 10 fois plus élevées » que les femmes infectées uniquement par le VHC. Or la charge virale demeure fortement associée à la TME du VHC, si bien qu’on n’a rapporté que de rares cas de TME en deçà d’une virémie maternelle de 1 x 106 copies d’ARN VHC par ml de plasma (« charge virale seuil ») [31]. Cette situation diffère de celle du VIH, pour lequel une faible virémie n’écarte pas les risques de TME, qui peut parfois se produire lorsque la mère présente une virémie inférieure à 1 000 copies d’ARN par ml de plasma [
34]. (2) Si le VHC était capable d’infecter les cellules trophoblastiques in vivo, à l’instar du virus du Nil Occidental [
35], un autre Flaviviridae, il se pourrait que la co-infection par le VIH potentialise sa réplication dans ce tissu ou encore induise sa transcytose à travers la barrière placentaire. Ce mécanisme pourrait également expliquer l’augmentation de la TME du VIH en présence de co-infection VIH-VHC. (3) Chez la femme infectée par le VIH et chez les UDI en général, on retrouve une forte prévalence de chorioamniotite aiguë et chronique [
36], deux états inflammatoires qui pourraient favoriser le transit non seulement du VHC mais aussi du VIH à travers des microlésions placentaires. (4) L’infection par le VIH est associée à une profonde immunodéficience, tant au niveau humoral que cellulaire, déficience qui affecte également l’immunité anti-VHC [
37] et pourrait indirectement faciliter la TME. On sait que l’évolution clinique de l’hépatite C est modifiée durant la grossesse et après l’accouchement, et que cette modulation comporte une forte composante immunitaire [
38]. On sait également que la présence du VIH et l’immunodéficience qui y est associée sont capables d’influencer la charge et la dynamique des populations virales du VHC durant la grossesse et chez l’enfant co-infecté [
39–
41]. Le traitement de choix de l’infection par le VHC, une combinaison de ribavirine et d’IFN-α pégylé, est fortement contre-indiqué durant la grossesse, la ribavirine étant tératogène [
42] et l’IFN-α possédant des propriétés antiprolifératives et neurotoxiques [
43]. D’où l’importance d’un traitement efficace de l’infection par le VIH chez la femme co-infectée, traitement qui, en agissant directement sur la charge virale VIH et indirectement sur la reconstitution immunitaire, devrait contribuer à réduire les risques de TME du VHC. Enfin, la co-transmission du VIH et du VHC à l’enfant, bien que moins fréquente que la transmission individuelle de chacun des virus, peut avoir chez ce dernier d’importantes conséquences pathologiques à long terme [39]. |
Questions criantes et défis récents Vingt ans après la découverte de la TME du VIH et plus de 15 ans après la découverte du VHC, un grand nombre de questions criantes et de problèmes émergents demeurent. Au début des années 1990, l’incidence de la TME du VIH était d’environ 15 à 25 % dans les pays développés, ces chiffres ont diminué pour atteindre moins de 2 % aujourd’hui grâce à la prophylaxie antirétrovirale, à la pratique de la césarienne programmée et à l’allaitement artificiel. Cependant, l’accès au traitement est toujours cruellement déficient dans les régions du Globe les plus durement touchées par la pandémie et par la possible dissémination de souches résistantes à la névirapine chez la mère et l’enfant qui reste un problème considérable dans le contexte de l’utilisation à court terme de ce seul agent. Dans la plupart des pays industrialisés, la sélection de souches multi-résistantes lors de traitements anti-VIH à long terme complique la programmation de la thérapie et en compromet l’efficacité, ceci en dépit de la disponibilité d’un éventail sans cesse croissant d’agents antirétroviraux ciblant diverses phases du cycle de réplication viral (inhibiteurs de fusion, antagonistes de corécepteurs, inhibiteurs d’intégrase). Les difficultés reliées à la non-adhésion au traitement et les effets secondaires limitent également l’efficacité de la thérapie. Enfin, bien qu’aucune corrélation solide n’ait encore été établie entre génotype viral et incidence de la TME, la diffusion croissante des souches non-B du VIH, un phénomène global mais qui n’a été que récemment observé en Amérique du Nord et qui est étroitement lié aux mouvements migratoires à partir de régions à haute endémicité [
44], pose un défi autant pour le dépistage et le traitement de l’infection chez la femme enceinte que pour le design vaccinal. Quant à la TME de l’hépatite C, le traitement par l’IFN-α pourrait être envisageable chez la femme enceinte mais uniquement dans les cas d’infection aigüe ou de maladie hépatique avancée [
45]. De son côté, le bénéfice réel de la pratique de la césarienne programmée dans le contexte de la TME du VHC n’a pas encore été formellement établi [32]. Plusieurs agents antiviraux ciblant le VHC (BILN 2061, VX-950, SCH 503034) sont en cours d’évaluation et certains d’entre eux atteindront bientôt des phases d’essais cliniques avancées. De la même façon que le traitement préventif de la TME du VIH par les agents antirétroviraux, une éventuelle disponibilité d’agents anti-VHC en clinique aurait de bonnes chances de changer la situation en ce qui concerne le traitement de l’hépatite C et la prophylaxie antivirale durant la grossesse. |
Les auteurs souhaitent remercier les patients de la Cohorte mère-enfant du CMIS pour leur participation, ainsi que Ampha Khammy, Silvie Valois et Martine Caty pour leur assistance. Soutenu par le Réseau sida et maladies infectieuses du Fonds de la recherche en santé du Québec (FRSQ), par l’initiative de recherche sur l’hépatite C des Instituts de recherche en santé du Canada (IRSC) et de Santé Canada (EOP-41537), par CANFAR, la Fondation canadienne de recherche sur le sida (subvention no013515) et par la Elizabeth Glaser Pediatric AIDS Foundation.
Hugo Soudeyns est soutenu en partie par le Réseau SIDA et maladies infectieuses du Fonds de la recherche en santé du Québec (FRSQ), l’initiative stratégique de recherche sur le VIH/Sida des Instituts de recherche en santé du Canada (IRSC) et CANFAR, la Fondation canadienne de recherche sur le SIDA.
|
1. Oleske J, Minefor A, Cooper R, et al. Immune deficiency syndrome in children. JAMA 1983; 249 : 2345–9. 2. Cowan MJ, Hellmann D, Chudwin D, et al. Maternal transmission of acquired immune deficiency syndrome. Pediatrics 1984; 73 : 382–6. 3. Lapointe N, Michaud J, Pekovic D, et al. Transplacental transmission of HTLV-III virus. N Engl J Med 1985; 312 : 1325–6. 4. UNAIDS. AIDS epidemic update : December 2006. Genève, Suisse : UNAIDS, 2006. 5. Shepard CW, Finelli L, Alter MJ. Global epidemiology of hepatitis C virus infection. Lancet Infect Dis 2005; 5 : 558–67. 6. Shafran SD. Early initiation of antiretroviral therapy : the current best way to reduce liver-related deaths in HIV/hepatitis C virus-coinfected patients. J Acquir Immune Defic Syndr 2007 online (sois presse). 7. Lagaye S, Derrien M, Menu E, et al. European network for the study of in utero transmission of HIV-1. Cell-to-cell contact results in a selective translocation of maternal human immunodeficiency virus type 1 quasispecies across a trophoblastic barrier by both transcytosis and infection. J Virol 2001; 75 : 4780–91. 8. Tscherning-Casper C, Papadogiannakis N, Anvret M, et al. The trophoblastic epithelial barrier is not infected in full-term placentae of human immunodeficiency virus-seropositive mothers undergoing antiretroviral therapy. J Virol 1999; 73 : 9673–8. 9. Mundy DC, Schinazi RF, Gerber AR, et al. Human immunodeficiency virus isolated from amniotic fluid. Lancet 1987; 2 : 459–60. 10. Tuomala RE, O’Driscoll PT, Bremer JW, et al. Cell-associated genital tract virus and vertical transmission of human immunodeficiency virus type 1 in antiretroviral-experienced women. J Infect Dis 2003; 187 : 375–84. 11. Mandelbrot L, Burgard M, Teglas JP, et al. Frequent detection of HIV-1 in the gastric aspirates of neonates born to HIV-infected mothers. AIDS 1999; 13 : 2143–9. 12. Thiry L, Sprecher-Goldberger S, Jonckheer T, et al. Isolation of virus from cell free breast milk of three healthy virus carriers. Lancet 1985; 2 : 891–2. 13. Rousseau CM, Nduati RW, Richardson BA, et al. Longitudinal analysis of human immunodeficiency virus type 1 RNA in breast milk and of its relationship to infant infection and maternal disease. J Infect Dis 2003; 187 : 741–7. 14. Connor EM, Sperling RS, Gelber R, et al. Reduction of maternal-infant transmission of human immunodeficiency virus type 1 with zidovudine treatment. Pediatric AIDS Clinical Trials Group Protocol 076 Study Group. N Engl J Med 1994; 331 : 1173–80. 15. Perinatal HIV Guidelines Working Group. Public health Service Task Force recommendations for the use of antiretroviral drugs in pregnant HIV-1 infected women for maternal health and interventions to reduce perinatal HIV-1 transmission in the United States. Bethesda, MD : National Institutes of Health, 2006. 16. Soudeyns H, Yao XJ, Gao Q, et al. Anti-HIV-1 activity and in vitro toxicity of 2’-deoxy, 3’-thiacytidine (BCH-189), a novel heterocyclic nucleoside analog. Antimicrob Agents Chemother 1991; 35 : 1386–90. 17. Rodrigues A, Faucher P, Batallan A, et al. Mode of delivery of HIV-infected women : a retrospective study of 358 pregnancies followed in the same hospital between 2000 and 2004. Gynecol Obstet Fertil 2006; 34 : 304–11. 18. Guay LA, Musoke P, Fleming T, et al. Intrapartum and neonatal single-dose nevirapine compared with zidovudine for prevention of mother-to-child transmission of HIV-1 in Kampala, Uganda : HIVNET 012 randomized trial. Lancet 1999; 354 : 795–802. 19. Lallemant M, Jourdain G, Le Coeur S, et al. Single-dose perinatal nevirapine plus standard ziduvudine to prevent mother-to-child transmission of HIV-1 in Thailand. N Engl J Med 2004; 351 : 217–28. 20. Newell ML, Dunn DT, Peckham CS, Semprini AE, Pardi G. Vertical transmission of HIV-1 : maternal immune status and obstetric factors. The European Collaborative Study. AIDS 1996; 10 : 1675–81. 21. Plaeger S, Bermudez S, Mikyas Y, et al. Decreased CD8 cell-mediated viral suppression and other immunologic characteristics of women who transmit human immunodeficiency virus to their infants. J Infect Dis 1999; 179 : 1388–94. 22. Pillay T, Zhang HT, Drijfhout JW, et al. Unique acquisition of cytotoxic T-lymphocyte escape mutants in infant human immunodeficiency virus type 1 infection. J Virol 2005; 79 : 12100–5. 23. Wu X, Parast AB, Richardson BA, et al. Neutralization escape variants of human immunodeficiency virus type 1 are transmitted from mother to infant. J Virol 2006; 80 : 835–44. 24. MacDonald KS, Embree J, Njenga S, et al. Mother-child class I HLA concordance increases perinatal human immunodeficiency virus type 1 transmission. J Infect Dis 1998; 177 : 551–6. 25. Cheynier R, Langlade-Demoyen P, Marescot MR, et al. Cytotoxic T lymphocyte responses in the peripheral blood of children born to human immunodeficiency virus-1-infected mothers. Eur J Immunol 1992; 22 : 2211–7. 26. Silvestri G, Soudeyns H, Lapointe N, et al. T-cell receptor Vβ-specific expansions in children from HIV-infected mothers. AIDS 1996; 10 : 549–51. 27. Soudeyns H, Champagne P, Holloway CL, et al. Transient T cell receptor BV-specific expansions of CD4+ and CD8+ T cells during the early phase of pediatric human immunodeficiency virus infection : characterization of expanded cell populations by T cell receptor phenotyping. J Infect Dis 2000; 181 : 107–20. 28. Safrit JT, Ruprecht R, Ferrantelli F, et al. Immunoprophylaxis to prevent mother-to-child transmission of HIV-1. J Acquir Immune Defic Syndr 2004; 35 : 69–77. 29. Xu W, Hofmann-Lehmann R, McClure HM, et al. Passive immunization with human neutralizing monoclonal antibodies : correlates of protective immunity against HIV. Vaccine 2002; 20 : 1956–60. 30. Binley JM, Wrin T, Korber B, et al. Comprehensive cross-clade neutralization analysis of a panel of anti-human immunodeficiency virus type 1 monoclonal antibodies. J Virol 2004; 78 : 13232–52. 31. Thomas SL, Newell ML, Peckham CS, Ades AE, Hall AJ. A review of hepatitis C virus (HCV) vertical transmission : risks of transmission to infants born to mothers with and without HCV viraemia or human immunodeficiency virus infection. Int J Epidemiol 1998; 27 : 108–17. 32. Boucher M, Gruslin A, Delage G, et al. The reproductive care of women living with hepatitis C infection – Les soins de santé en reproduction pour les femmes vivant avec l’hépatite C. Health Canada/Santé Canada and/et SOGC Clinical Practice Guidelines / Directives cliniques de la SOGC. J Soc Obstet Gynaecol Can 2000; 22 : 820–44. 33. Mok J, Pembrey L, Tovo PA, Newell ML, European Paediatric Hepatitis C Virus Network. When does mother to child transmission of hepatitis C virus occur ? Arch Dis Child Fetal Neonatal Ed 2005; 90 : 156–60. 34. Ioannidis JP, Abrams EJ, Ammann A, et al. Perinatal transmission of human immunodeficiency virus type 1 by pregnant women with RNA virus loads < 1000 copies/ml. J Infect Dis 2001; 183 : 539–45. 35. King NJ, Maxwell LE, Kesson AM. Induction of class I major histocompatibility complex antigen expression by West Nile virus on gamma interferon-refractory early murine trophoblast cells. Proc Natl Acad Sci USA 1989; 86 : 911–5. 36. Chi BH, Mudenda V, Levy J, et al. Acute and chronic chorioamnionitis and the risk of perinatal human immunodeficiency virus type 1 transmission. Am J Obs Gynecol 2006; 194 : 174–81. 37. Lauer GM, Nguyen TN, Day CL et al. Human immunodeficiency type 1-hepatitis C virus co-infection : intraindividual comparison of cellular immune responses against two persistent viruses. J Virol 2002; 76 : 2817–26. 38. Gervais A, Bacq Y, Bernuau J, et al. Decrease in serum ALT and increase in serum HCV RNA during pregnancy in women with chronic hepatitis C. J Hepatol 2000; 32 : 293–9. 39. Canobio S, Guilbert C, Troesch M, et al. Differing patterns of liver disease progression and hepatitis C virus (HCV) quasi species evolution in children vertically co-infected with HCV and human immunodeficiency virus type 1. J Clin Microbiol 2004; 42 : 4365–9. 40. Troesch M, Jalbert E, Canobio S, et al. Characterization of humoral and cell-mediated immune responses directed against hepatitis C virus F protein in patients co-infected with hepatitis C virus and HIV-1. AIDS 2005; 19 : 775–84. 41. Troesch M, Meunier I, Lapierre P, et al. Study of a novel hypervariable region in hepatitis C virus (HCV) E2 envelope glycoprotein. Virology 2006; 352 : 357–67. 42. Ferm VH, Willhite C, Kilham L. Teratogenic effects of ribavirin on hamster and rat embryos. Teratology 1978; 17 : 93–101. 43. Dubois J, Hershon L, Carmant L, et al. Toxicity profile of interferon alfa-2b in children : A prospective evaluation. J Pediatr 1999; 135 : 782–5. 44. Akouamba BS, Viel J, Charest H, et al. HIV-1 genetic diversity in antenatal cohort, Canada. Emerg Infect Dis 2005; 11 : 1230–4. 45. Ozaslan E, Yilmaz R, Simsek H, Tatar G. Interferon therapy for acute hepatitis C during pregnancy. Ann Pharmacother 2002; 36 : 1715–8. |