| |
| Med Sci (Paris). 2007 November; 23(11): 975–979. Published online 2007 November 15. doi: 10.1051/medsci/20072311975.Immunologie néonatale et greffe de sang de cordon Emily Charrier, R’Kia Dardari, Annie Michaud, Paulo Cordeiro, and Michel Duval* Laboratoire d’immunovirologie et de recherche sur le sang de cordon, Centre de cancérologie Charles-Bruneau, Centre de recherche, Hôpital Sainte-Justine, Université de Montréal, Montréal (Québec), Canada Service d’Hématologie-Oncologie, CHU Sainte-Justine, 3175, chemin de la Côte-Sainte-Catherine, Montréal, Québec, H3T 1C5 Canada |
Les infections néonatales et la survie de l’espèce Bien que la mise en place des programmes de prévention et de vaccination ait permis de réduire considérablement le taux de mortalité néonatale, l’Organisation Mondiale de la Santé estime que chaque année 1,3 millions de nouveau-nés meurent encore de maladies d’origine infectieuse. Les maladies infectieuses représentent ainsi la première cause de mortalité néonatale. Malgré l’effet négatif certain de ces infections sur la survie de l’espèce, il est surprenant de constater que l’Évolution n’ait pas débouché sur la mise en place de mécanismes de contrôle de ces infections. Le modèle actuellement retenu pour expliquer la vulnérabilité du nouveau-né aux infections est celui de l’immaturité du système immunitaire néonatal. Une autre hypothèse que nous exposerons ici, serait que le système immunitaire du nouveau-né humain est mature, mais qu’il présente des différences fonctionnelles par rapport à celui de l’adulte. Ces différences fonctionnelles, qui le prédisposent aux infections, assureraient une fonction plus importante pour la survie de l’espèce que la protection contre les infections néonatales. |
Les connaissances concernant l’immunologie du nouveau-né ont grandement bénéficié de la disponibilité du sang de cordon, prélevé à partir du placenta par le cordon ombilical après que celui-ci ait été coupé. Contrairement au sang du nouveau-né, le sang de cordon peut être obtenu sans difficulté éthique majeure : le sang de cordon, d’un volume de 50 à 100 ml, est habituellement jeté avec le placenta. Par définition, le système immunitaire du nouveau-né est naïf, c’est-à-dire qu’il n’a jamais été en contact avec un antigène étranger (excepté lors d’infections transmises par la mère, qui s’avèrent très rares). Les lymphocytes T naïfs sont caractérisés par l’expression de l’isoforme CD45RA et une faible expression de CD28. La proportion de cellules présentant ces caractéristiques est, comme prévu, plus importante dans le sang de cordon, comparativement à celui de l’adulte [
1]. Cependant, la diversité du répertoire pré-immun des lymphocytes T néonataux est normale [
2]. On retrouve également dans le sang de cordon des lymphocytes T anti-mélanome, tout comme dans le répertoire pré-immun de l’adulte (Hugo Soudeyns, communication personnelle). La susceptibilité néonatale aux infections est souvent expliquée par la naïveté du système immunitaire du nouveau-né. Cependant, la sévérité de ces infections est moins grande après quelques mois de vie. Or, lors de ces primo-infections, le système immunitaire de l’enfant est également naïf vis-à-vis du germe en cause. |
Le sang de cordon : immature ? Outre son caractère naïf, pré-immun, le système immunitaire du sang de cordon présente des différences fonctionnelles avec celui de l’adulte. L’attribution de ces différences fonctionnelles à une immaturité est cependant une hypothèse contre laquelle militent plusieurs arguments. Nous avons confirmé le fort pourcentage de cellules NK dans le sang de cordon [1,
3]. Le phénotype de ces cellules est identique à celui des NK de l’adulte, à l’exception d’une faible expression des antigènes CD8, CD57, ICAM-1, CD161 et L-sélectine. Leur activité cytotoxique spontanée est faible, mais l’expression de perforine et granzyme, deux molécules effectrices de l’activité cytolytique, est normale. La faible activité cytolytique des cellules NK du sang de cordon est facilement restaurée, en présence d’IL-2 et d’IL-15, ce qui plaide en faveur d’une machinerie cytotoxique mature. De plus, les cellules NK du sang de cordon sont capables de produire de l’interféron-γ (IFN-γ) et de proliférer après un traitement par l’IL-2, de manière comparable à celle de l’adulte. L’ensemble de ces différences n’est pas en faveur d’une immaturité des cellules NK néonatales [3]. Les différences entre les systèmes immunitaires du nouveau-né et de l’adulte concernent aussi les propriétés des cellules dendritiques présentatrices d’antigène. Il existe deux principales sous populations de cellules dendritiques : les cellules dendritiques myéloïdes et les cellules dendritiques plasmacytoïdes (pDC) [
4]. Les pDC constituent la principale source d’interféron-α (IFN-α), qu’elles produisent en réponse au CpG (un dérivé d’ADN viral). Cette production d’IFN-α est considérée comme la première réaction du système immunitaire devant l’intrusion d’un virus, et marque la première étape qui non seulement conduira à l’activation des bras (aussi bien inné qu’adaptatif) de l’immunité mais encore conditionnera cette activité [
5]. Chez l’adulte, les cellules dendritiques myéloïdes représentent 60 % des cellules dendritiques sanguines ; en revanche, dans le sang de cordon, elles ne composent que 25 % des cellules dendritiques [
6]. De plus, elles expriment faiblement les molécules HLA et les molécules d’adhésion, et leur capacité à produire l’IL-12 est réduite [
7,
8]. Néanmoins, elles sont capables d’entrer en maturation et de produire des cytokines, si elles reçoivent les signaux pro-inflammatoires combinés appropriés, comme le LPS et l’IFN-γ [
9]. Les pDC, elles, représentent 75 % des cellules dendritiques du sang de cordon, mais leur production d’IFN-α en réponse au CpG est nulle [
10]. Notre laboratoire a relevé une plus faible expression de molécules de la voie de signalisation menant à la production d’IFN-α (observations non publiées). Cette absence de production d’IFN-α peut expliquer la faible cytotoxicité des cellules NK du sang de cordon puisque nous avons observé que l’incubation de ces cellules avec l’IFN-α restaure leur activité cytotoxique (observations non publiées). Les cytokines, produites au cours d’une réaction immunitaire, jouent un rôle clé dans la polarisation de la réponse adaptative vers Th1 ou Th2. De nombreuses études ont pu mettre en évidence une réduction significative du niveau de l’ARNm et une diminution de la production de nombreuses cytokines pro-inflammatoires (de type Th1) par les cellules mononuclées du sang de cordon [
11–
15]. De plus, quel que soit le stimulus, la production d’IFN-γ dans le sang de cordon est réduite [
16]. Néanmoins, la modeste production de ces cytokines, comme l’IFN-γ, peut être restaurée en incubant les cellules mononucléées du sang de cordon en présence d’IL-12 ou d’IL-15 [
13,
14]. Comparées aux lymphocytes T du sang d’adulte, les cellules T du sang de cordon présentent aussi des différences fonctionnelles : signalisation diminuée via CD28 [
17], diminution de l’expression de CD40 [
18] et expression différentielle des récepteurs de cytokines [
19]. Dans des réactions lymphocytaires mixtes, les cellules T du sang de cordon montrent une alloréactivité réduite comparée à celle de l’adulte [
20]. Malgré ces différences, les cellules T du fœtus sont capables de monter des réponses contre un pathogène comparables à celles de l’adulte [
21]. De plus, des tentatives cliniques de transplantation de foie fœtal ont montré que les cellules T transplantées induisent de manière systématique une réponse allogénique efficace contre les cellules du receveur [
22]. De même, dans un modèle de transplantation hématopoïétique in utero, le rejet du donneur par les cellules T du fœtus receveur révèle la capacité des cellules T fœtales à déclencher des réactions allogéniques efficaces [
23]. |
Le sang de cordon : tolérant La production de cytokines de type Th2 et l’abondance des cellules T régulatrices (Treg) suggèrent que le système immunitaire néonatal est caractérisé par une tolérance aspécifique. Le sang de cordon représente ainsi une excellente source de Treg et leur isolement y est plus facile. Caractérisées par l’expression concomitante des marqueurs CD4 et CD25 et un haut niveau de la protéine nucléaire FoxP3, les Treg régulent négativement les réponses immunitaires, notamment en inhibant la prolifération des cellules T CD4+. L’activité suppressive des Treg issus du sang de cordon est plus puissante et plus constante que celle des Treg issus de l’adulte [
24]. Le phénotype de ces Treg est plus homogène que celui des Treg du sang d’adulte. Par ailleurs, les Treg ont été trouvés dans le thymus, la rate et les ganglions du fœtus humain dès la 14e semaine de gestation [
25]. Plusieurs équipes ont montré que des cytokines de type Th2 sont produites en grande quantité durant la vie fœtale. L’IL-13 est produite abondamment par les cellules T néonatales [
26]. De même, l’IL-10 est produite en forte quantité dans le sang de cordon, notamment par les cellules T et les cellules trophoblastiques du placenta [
27]. De plus, les lymphocytes B CD5+, abondants dans le sang de cordon, sont de grands producteurs d’IL-10 [
28]. Cette cytokine est capable d’induire l’apoptose des cellules dendritiques plasmacytoïdes [
29] et de réduire leur production d’IFN-α en réponse à une stimulation virale [
30]. Ainsi, le déficit fonctionnel complet des cellules dendritiques plasmacytoïdes que nous avons observé dans le sang de cordon pourrait être dépendant de l’IL-10. De plus, l’IL-10 inhibe l’activation des monocytes, des macrophages, des cellules T et NK et la production de cytokines de type Th1. L’IL-10 engendre une population de cellules T régulatrices capable de produire de grandes quantités d’IL-10 et de supprimer les réponses spécifiques à un antigène in vivo et in vitro [29]. |
La greffe de sang de cordon Les caractéristiques du système immunitaire du nouveau-né peuvent être mises à profit pour la greffe de sang de cordon. Utilisée depuis 1988 comme source de cellules souches hématopoïétiques [
31], la greffe de sang de cordon a permis de traiter avec succès des déficits immunitaires congénitaux, des aplasies médullaires congénitales ou acquises, d’autres anomalies innées du métabolisme, ainsi que des hémopathies malignes (leucémies aigues et chroniques). La greffe de sang de cordon présente plusieurs avantages par rapport à une greffe de moelle osseuse non apparentée. Le principal avantage tient à la disponibilité du sang de cordon. Nous avons en effet rapporté que parmi les enfants en attente d’une greffe non apparentée, 68 % seulement trouvent un greffon si la recherche est restreinte à la moelle osseuse ; ce chiffre atteint 99 % si les greffons provenant de sang de cordon sont inclus dans la recherche [
32,
33]. En effet, une moins grande compatibilité HLA entre donneur et receveur peut être acceptée pour une greffe de sang de cordon. De plus, la logistique de la greffe de sang de cordon est plus simple puisque celui-ci est cryopréservé dans des banques de sang, alors que la moelle osseuse doit être prélevée à partir d’un donneur vivant juste avant la greffe. Nous avons ainsi démontré que le temps entre la prise de décision et la transplantation est beaucoup plus court avec le sang de cordon : 25 jours pour le sang placentaire contre 61 jours pour la moelle osseuse [32]. Un autre important avantage du sang de cordon est le faible taux de maladie du greffon contre l’hôte (GvH), complication parfois fatale de la greffe de cellules souches hématopoïétiques. La GvH est une réaction allogénique engendrée par le système immunitaire du donneur qui reconnaît comme étrangères les cellules du receveur. La moindre incidence et la moindre sévérité de la GvH dans les greffes de sang de cordon sont habituellement attribuées à la naïveté ou à l’immaturité du sang de cordon. L’attribution à la naïveté est illogique, puisque les réponses allogéniques ne nécessitent pas un premier contact avec l’antigène pour se développer, comme en témoigne in vitro la réaction lymphocytaire mixte. Nous avons discuté l’argument de la maturité plus haut : la plupart des différences entre système immunitaire néonatal et adulte se corrigent rapidement en fournissant un signal de stimulation de type Th1. Or, la greffe de sang de cordon, comme toute greffe hématopoïétique, est caractérisée par une production majeure de cytokines de type Th1 dès les premiers jours de greffe [
34]. En revanche, le caractère tolérant du sang de cordon expliquerait le faible taux de GvH. L’équilibre Th1/Th2 est biaisé vers Th2 dans le sang de cordon, avec une forte production d’IL-10 par le cytotrophoblaste placentaire et par les cellules B CD5+ néonatales [27, 28]. L’abondance de Treg pourrait également jouer un rôle. En effet, dans un modèle de greffe de moelle osseuse, appauvrie en Treg, on a constaté une augmentation significative du taux de GVHD [
35]. |
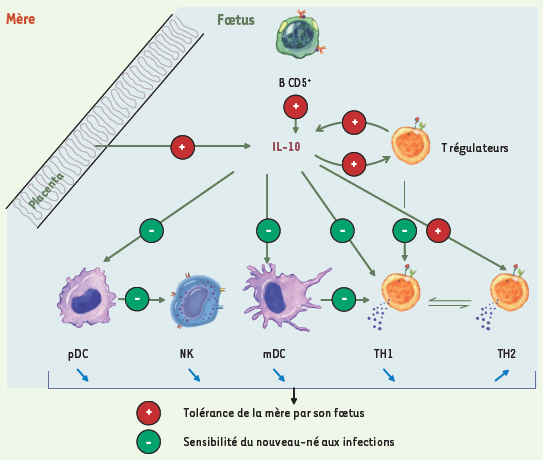
La mère, une allogreffe que le fœtus doit tolérer La sensibilité du nouveau-né aux infections est habituellement attribuée à la naïveté ou à l’immaturité du système immunitaire néonatal. Nous avons vu que la naïveté ne peut pas expliquer cette extrême sensibilité aux pathogènes, et que des différences fonctionnelles existent mais qu’elles sont facilement réversibles par des signaux de type Th1. En revanche, le système immunitaire du nouveau-né est caractérisé par de puissants mécanismes de tolérance reposant sur l’existence conjointe d’un grand nombre de cellules T régulatrices et d’une forte production d’IL-10, partiellement d’origine placentaire. Ces propriétés particulières pourraient aussi expliquer le faible taux de GvH observé après greffe de sang de cordon. Plutôt qu’un déficit par immaturité, nous émettons l’hypothèse qu’il s’agit d’un mécanisme actif d’origine placentaire, mécanisme où l’IL-10 joue un rôle-clé (Figure 1). Puisque durant la gestation, le système immunitaire maternel est exposé aux antigènes paternels présents dans le fœtus, P.B. Medawar a proposé le modèle de fœtus en tant qu’allogreffe [
36]. Nous proposons le modèle symétrique, soit celui de la mère, considéré comme allogreffe à laquelle le fœtus doit être tolérant sous peine de provoquer la mort des deux protagonistes. En faveur de ce modèle, il est intéressant de noter que les cellules T du sang de cordon sont tolérantes aux antigènes HLA maternels in utero, que cette tolérance se poursuit jusqu’à 6 mois après la naissance [
37] et que le trophoblaste des femmes enceintes en pré-éclampsie présente un déficit de production d’IL-10 [
38]. La susceptibilité néonatale aux infections serait donc le prix à payer pour le bon déroulement de la grossesse, processus indispensable à la survie de l’espèce.  | Figure 1.
La nécessaire tolérance du fœtus envers sa mère expliquerait la sensibilité du nouveau-né aux infections. L’IL-10 jouerait un rôle central dans cette tolérance. Produite par les cellules cytotrophoblastiques placentaires et les cellules B CD5+, cette cytokine régule négativement la fonction des cellules dendritiques plamacytoïdes (pDC), les cellules naturelles tueuses (NK), les cellules dendritiques myéloïdes (mDC) et les cellules T effectrices (de type Th1) directement ou indirectement. Elle favorise la réponse des cellules Th2. Une boucle de rétroaction positive s’installe avec les cellules T régulatrices. |
|
Nous remercions nos collègues du groupe de recherche sur la transplantation et l’immunologie du sang de cordon du CHU Sainte-Justine (Caroline Alfieri, Christian Beauséjour, Martin Champagne, Elie Haddad, Nikolaus Heveker, Françoise Le Deist, Hugo Soudeyns, Eric Wagner) et particulièrement le Dr José Menezes. Ce texte a été largement alimenté par leurs réflexions et soutenu par leurs encouragements. Ce travail a été possible grâce au généreux soutien de la Fondation Charles-Bruneau et du Fond de recherche en santé du Québec.
|
1. Theilgaard-Monch K, Raaschou-Jensen K, Palm H, et al. Flow cytometric assessment of lymphocyte subsets, lymphoid progenitors, and hematopoietic stem cells in allogeneic stem cell grafts. Bone Marrow Transplant 2001; 28 : 1073–82. 2. Peggs KS, Verfuerth S, D’Sa S, et al. Assessing diversity: immune reconstitution and T-cell receptor BV spectratype analysis following stem cell transplantation. Br J Haematol 2003; 120 : 154–65. 3. Dalle JH, Menezes J, Wagner E, et al. Characterization of cord blood natural killer cells: Implications for transplantation and neonatal infections. Pediatr Res 2005; 57 : 649–55. 4. Rossi M, Young JW. Human dendritic cells: potent antigen-presenting cells at the crossroads of innate and adaptive immunity. J Immunol 2005; 175 : 1373–81. 5. Liu YJ. IPC: professional type 1 interferon-producing cells and plasmacytoid dendritic cell precursors. Annu Rev Immunol 2005; 23 : 275–306. 6. Borras FE, Matthews NC, Lowdell MW, Navarrete CV. Identification of both myeloid CD11c+ and lymphoid CD11c- dendritic cell subsets in cord blood. Br J Haematol 2001; 113 : 925–31. 7. Hunt DW, Huppertz HI, Jiang HJ, Petty RE. Studies of human cord blood dendritic cells: evidence for functional immaturity. Blood 1994; 84 : 4333–43. 8. Goriely S, Vincart B, Stordeur P, et al. Deficient IL-12(p35) gene expression by dendritic cells derived from neonatal monocytes. J Immunol 2001; 166 : 2141–6. 9. Krumbiegel D, Rohr J, Schmidtke P, et al. Efficient maturation and cytokine production of neonatal DCs requires combined proinflammatory signals. Clin Dev Immunol 2005; 12 : 99–105. 10. De Wit D, Olislagers V, Goriely S, et al. Blood plasmacytoid dendritic cell responses to CpG oligodeoxynucleotides are impaired in human newborns. Blood 2004; 103 : 1030–2. 11. Yan SR, Qing G, Byers DM, et al. Role of MyD88 in diminished tumor necrosis factor alpha production by newborn mononuclear cells in response to lipopolysaccharide. Infect Immun 2004; 72 : 1223–9. 12. Chang M, Suen Y, Lee SM, et al. Transforming growth factor-beta 1, macrophage inflammatory protein-1 alpha, and interleukin-8 gene expression is lower in stimulated human neonatal compared with adult mononuclear cells. Blood 1994; 84 : 118–24. 13. Lee SM, Suen Y, Chang L, et al. Decreased interleukin-12 (IL-12) from activated cord versus adult peripheral blood mononuclear cells and upregulation of interferon-gamma, natural killer, and lymphokine-activated killer activity by IL-12 in cord blood mononuclear cells. Blood 1996; 88 : 945–54. 14. Qian JX, Lee SM, Suen Y, Knoppel E, et al. Decreased interleukin-15 from activated cord versus adult peripheral blood mononuclear cells and the effect of interleukin-15 in upregulating antitumor immune activity and cytokine production in cord blood. Blood 1997; 90 : 3106–17. 15. De WD, Tonon S, Olislagers V, et al. Impaired responses to toll-like receptor 4 and toll-like receptor 3 ligands in human cord blood. J Autoimmun 2003; 21 : 277–81. 16. Wilson CB, Westall J, Johnston L, et al. Decreased production of interferon-gamma by human neonatal cells. Intrinsic and regulatory deficiencies. J Clin Invest 1986; 77 : 860–7. 17. Hassan J, O’Neill S, O’Neill LA, et al. Signalling via CD28 of human naive neonatal T lymphocytes. Clin Exp Immunol 1995; 102 : 192–8. 18. Nonoyama S, Penix LA, Edwards CP, et al. Diminished expression of CD40 ligand by activated neonatal T cells. J Clin Invest 1995; 95 : 66–75. 19. Zola H, Fusco M, Macardle PJ, et al. Expression of cytokine receptors by human cord blood lymphocytes: comparison with adult blood lymphocytes. Pediatr Res 1995; 38 : 397–403. 20. Barbey C, Irion O, Helg C, et al. Characterisation of the cytotoxic alloresponse of cord blood. Bone Marrow Transplant 1998; 22 (suppl 1) : S26–30. 21. Hermann E, Truyens C, Alonso-Vega C, et al. Human fetuses are able to mount an adultlike CD8 T-cell response. Blood 2002; 100 : 2153–8. 22. Renda MC, Fecarotta E, Dieli F, et al. Evidence of alloreactive T lymphocytes in fetal liver: implications for fetal hematopoietic stem cell transplantation. Bone Marrow Transplant 2000; 25 : 135–41. 23. Flake AW, Zanjani ED. In utero hematopoietic stem cell transplantation. A status report. JAMA 1997; 278 : 932–7. 24. Godfrey WR, Spoden DJ, Ge YG, et al. Cord blood CD4+CD25+-derived T regulatory cell lines express FoxP3 protein and manifest potent suppressor function. Blood 2005; 105 : 750–8. 25. Cupedo T, Nagasawa M, Weijer K, et al. Development and activation of regulatory T cells in the human fetus. Eur J Immunol 2005; 35 : 383–90. 26. Ribeiro-do-Couto LM, Boeije LC, Kroon JS, et al. High IL-13 production by human neonatal T cells: neonate immune system regulator ? Eur J Immunol 2001; 31 : 3394–402. 27. Roth I, Corry DB, Locksley RM, et al. Human placental cytotrophoblasts produce the immunosuppressive cytokine interleukin 10. J Exp Med 1996; 184 : 539–48. 28. O’Garra A, Howard M. IL-10 production by CD5 B cells. Ann NY Acad Sci 1992; 651 : 182–99. 29. Moore KW, de Waal MR, Coffman RL, O’Garra A. Interleukin-10 and the interleukin-10 receptor. Annu Rev Immunol 2001; 19 : 683–765. 30. Payvandi F, Amrute S, Fitzgerald-Bocarsly P. Exogenous and endogenous IL-10 regulate IFN-alpha production by peripheral blood mononuclear cells in response to viral stimulation. J Immunol 1998; 160 : 5861–8. 31. Gluckman E, Broxmeyer HA, Auerbach AD, et al. Hematopoietic reconstitution in a patient with Fanconi’s anemia by means of umbilical-cord blood from an HLA-identical sibling. N Engl J Med 1989; 321 : 1174–8. 32. Dalle JH, Duval M, Moghrabi A, et al. Results of an unrelated transplant search strategy using partially HLA-mismatched cord blood as an immediate alternative to HLA-matched bone marrow. Bone Marrow Transplant 2004; 33 : 605–11. 33. Gluckman E, Rocha V, Boyer-Chammard A, et al. Outcome of cord-blood transplantation from related and unrelated donors. Eurocord Transplant Group and the European Blood and Marrow Transplantation Group. N Engl J Med 1997; 337 : 373–81. 34. Holler E. Cytokines, viruses, and graft-versus-host disease. Curr Opin Hematol 2002; 9 : 479–84. 35. Cohen JL, Trenado A, Vasey D, et al. CD4+CD25+ immunoregulatory T Cells: new therapeutics for graft-versus-host disease. J Exp Med 2002; 196 : 401–6. 36. Medawar PB. Immunological tolerance. Science 1961; 133:303–6. 37. Harris DT, Schumacher MJ, LoCascio J, et al. Immunoreactivity of umbilical cord blood and post-partum maternal peripheral blood with regard to HLA-haploidentical transplantation. Bone Marrow Transplant 1994; 14 : 63–8. 38. Rein DT, Breidenbach M, Honscheid B, et al. Preeclamptic women are deficient of interleukin-10 as assessed by cytokine release of trophoblast cells in vitro. Cytokine 2003; 23 : 119–25. |