| |
| Med Sci (Paris). 2007 November; 23(11): 950–956. Published online 2007 November 15. doi: 10.1051/medsci/20072311950.Flux dans l’isthme aortique foetal Nouveau concept physiologique aux potentiels cliniques inexploités Jean-Claude Fouron* Unité de cardiologie foetale, Service de cardiologie, CHU Sainte-Justine, 3175, chemin de la Côte Sainte-Catherine, Montréal, Québec H3T 1C5, Canada |
Il est classiquement admis que deux éléments principaux différencient la dynamique cardio-circulatoire fœtale de la dynamique cardio-circulatoire post-natale [
1,
2] : (1) la disposition en parallèle durant la vie intra-utérine des deux pompes ventriculaires et de leur voie d’éjection artérielle, alors qu’après la naissance les deux ventricules sont disposés en série ; (2) la présence normale chez le fœtus de shunts, l’un intracardiaque (le foramen ovale) et les deux autres extracardiaques (le canal d’Arantius ou ductus venosus et le canal artériel) ; ils disparaissent après la naissance. Il s’agit de notions d’anatomo-physiologie qui n’ont jamais été remises en question. La disposition en parallèle des ventricules fœtaux est irréfutable. Elle explique un certain nombre d’observations hémodynamiques prénatales telles que l’inégalité normale des débits ventriculaires et la capacité fœtale de survivre à l’hypoplasie d’une des pompes cardiaques. À l’évidence, il s’agit de différences majeures. La prise en compte de ces différences est essentielle pour éviter les incohérences qu’entraîne l’interprétation de phénomènes hémodynamiques fœtaux à la lumière de notions établies en période post-natales. La description d’un shunt de droite à gauche réalisé par le canal artériel fœtal en est un bel exemple. Par définition, un shunt dévie de son trajet normal une partie d’un volume circulant. Ainsi, la persistance d’un canal artériel chez un nouveau-né va créer un shunt dont la direction systémique ou pulmonaire dépendra de l’équilibre des résistances de part et d’autre du canal ; le shunt sera en général de gauche à droite avec la chute des résistances vasculaires pulmonaires, déviant ainsi un certain nombre de globules de leur destination normale qui est la circulation sous-diaphragmatique. En revanche, si, durant la vie fœtale, le sang qui emprunte l’arche pulmonaire et le canal artériel pour se rendre à l’aorte descendante continue d’être considéré comme un shunt de droite à gauche, comme il est classiquement décrit, il faudrait alors conclure qu’une partie du débit du tronc pulmonaire est déviée de sa destination première qui serait les poumons et que les deux ventricules sont, comme dans la vie post-natale, disposés en série. Considérer le canal artériel fœtal comme un shunt et, en même temps, affirmer que cette circulation est perfusée par deux pompes en parallèle est tout à fait irrationnel. |
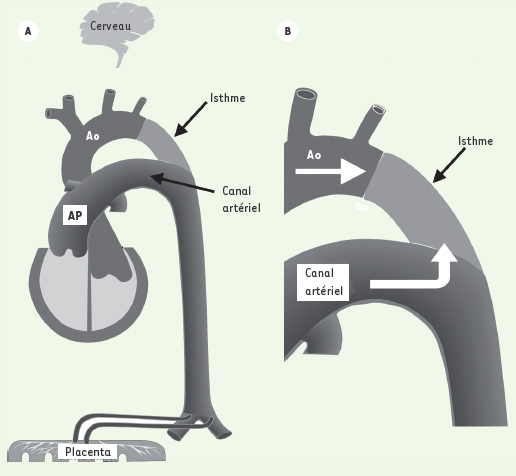
Nouveau concept physiologique À l’évidence, durant la vie intra-utérine, le segment vasculaire artériel qui se conforme à la définition d’un shunt et se comporte comme un shunt est l’isthme aortique. Ce petit segment vasculaire localisé entre l’origine de l’artère sous-clavière gauche et l’extrémité aortique du canal artériel établit, en effet, une communication entre les 2 voies artérielles qui perfusent en parallèle le système circulatoire supra et infra-diaphragmatique du fœtus (Figure 1A). Ce nouveau concept a été proposé en 2003 [
3] à la suite de nombreux travaux expérimentaux et cliniques [
4–
9]. 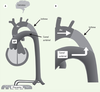 | Figure 1.
A. Position particulière de l’isthme aortique intercalé entre les arches aortique et pulmonaire disposées en parallèle. Ce schéma illustre bien le fait que le canal artériel est une partie intégrante de l’arche pulmonaire. Le cerveau et le placenta représentent chacun d’eux la zone de plus faible résistance au sein des circuits sus et sous-diaphragmatiques respectivement. L’équilibre entre ces deux réseaux de faible résistance dicte l’orientation du flux dans l’isthme. B. Cet agrandissement de la région de l’isthme montre l’effet opposé des éjections ventriculaires droite et gauche sur l’orientation du flux isthmique. Le ventricule gauche (flèche rectiligne) a un effet antérograde alors que le ventricule droit (flèche à angle droit) influence le flux dans l’isthme de façon rétrograde. |
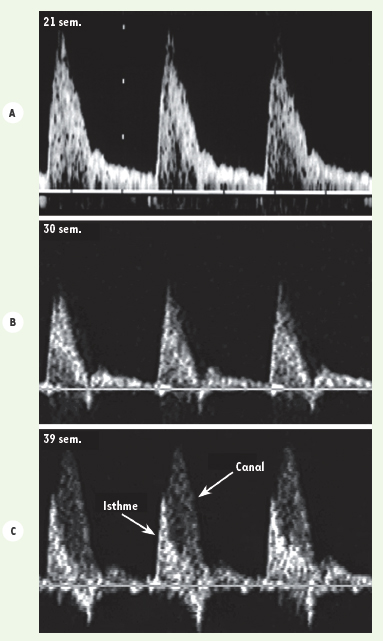
Puisque l’isthme aortique fœtal est intercalé entre les deux voies artérielles aortique et pulmonaire disposées en parallèle, l’éjection systolique aura sur le shunt isthmique une influence opposée, antérograde pour le ventricule gauche et rétrograde pour le ventricule droit (Figure 1B). À l’influence ventriculaire, s’ajoute concomitamment l’impédance respective des lits vasculaires supra et infradiaphragmatique. En diastole, les 2 valves semi-lunaires étant fermées, seule persiste l’influence des impédances périphériques. Dans les conditions normales, la très faible résistance offerte par le réseau vasculaire placentaire est la cause d’un flux isthmique antérograde tant en systole qu’en diastole. Les changements cardio-circulatoires observés au cours du développement fœtal normal entraînent une diminution progressive du flux antérograde dans l’isthme à cause, d’une part, de l’effet frénateur rétrograde de la prépondérance ventriculaire droite du 3e trimestre et, d’autre part, de la diminution des résistances vasculaires cérébrales durant la même période [
10] au moment où celles du placenta demeurent inchangées [
11]. Ce changement quantitatif s’accompagne d’une modification de la courbe des vélocités-Doppler dans l’isthme ; entre la 25e et la 30e semaine de gestation apparaît, en effet, une petite incisure télésystolique qui va s’accentuer progressivement pour devenir, à terme, franchement rétrograde (Figure 2). Ce phénomène est lié à l’influence de plus en plus prépondérante du flux provenant du canal artériel [
12]. 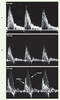 | Figure 2.
Modification du profil des vélocités-Doppler dans l’isthme selon l’âge de gestation. Ces tracés sont obtenus chez des fœtus humains tout à fait normaux mais d’âges gestationnels différents. La ligne de base correspond au niveau zéro de vélocité sanguine. Au-dessus de cette ligne de base, les vélocités sont antérogrades et en-dessous rétrograde. Le lecteur notera que le profil de ces vélocités est tout à fait comparable à celui des enregistrements endovasculaires de la pression artérielle responsables du déplacement sanguin. A. Fœtus de 21 semaines : un flux antérograde systolo-diastolique est observé. B. Fœtus de 30 semaines : on voit apparaître une incisure télésystolique avec léger reflux rétrograde. C. Fœtus à terme : les vélocités tant systoliques que diastoliques sont diminuées au niveau de l’isthme. En revanche, le flux dans le canal vu en superposition est nettement prédominant et est responsable de la réduction des vélocités isthmiques antérogrades en mésosystole ; ces vélocités deviennent rétrogrades en télésystole. |
|
Reconnaître que le flux dans l’isthme aortique est un shunt entre deux réseaux artériels parallèles ouvre la voie à de nombreuses applications cliniques englobant tant la performance des deux ventricules que les changements vasculaires périphériques. Le volume et l’orientation du flux à travers l’isthme peuvent être évalués de façon non invasive par l’enregistrement ultrasonographique des vélocités sanguines fondé sur l’effet Doppler. Cet effet découle fondamentalement des 2 principes suivants : (1) lorsqu’une onde se déplace dans un milieu conducteur à partir d’une source fixe vers un observateur fixe, sa longueur d’onde demeure parfaitement stable ; (2) si l’un des deux (source ou observateur) se déplace, la longueur d’onde sera comprimée ou étirée selon le sens du déplacement. On parle alors de glissement de la longueur d’onde initiale. Dans le domaine cardio-vasculaire, la source (qui se déplace) est le globule rouge et l’observateur (qui est fixe) est la sonde ultrasonographique. Tous ces phénomènes sont régis par des équations rigoureuses. Un échantillon Doppler placé dans l’arc aortique entre le point de départ de la sous-clavière gauche et l’abouchement aortique du canal artériel permet d’enregistrer les vélocités sanguines isthmiques de façon fiable. Les ventricules Comme nous l’avons mentionné précédemment, dans les conditions normales, les répercussions d’une dysfonction ventriculaire exercent une influence opposée sur le débit et l’orientation du flux isthmique selon qu’il s’agit du ventricule gauche ou du ventricule droit. Il faut rappeler que les mécanismes d’adaptation à la présence d’une obstruction à l’éjection ventriculaire en période fœtale sont fort différents de ceux observés durant la vie extra-utérine. Après la naissance, en effet, une sténose d’une des deux voies d’éjection peut longtemps être associée à un débit ventriculaire normal grâce à la présence d’un gradient (différence de pression) de part et d’autre de la lésion. Dans ces circonstances, le gradient est un critère fiable de la sévérité de la sténose. Ce mécanisme opère peu ou pas durant la vie fœtale où tout obstacle le long d’une voie d’entrée ou de sortie d’une des pompes cardiaques s’accompagne d’un phénomène de redistribution sanguine vers la pompe non affectée. Cette déviation cause une chute du débit à hauteur de la sténose et réduit la fiabilité du gradient dans l’évaluation de sa sévérité. En revanche, l’évaluation du flux dans l’isthme ne souffre pas d’une telle lacune. Dysfonction gauche Une baisse du débit ventriculaire gauche a pour effet de réduire le flux systolique antérograde normalement observé dans l’isthme ; en contrepartie, l’augmentation compensatrice du débit droit accentue l’influence rétrograde du flux arrivant par le canal. Si le flux isthmique quoique réduit demeure antérograde, on peut conclure que le volume d’éjection est suffisant pour assurer une perfusion des tissus de la région supradiaphragmatique et, en partie, de la région sous-diaphragmatique. Ce constat permet de prédire une prise en charge totale du débit systémique par le ventricule gauche après la naissance. À l’inverse, un flux systolique rétrograde dans l’isthme traduit une réduction sévère du débit ventriculaire gauche. En période post-natale, on peut s’attendre à ce que la perfusion systémique dépende en grande partie du shunt de droite à gauche par le canal. L’hypoplasie du cœur gauche (HCG) représente la forme extrême d’une telle situation au cours de laquelle le ventricule droit assure seul la perfusion des deux réseaux artériels pulmonaire et aortique tant en période fœtale que post-natale. Cependant, le fœtus atteint d’HCG se singularise par la présence d’un flux isthmique diastolique normal, antérograde, lié à la faible résistance vasculaire placentaire. Ce flux diastolique antérograde peut être considéré comme un véritable « vol placentaire » ravissant aux régions supra-diaphragmatiques une partie du volume sanguin qui lui était destinée. Dysfonction droite Pour les raisons exposées précédemment, toute baisse du débit droit s’accompagne d’une augmentation de l’éjection gauche et secondairement du flux systolique antérograde isthmique. Dans les sténoses de la voie de chasse droite, avec (tétralogie de Fallot) ou sans communication interventriculaire, cet hyper débit gauche explique, d’une part, l’absence du rétrécissement isthmique lié normalement à la prépondérance ventriculaire droite en fin de gestation et, d’autre part, l’extrême rareté d’une coarctation de l’aorte associée. Dans les atteintes fonctionnelles droites sévères, le débit pulmonaire est assuré en tout (atrésie pulmonaire) ou en partie (sténose pulmonaire critique) par du flux provenant de l’isthme et du ventricule gauche, perfusant de façon rétrograde le canal artériel et l’arche pulmonaire. La détection au Doppler d’un flux systolique rétrograde dans le canal artériel demeure, durant la vie fœtale, un des critères prédictifs fiables de la nécessité de maintenir en période post-natale la perméabilité du canal artériel pour une perfusion pulmonaire et une hématose adéquates. La circulation périphérique Toutes les variations de débit ou de résistance dans l’un ou l’autre des réseaux vasculaires disposés en parallèle modifient profondément la dynamique du shunt isthmique. Le tableau observé diffère selon le réseau vasculaire affecté. Réseau vasculaire supradiaphragmatique (à l’exception des poumons) Les fistules artério-veineuses cérébrales représentent l’exemple clinique typique d’une chute isolée des impédances vasculaires dans ce réseau. L’investigation Doppler met en évidence dans ces cas une dynamique circulatoire particulière qui s’explique par les modifications de la précharge ventriculaire droite [
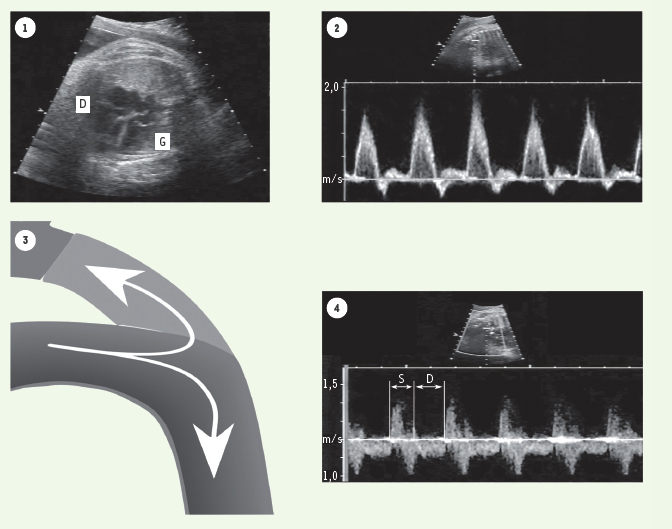
13] : le court-circuit artério-veineux de la fistule entraîne une importante augmentation du retour veineux par la veine cave supérieure dont le sang est, chez le fœtus, drainé en totalité vers le ventricule droit. Cette dynamique explique la dilatation ventriculaire droite observée en période pré et post-natale dans ces cas (Figure 3-1, 3-2). Grâce à l’hyper débit secondaire dans l’arche pulmonaire, on assiste à un véritable partage des eaux à l’extrémité aortique du canal artériel, bien illustré dans la Figure 3 (3-3 et 3-4) : une partie du flux provenant du canal suit l’orientation normale vers l’aorte descendante, l’autre partie emprunte la voie isthmique de façon rétrograde dès la deuxième moitié de la systole et durant toute la diastole. 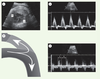 | Figure 3.
Illustration de l’impact d’une fistule artério-veineuse cérébrale chez un fœtus de 38 semaines. 1. Image des 4 cavités cardiaques montrant une dilatation de la cavité ventriculaire droite (D : droit, G : gauche). 2. Onde de vélocité dans le canal artériel ; les pics de vélocité atteignent 1,5 m/s témoignant d’un hyperdébit. 3. Diagramme illustrant la répartition du flux sanguin au niveau de la jonction canal artériel-isthme aortique : une partie du volume sanguin s’oriente de façon rétrograde dans l’isthme vers la circulation cérébrale et l’autre suit la voie habituelle vers l’aorte descendante. Ce diagramme explique le profil des vélocités dans l’isthme illustré en 4 : un flux systolique antérograde provenant de l’aorte est observé dans la première moitié de la systole rapidement suivi par un important flux rétrograde alimenté par le volume sanguin provenant du canal artériel et qui se poursuit durant toute la diastole (S : systole, D : diastole). Dans les 2 tracés-Doppler, le fœtus est en décubitus ventral, la colonne étant dans la partie supérieure de l’image témoin ; les ondes de vélocités antérogrades sont au-dessus de la ligne de base et les ondes rétrogrades en dessous (pour la compréhension du tracé, voir les explications fournies dans la légende de la Figure 2) |
Réseau vasculaire sous-diaphragmatique Une chute de l’impédance vasculaire peut être créée par une fistule artério-veineuse dans ce réseau ; tératome sacro-coxygéen, chorio-angiome placentaire ou hémangiome hépatique en sont des exemples. Le tableau hémodynamique est ici très différent de celui décrit précédemment pour les fistules artério-veineuses cérébrales. L’augmentation du retour veineux est dans ces cas prise en charge par la veine cave inférieure et la surcharge diastolique est biventriculaire. En effet, même si une portion variable du sang de la veine cave inférieure traverse le foramen ovale et participe à la précharge ventriculaire gauche [
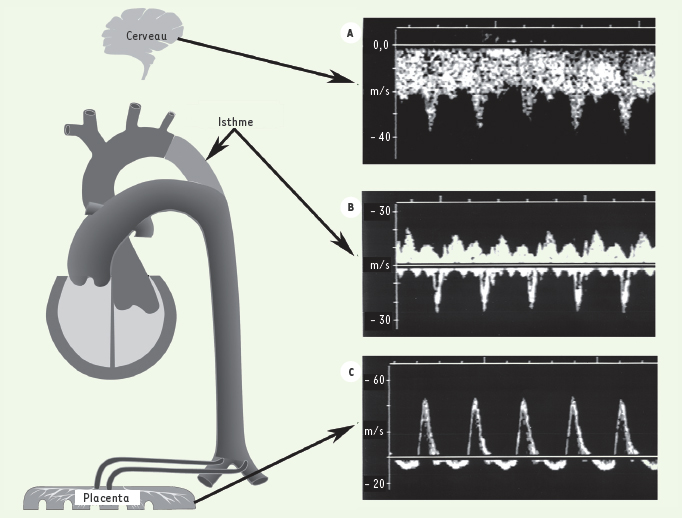
14], toute augmentation isolée du débit gauche est drainée durant la vie fœtale par la veine cave supérieure vers le ventricule droit. Ces observations expliquent bien le peu de répercussions qu’ont sur l’orientation du flux isthmique les baisses d’impédance dans la circulation sous-diaphragmatique. La situation est tout autre en présence d’une augmentation de la résistance au flux sanguin dans ce même réseau. L’exemple clinique le plus fréquent est celui du retard de croissance intra-utérin (RCIU) par insuffisance circulatoire placentaire. Dans cette situation, la résistance placentaire s’élève alors que normalement elle est la plus faible de tout le réseau vasculaire fœtal. L’augmentation des résistances placentaires s’accompagne également d’une réduction du débit ombilical et, secondairement, d’une hypoxémie fœtale, autre élément déterminant en ce qui concerne l’orientation du flux isthmique. En effet, l’hypoxémie fœtale cause, d’une part, une vasoconstriction mésentérique qui s’ajoute à la pathologie placentaire pour accroître l’élévation des résistances sous-diaphragmatiques et, d’autre part, une vaso-dilatation coronarienne et cérébrale qui fait chuter les résistances supra-diaphragmatiques. Ces deux facteurs se conjuguent pour perturber précocement cet équilibre entre les résistances périphériques des deux réseaux supra et sous-diaphragmatiques, équilibre qui dicte l’orientation diastolique du flux isthmique. Pour toutes ces raisons, les variations d’orientation du shunt isthmique en présence d’un RCIU sont souvent plus sévères que celles observées dans l’artère ombilicale qu’elles précèdent [4]. La figure 4 illustre les répercussions circulatoires causées par une insuffisance circulatoire placentaire sévère. 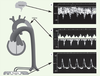 | Figure 4.
Répercussions d’une insuffisance circulatoire placentaire sévère. A. Vasodilatation cérébrale qui se traduit par une augmentation importante du flux diastolique. B. Au niveau de l’isthme aortique, le flux diastolique est rétrograde et nettement supérieur à l’onde systolique antérograde.C. Profil des vélocités dans l’artère ombilicale montrant un flux diastolique rétrograde holodiastolique. à noter que, dans les deux premiers tracés, à cause de la position du fœtus, le flux antérograde s’inscrit au-dessous de la ligne de référence 0, et le flux rétrograde au-dessus. |
Dans le contexte d’un RCIU, un index du flux isthmique (IFI) (flux systolique + flux diastolique/flux systolique) a été proposé [9]. Cinq types de IFI peuvent être observés : Type I : IFI > 1 témoignant d’un flux antérograde systolo-diastolique ; type 2 : IFI = 1 quand le flux diastolique est absent ; type 3 : 1 < IFI > 0, indique l’apparition d’un petit flux diastolique rétrograde mais avec un flux antérograde dominant ; type 4 : IFI = 0 quand les volumes antérograde et rétrograde sont égaux, la résultante étant une absence effective de flux dans l’isthme ; type 5 : IFI < 0, l’index est alors négatif témoignant d’une prédominance du flux rétrograde. La surveillance du flux isthmique au cours de l’évolution d’un RCIU pourrait jouer un rôle majeur dans la recherche de critères prénataux visant à prévenir les atteintes hypoxiques cérébrales. L’hypothèse suivante est proposée : avec l’apparition d’un flux rétrograde dans l’isthme, des globules rouges pré-placentaires, pauvres en oxygène et en substrats essentiels au développement, contaminent le sang destiné au cerveau et exposent le fœtus au risque de subir des lésions cérébrales irréversibles. Il n’existe, pour le moment, aucun signe permettant de repérer le fœtus souffrant d’une insuffisance circulatoire placentaire apparemment compensée chez lequel la décompensation est imminente. Les premiers résultats cliniques démontrent bien que tous les fœtus chez lesquels un flux diastolique rétrograde dominant est noté dans l’isthme (IFI du type 5), ont un neuro-développement post-natal anormal [
8,
15]. Manifestement, l’extraction fœtale a été pratiquée trop tardivement chez ces fœtus. Des travaux préliminaires portant sur un nombre relativement restreint de fœtus, suggèrent qu’un IFI de 0,7 (type 3) représenterait le niveau au-dessous duquel le risque d’atteintes neurologiques deviendrait significativement plus élevé [
16]. D’autres études multicentriques avec un plus grand nombre de sujets sont indispensables pour établir avec plus d’assurance cette valeur d’IFI sur laquelle pourrait être fondée la décision d’extraction d’un fœtus souffrant de RCIU. |
Les données accumulées, tant expérimentales que cliniques, permettent donc de conclure que l’isthme aortique, et non le canal artériel, est le seul shunt artériel de la circulation fœtale. L’observation ultrasonographique par méthode-Doppler du flux dans l’isthme constitue un outil supplémentaire et précieux d’évaluation de la sévérité des atteintes fonctionnelles ventriculaires cardiaques ; elle permet d’apprécier les perturbations hémodynamiques créées par des pathologies vasculaires périphériques et, plus précisément dans les cas de retard de croissance par insuffisance placentaire, offre une méthode d’estimation indirecte de l’oxygénation cérébrale. |
1. Rudolph AM, Heymann MA. Circulatory changes during growth in the fetal lamb. Circ Res 1970; 26 : 289–99. 2. Kenny JF, Plappert T, Doubilet P, et al. Changes in intracardiac blood flow velocities and right and left ventricular stroke volume with gestational age in the normal human fetus : a prospective Doppler echocardiographic study. Circulation 1986; 74 : 1208–16. 3. Fouron JC. The unrecognized physiological and clinical significance of the fetal aortic isthmus. Ultrasound Obstet Gynecol 2003; 22 : 4417. 4. Fouron JC, Skoll A, Sonesson SE, et al. Relationship between the flow through fetal aortic isthmus and cerebral oxygenation during placental circulatory insufficiency. Am J Obstet Gynecol 1999; 181 : 11020–7. 5. Fouron JC, Teyssier G, Maroto E, et al. Diastolic circulatory dynamics in the presence of elevated placental resistance and retrograde diastolic flow in the umbilical artery. A Doppler echographic study in lambs. Am J Obstet Gynecol 1991; 164 : 195–203. 6. Fouron JC, Teyssier G, Bonnin P, et al. Blood flow velocity profile in the fetal aortic isthmus : a sensitive indicator of changes in systemic peripheral resistances. II. Preliminary clinical observations. J Matern Fetal Invest 1993; 3 : 219–24. 7. Bonnin P, Fouron JC, Teyssier G, et al. Quantitative assessment of circulatory changes in the fetal aortic isthmus during progressive increase of resistance to umbilical blood flow. Circulation 1999; 88 : 216–22. 8. Fouron JC, Gosselin J, Amiel-Tison C, et al. Correlation between prenatal velocity waveforms in the aortic isthmus and neurodevelopmental outcome between the ages of 2 and 4 years. Am J Obstet Gynecol 2001; 184 : 630–6. 9. Ruskamp JM, Fouron JC, Raboisson MJ, et al. Reference values for an index of fetal aortic isthmus blood flow during the second half of pregnancy. Ultrasound Obstet Gynecol 2003; 21 : 441–4. 10. Mari G, Deter RL. Middle cerebral artery flow velocity waveforms in normal and small-for-gestational-age fetuses. Am J Obstet Gynecol 1992; 166 : 1262–70. 11. Sonesson SE, Fouron JC, Drblik SP, et al. Reference values for Doppler velocimetric indices from the feta land placental ends of the umbilical artery during normal pregnancy. J Clin Ultrasound 1993; 21 : 317–24. 12. Schmidt KG, Silverman NH, Rudolph AM. Phasic flow events at the aortic isthmus : ductus arteriosus junction and branch pulmonary artery evaluated by multimodal ultrasonography in fetal lambs. Am J Obstet Gynecol 1998; 179 : 1338–47. 13. Patton DJ, Fouron JC. Cerebral arteriovenous malformation : comparison of pre- and postnatal central blood flow dynamics. Pediatr Cardiol 1995; 16 : 141–4. 14. Rasanen J, Wood DC, Weiner S, et al. Role of the pulmonary circulation in the distribution of human fetal cardiac output during the second half of pregnancy. Circulation 1996; 94 : 1068–73. 15. Mäkikallio K, Jouppila P, Räsänen J. Retrograde net blood flow in the aortic isthmus in relation to human fetal arterial and venous circulations. Ultrasound
Obstet Gynecol 2002; 19 : 147–52. 16. Fouron JC, Gosselin J, Raboisson MJ, et al. The relationship between an aortic isthmus blood flow velocity index and the postnatal neurodevelopmental status of fetuses with placental circulatory insufficiency. Am J Obstet Gynecol 2005; 192 : 497–503. |