| |
| Med Sci (Paris). 2007 November; 23(11): 929–933. Published online 2007 November 15. doi: 10.1051/medsci/20072311929.Nouveau modèle animal d’épilepsie temporale Lionel Carmant* D. Clinique d’épilepsie Centre de recherche sur l’épilepsie, Service de neurologie, CHU Sainte-Justine, Université de Montréal, 3175, Côte Sainte- Catherine, Bureau A-714, Montréal, Québec, H3T 1C5 Canada |
L’épilepsie temporale est la cause la plus fréquente d’épilepsie réfractaire au traitement médical. Elle est associée à de nombreuses perturbations co-morbides comme, par exemple, des troubles mnésiques, des troubles d’apprentissage, un absentéisme accru, la dépression et le suicide [
1]. Depuis longtemps déjà l’on a noté que la plupart des patients opérés pour une épilepsie temporale réfractaire avaient subi en bas âge une convulsion fébrile prolongée [
2]. Cependant, un lien physiopathologique n’avait jamais pu être établi entre les convulsions fébriles et l’épilepsie temporale tant chez l’humain que dans les modèles animaux [
3,
4]. Et ce bien que de nombreuses études rétrospectives aient montré une association nette entre les deux phénomènes [2]. En fait, les convulsions fébriles sont les crises les plus fréquentes chez l’humain : elles surviennent chez 5 % et plus des enfants âgés de 3 mois à 6 ans [
5]. Les convulsions fébriles sont cependant considérées comme bénignes : car elles ne sont pas associées à un risque significativement accru d’épilepsie. D’ailleurs, aucune règle n’indique aux cliniciens de prescrire un examen d’imagerie ni de traiter les enfants victimes d’une convulsion fébrile [
6]. Quoiqu’il en soit, les convulsions fébriles se divisent en 2 sous-groupes selon leurs caractéristiques cliniques. Les convulsions fébriles simples sont des convulsions généralisées de courte durée (< 15 minutes), survenant une seule fois lors d’une période de 24 heures et n’entraînant pas de déficit neurologique. Ces convulsions fébriles simples ne semblent avoir aucune conséquence sur le développement de l’enfant. Et les études montrent que pour ces enfants, seulement 2 % vont présenter une épilepsie avant l’âge de 7 ans et seulement 2,4 % si on les suit jusqu’à 25 ans (contre 1,5 % de la population générale) [6]. Un deuxième sous-groupe de convulsions fébriles est classé comme atypique. Il s’agit des convulsions qui sont prolongées (> 15 minutes), récidivantes dans les 24 heures, latéralisées ou suivies d’un déficit neurologique focal. Ces convulsions atypiques représentent de 20 à 30 % des convulsions fébriles. Chez les enfants qui en sont victimes, le risque d’épilepsie augmente considérablement, allant même jusqu’à 49 % pour ceux qui comptent tous les critères d’atypie [1]. Une étude menée dans notre population a montré des résultats similaires. En effet, nous avons remarqué, chez les patients victimes de convulsions fébriles atypiques, que quelque 32 % étaient exposés à un risque accru de subir des crises d’épilepsie partielle [
7]. En nous fondant sur ces observations cliniques, nous voulions répondre, en nous servant d’un modèle animal, à deux questions fondamentales. Premièrement : pourquoi certains enfants font-ils des convulsions prolongées ? Deuxièmement : ces convulsions prolongées conduisent-elles à l’installation de l’épilepsie temporale ou ne sont-elles que l’expression précoce d’une épilepsie sous-jacente ? Pour ce faire, nous avons émis les deux hypothèses suivantes : les convulsions fébriles prolongées surviennent chez des individus qui ont une prédisposition et l’épilepsie se manifeste chez les individus ayant une fragilité provenant d’une convulsion prolongée ; il s’agit du two-hit hypothesis qui avait été envisagé dans d’autres modèles chez l’animal immature [
8]. |
Pour appuyer notre double hypothèse de travail, nous avons effectué une étude rétrospective auprès des enfants opérés pour épilepsie temporale au Centre hospitalier universitaire Sainte-Justine. Nous avons consulté les dossiers médicaux de tous les enfants qui ont subi une lobectomie temporale pour des convulsions réfractaires entre 1979 et 1999 dans notre établissement. Nous avons analysé leur évolution et les avons classifiés en deux groupes : « amélioration significative » (libre de crise ou seulement de rares crises) et « pas d’amélioration significative ». Nous avons réexaminé tous les tissus pathologiques pour tenter de définir la cause de l’épilepsie réfractaire et tenter d’établir une corrélation entre les changements histopathologiques et ceux qu’en donne l’imagerie [
9]. Bien qu’elle ait été effectuée à partir d’une population plus jeune que la moyenne, notre étude (et les données épidémiologiques qui y étaient reliées) était similaire aux autres études sur le sujet. Chez 45 % des enfants, un facteur précipitant avait précédé le début de l’épilepsie : dans la plupart des cas il s’agissait d’une convulsion fébrile prolongée. Le principal mérite de cette étude fut d’avoir décelé la présence chez la plupart des enfants d’une double pathologie soit la co-existence d’une sclérose de l’hippocampe et d’une lésion corticale de type dysplasie corticale ou tumeur de bas grade (66 %) (Figure 1). La sclérose mésiale a également été repérée dans le sous-groupe n’ayant pas de dysplasie corticale (100 %) et était visible en résonance magnétique chez ceux dont l’hippocampe n’avait pas fait l’objet d’un examen histopathologique visible (71 %). Le nombre de doubles pathologies augmente encore plus si on considère les enfants affectés d’une microdysgénésie [
10]. La microdysgénésie est une forme encore plus subtile de dysplasie corticale. Celle-ci ne répond pas à tous les critères diagnostiques de la dysplasie corticale et on peut retrouver ces changements dans la population normale, bien qu’à une fréquence beaucoup plus faible que dans la population des patients opérés pour épilepsie (Figure 2). L’avenir des patients affectés de la double pathologie semblait également moins bon que celui des patients victimes seulement d’une sclérose de l’hippocampe. Le second facteur qui a attiré notre attention tenait au fait que la plupart des malformations corticales n’avaient pas été pas décelées en résonance magnétique. Nous avons donc conclu que la présence d’une lésion corticale développementale prédispose les enfants non seulement aux convulsions fébriles prolongées mais aussi à les exposer à des crises d’épilepsie temporale réfractaire. De plus, ces convulsions fébriles sont suivies d’une période de latence pendant laquelle le patient est asymptomatique ; ce laps de temps correspond à la période d’épileptogenèse. Nous croyons que si les individus porteurs de risque peuvent être identifiés aussitôt après la crise initiale, nous pourrions intervenir durant la période de latence et éviter qu’ils soient sujets à des crises d’épilepsie temporale réfractaire. Nous avons suggéré que les prochaines études prospectives pourraient bénéficier d’imagerie de pointe (IRM 3 ou 7 Tesla) ainsi que d’analyses histopathologiques de haute qualité si nous voulons mieux comprendre l’épilepsie temporale chez l’humain. L’article où figurait cette double recommandation a été très bien reçu dans la communauté des épileptologues et nous y avons perçu un encouragement à continuer nos recherches avec un modèle animal [
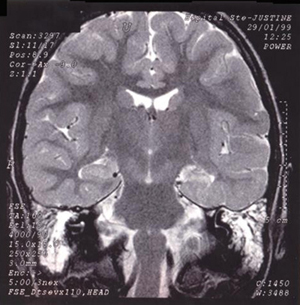
11].  | Figure 1.
Imagerie par résonance magnétique d’un enfant avec épilepsie réfractaire. Le lobe temporal gauche (à droite sur l’image) montre des changements sclérotiques de l’hippocampe caractérisés par un signal hyper-intense en pondération T2, mais aussi une mauvaise différenciation matière blanche-matière grise suggérant la présence d’une dysplasie corticale associée (double pathologie). La plupart des dysplasies corticales dans notre série n’ont pas été détectées par l’imagerie mais plutôt par l’analyse histopathologique. |
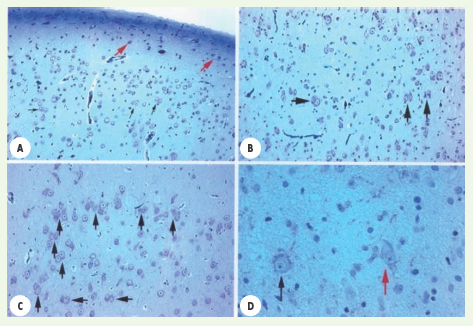
 | Figure 2.
Marqueurs de la dysplasie corticale. La dysplasie corticale comprend 4 critères démontrés deA àD. A. Neurones ectopiques dans la couche 1 (flèches rouges). B. Lamination neuronale désorganisée. C. Amas ectopiques de neurones dans la substance blanche. D. Cellules en ballon. Dans notre série, plusieurs enfants n’avaient que 1 ou 2 de ces critères et ils étaient donc classifiés comme porteurs de microdysgénésie. |
Nous avons donc raffiné notre hypothèse en suggérant qu’une malformation corticale prédispose le cerveau immature aux convulsions fébriles prolongées et que ces mêmes animaux, par suite d’une convulsion fébrile prolongée sont sujets à une épilepsie temporale. |
Il s’agissait, dans un premier temps, de démontrer à l’aide d’un modèle animal que les convulsions fébriles prolongées surviennent chez des individus prédisposés et qu’une malformation corticale subtile pouvait expliquer cette prédisposition. Un bon modèle animal d’épilepsie temporale doit donc pouvoir reproduire la situation tant sur le plan des manifestations cliniques (crises aiguës, période de latence puis épilepsie réfractaire), des changements électrophysiologiques (anomalies épileptiques ayant un départ dans le lobe), des anomalies en neuro-imagerie (atrophie de l’hippocampe), des anomalies histopathologiques (sclérose de l’hippocampe) et une non-réponse au traitement conventionnel. Pour créer ce modèle, nous avons combiné deux modèles animaux : l’un de dysplasie corticale et l’autre de convulsion fébrile. Ces deux ont pour propriété de diminuer le seuil de convulsion chronique mais il n’avait pas été prouvé qu’individuellement chacun d’eux conduisait à une épilepsie chronique. Premièrement nous avons utilisé le modèle de cryolésion de Dvorak et al. [
12]. La lésion se produit en appliquant sur le crâne une tige de 2 mm de diamètre en cuivre après avoir dégagé la peau au-dessus des coordonnées du cortex fronto-pariétal. Après une légère pression, la tige est retirée et la peau réparée. Nous avons de façon reproductible réussi à créer un microgyrus caractérisé par un cortex à 4 couches [
13] (Figure 3). D’autres groupes ont démontré que cette lésion dysplasique entraîne des changements neuroanatomiques et fonctionnels qui facilitent l’excitation du cortex adjacent par une réduction des récepteurs GABAA autour de la lésion mais aussi dans des régions distantes notamment l’hippocampe [
14]. Ces changements sont cependant âge-dépendants et reviennent à la normale autour du trente-cinquième jour de vie (P35). Cependant, ces animaux ne manifestent jamais de convulsion spontanée, ce qui n’en fait pas des modèles pour l’étude de l’épileptogénèse. Notre hypothèse veut que si une convulsion aiguë survient dans cette période de vulnérabilité, la réduction des récepteurs GABAA, associée à la dysplasie, pourrait enrayer les mécanismes d’arrêt des crises convulsives et entraîner une crise prolongée pouvant, quant à elle, déclencher des mécanismes d’épileptogenèse [14]. Cette hypothèse pourrait aussi expliquer l’efficacité des médicaments GABAergiques pour traiter les épilepsies temporales [
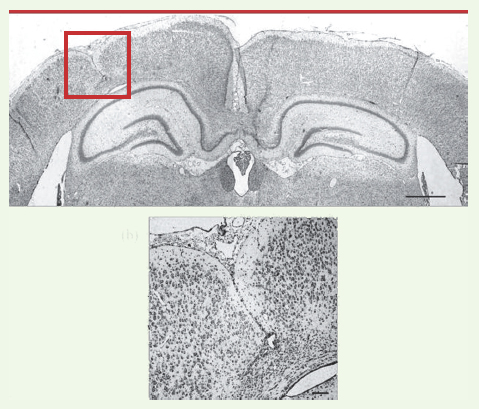
15]. 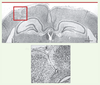 | Figure 3.
Tranche de cerveau d’un animal avec la lésion faite à P1. Nous y voyons un hippocampe mal formé (sur la gauche de la coupe) ainsi que le microgyrus qui chevauche ce même hippocampe. En gros plan, on peut distinguer les 4 couches du cortex du microgyrus. P1 : jour 1 de vie. |
Nous avons donc testé cette hypothèse en exposant nos animaux à un modèle de convulsions fébriles à P10. Le modèle que nous avons utilisé est celui de l’hyperthermie mis au point par l’équipe du laboratoire du Dr Baram [4]. Les animaux sont placés dans une boîte de plexiglas dans laquelle circule de l’air chaud (45-50 °C) propulsé par un séchoir à cheveux muni de deux vitesses inséré au-dessus de la cage. Nous avons cependant modifié le modèle pour que les animaux demeurent dans la boîte jusqu’à ce qu’ils présentent une crise convulsive tonico-clonique. Par la suite, nous les transférons sur une surface à température ambiante pour une période d’observation de trente minutes. Tous les rats exposés à l’hyperthermie font des crises généralisées. En fait, les crises progressent d’une période d’arrêt des activités à l’autre : les myoclonies de la tête sont suivies par des crises cloniques des membres et, finalement, par la crise tonico-clonique généralisée. Cependant les animaux avec la lésion dysplasique préalable présentaient les crises cloniques plus tôt que les animaux contrôles sains (p ≤ 0,05). De plus, la latence entre le début de l’hyperthermie et la convulsion généralisée était plus courte dans le cas des animaux lésés exposés à l’hyperthermie (p ≤ 0,05). Dans tous les cas, les enregistrements EEG simultanés ont montré que la crise part de l’amygdale avant de s’étendre vers le cortex. Lors de ces expériences, nous avons observé un phénomène très important : les animaux lésés présentent les crises généralisées pendant que la température augmente ; ce phénomène est associé à une sécrétion massive de glutamate. Au contraire, les animaux contrôles ne présentent pas de convulsions quand la température augmente mais plus tard quand la température demeure élevée de façon soutenue. Cette observation semble répondre à la question que les observations cliniques avaient jusque-là laissée en suspens : les convulsions fébriles sont-elles attribuables à une augmentation rapide de température ou à une fièvre élevée soutenue ? Nos expériences suggèrent que dans le cerveau prédisposé, une augmentation rapide de température entraîne des convulsions fébriles tandis que dans le cerveau sain, il faut une température élevée prolongée pour provoquer de telles convulsions. Par la suite, nous avons observé les animaux dans leur phase post-ictale. Deux comportements se sont rapidement distingués. Les animaux contrôles revenaient à eux en moins de 10 minutes, tandis que les rats lésés prenaient presque deux fois plus de temps à se remettre de la convulsion. Nous avons donc décidé d’enregistrer leur EEG pendant cette phase de récupération. Ceci fut d’une importance capitale car nous nous sommes rendus compte que les animaux porteurs de la lésion conservaient des signes d’activité électro encéphalographique ce qui expliquait leur période de récupération prolongée. Les animaux contrôles avaient tout simplement un retour progressif vers la normale. Cette première série d’expériences nous a donc permis de conclure que les animaux affectés d’une prédisposition anatomique (dysplasie corticale focale) manifestent des convulsions généralisées plus rapidement que les animaux contrôles et que ces convulsions étaient toujours prolongées. Il nous fallait donc vérifier alors si ces animaux deviendraient épileptiques après une période de latence. Pour ce faire, nous avons travaillé avec une nouvelle série d’animaux, deux mois après la crise initiale, soit à P70. Nous avons commencé à enregistrer les animaux sur vidéo 4,5 heures par jour pendant une période de 10 jours. Lors de cette période d’enregistrement, 36 % des animaux avec lésion ont été diagnostiqués comme épileptiques grâce à l’enregistrement de crises de type limbique c’est-à-dire caractérisées par un arrêt des mouvements avec ou sans myoclonies. Pour confirmer que ces épisodes étaient d’origine épileptique, nous avons implanté des électrodes EEG dans l’amygdale : il nous est alors apparu que 86 % des animaux lésion-hyperthermie produisaient des décharges ictales toutes associés à des épisodes de fixité avec ou sans myoclonie. Bien qu’aucune crise convulsive généralisée n’ait été observée, les animaux épileptiques ont également manifesté une perte de fonction hippocampale. En effet, lorsque nous avons fait des tests de mémoire visuo-spatiale (Morrris Water Maze) nous avons pu démontrer que ces animaux ne présentaient pas de consolidation de leur mémoire visuo-spatiale. Ces changements caractérisent d’autres modèles d’épilepsie temporale [
16]. La seule atypie de notre modèle est le fait qu’à l’examen pathologique, nous n’avons pas décelé de sclérose mésiale de l’hippocampe. Il a cependant été démontré que l’animal immature est résistant à la sclérose mésiale [16]. Nous avons donc évalué la croissance de l’hippocampe chez nos animaux et nous avons confirmé que ces animaux sont affectés d’une atrophie hippocampale progressive. |
Nous croyons que ce nouveau modèle de double pathologie reproduit les caractéristiques de l’épilepsie temporale chez l’enfant. Il nous faut maintenant étudier les mécanismes pathophysiologiques favorisant l’épileptogenèse. En effet, une meilleure compréhension des changements provoqués par la crise initiale et une meilleure connaissance des mécanismes d’épileptogenèse en action durant la période de latence avant l’apparition des crises spontanées pourront nous aider à mettre au point des traitements préventifs (antiépileptogénique) chez l’humain. De plus, avec ce nouveau modèle, nous pouvons étudier l’efficacité de nouveaux agents thérapeutiques conventionnels (anticonvulsivants) dans des conditions beaucoup plus proches de la situation clinique réelle que celles associées aux modèles de l’acide kaïnique ou d’autres neurotoxines. |
1. Kozyrskyj AL, Prasad AN. The burden of seizures in Manitoba children : a population-based study. Can J NeuroSci 2004; 31 : 48–52. 2. Cendes F, Andermann F, Dubeau F, et al. Early childhood prolonged febrile convulsions, atrophy and sclerosis of mesial structures, and temporal lobe epilepsy : an MRI volumetric study. Neurology 1993; 43 : 1083–7. 3. Nelson KB, Ellenberg JS. Predictions of epilepsy in children who have experiences FS. N Engl J Med 1976; 295 : 1029–33. 4. Dubé C, Chen K, Eghbal-Ahmadi M, et al. Prolonged febrile seizures in the immature rat model enhance hippocampal excitability long term. Ann Neurol 2000; 47 : 336–44. 5. Annegers JF, Hauser WA, Shirts SB, Kurland LT. Factors prognostic of unprovoked seizures after febrile convulsions. N Engl J Med 1987; 316 : 493–8. 6. Rosman NP. Evaluation of the child with febrile seizures. In : Baram T. Shinnar S, eds. Febrile seizures. London : Academic Press, 2002 : 266–71. 7. Birca A, Guy N, Fortier I, et al. Genetic influence on the clinical characteristics and outcome of FS. Eur J Paediatr Neurol 2005; 9 : 339–45. 8. Koh S, Storey TW, Santos TC, et al. Early-life seizures in rats increase susceptibility to seizure-induced brain injury in adulthood. Neurology 2001; 57 (suppl 4) : S22–8. 9. Bocti C, Robitaille Y, Diadori P, et al. The pathological basis of temporal lobe epilepsy in childhood. Neurology 2003; 60 : 191–5. 10. Eriksson SH, Malmgren K, Nordborg C. Microdysgenesis in epilepsy. Acta Neurol Scand 2005; 111 : 279–90. 11. Vining EPG. Will the real temporal lobe epilepsy in childhood please stand up ? Epilepsy Curr 2003; 3 : 99–100. 12. Dvorak K, Feit J, Jurankova Z. Experimentally induced focal microgyria and status verrucosus deformis in rats : pathogenesis and interrelation. Histological and autoradiographical study. Acta Neuropathol 1978; 44 : 121–9. 13. Scantlebury MH, Ouellet PL, Psarropoulou C, Carmant L. Freeze lesion-induced focal cortical dysplasia predisposes to atypical hyperthermic seizures in the immature rat. Epilepsia 2004; 45 : 592–600. 14. Prince DA, Jacobs K. Inhibitory function in two models of chronic epileptogenesis. Epilepsy Res 1998; 32 : 83–92. 15. Bélanger S, Coulombe G, Carmant L. Role of vigabatrin and lamotrigine in treatment of childhood epileptic syndromes. Epilepsia 1998; 39 : 878–83. 16. Renaud J, Emond M, Meilleur S, et al. AIDA, a class I metabotropic glutamate-receptor antagonist limits kainate-induced hippocampal dysfunction. Epilepsia 2002; 43 : 1306–17. |