| |
| Med Sci (Paris). 2007 October; 23(10): 862–867. Published online 2007 October 15. doi: 10.1051/medsci/20072310862.Neutrophile et immunité Est-ce inné ou acquis ? Arpita Chakravarti, Isabelle Allaeys, and Patrice E. Poubelle* Centre de recherche en rhumatologie et immunologie, Centre de recherche du CHUL, Département de Médecine, Université Laval, 2705, boulevard Laurier, Bureau T1-49, Sainte-Foy (Québec) G1V 4G2, Canada |
Le polynucléaire neutrophile représente une entité cellulaire facile à caractériser puisqu’elle se distingue par son aspect morphologique original, notamment par son noyau irrégulier formé de plusieurs lobes reliés entre eux. Mais son activité fonctionnelle reste encore, à bien des égards, une énigme. Cette activité complexe ne fait plus de doute compte tenu des multiples modalités d’action de cette cellule « à tout faire ». Les neutrophiles ont, très longtemps, été uniquement considérés comme des cellules de défense de première ligne du fait de leur capacité à ingérer tout élément étranger au « soi ». Cela permet d’expliquer le processus inflammatoire local par la libération de multiples facteurs phlogogéniques reliés, notamment, à l’explosion oxydative et à la dégranulation. En revanche, il n’en est plus de même de ces cellules a u pouvoir de transformation remarquablement souple et rapide leur assurant un rôle dans tous les événements de la défense du « soi » physiologique, mais aussi pathologique. Afin de mieux cerner la complexité fonctionnelle du neutrophile, certains concepts établis depuis longtemps exigent d’être actualisés. Le neutrophile, cellule très différenciée dont l’apparition dans la circulation sanguine est d’emblée associée à sa mort programmée à court terme, peut survivre plusieurs jours dans un contexte inflammatoire. De plus, cette cellule à noyau polylobé et au cytoplasme granulaire ne représente pas une population uniforme, mais plutôt un ensemble de diverses sous-populations fonctionnellement différentes dont le rôle dans le processus inflammatoire varie en fonction de l’étiologie de ce processus. Enfin, le neutrophile, même s’il partage cette propriété avec bien d’autres types cellulaires, a la capacité d’interagir directement avec les diverses cellules de la réaction inflammatoire. Dans l’état actuel de nos connaissances, le neutrophile peut donc être considéré comme une cellule détruisant les micro-organismes, reconnaissant des signaux spécifiques faisant le lien entre l’immunité innée et l’immunité acquise, et pouvant se transformer en cellule directement responsable des défenses acquises. |
Neutrophile et immunité innée La fonction de base du neutrophile est de défendre l’organisme contre les intrus exogènes, que ce soit des bactéries, des virus, des toxines… Cela sous-entend, avant toute activité fonctionnelle, une réponse immédiate de ces cellules aux facteurs d’attraction. La réponse chimiotactique et cinétique importante des neutrophiles leur assure une rapidité de migration au site d’infection bien supérieure à celle des autres types cellulaires. Cette étape de l’immunité innée fait appel à divers types de récepteurs présents à la surface des neutrophiles (exemple : récepteurs pour certains fragments du complément, fragments Fc des immunoglobulines, mannose, β-glucan…) pour la capture des pathogènes. À cette liste non exhaustive doivent être ajoutés les récepteurs Toll (TLR)1 qui représentent certainement une des voies de reconnaissance les plus importantes et les plus sophistiquées [
1]. Ces récepteurs membranaires reconnaissent certains motifs spécifiques, notamment des membranes de micro-organismes, afin de mettre en place une défense adaptée pour lutter contre une infection. Une fois le pathogène reconnu, celui-ci est progressivement ingéré en passant par diverses étapes intra-cellulaires de dégradation et de digestion. Certaines armes anti-infectieuses, initialement monocytaires, font également partie de l’arsenal granulaire du neutrophile. C’est le cas, par exemple, des défensines, de la perforine et des granzymes [
2,
3]. Le neutrophile peut aussi assurer une défense innée en libérant des protéines granulaires et de la chromatine afin de former un réseau de fibres extra-cellulaires capables de fixer les bactéries et d’en diminuer la virulence [
4]. L’hétérogénéité des neutrophiles permet aussi de comprendre les différences entre individus quant à leur capacité de défense contre les micro-organismes. En effet, à côté de neutrophiles dits normaux n’exprimant pas spontanément cytokines et chimiokines, des sous-populations de neutrophiles expriment de façon variable des cytokines comme l’IL-12 ou l’IL-10, des chimiokines comme CCL3 ou CCL2, des TLR comme TLR5-TLR8 ou TLR7-TLR9. Cette découverte s’est faite à partir d’hôtes présentant soit une résistance, soit une sensibilité aux Staphylococcus
aureus résistants à la méthicilline [
5]. Aux premiers signaux d’attraction reconnus par les neutrophiles s’associe une activation plus ou moins durable de ces cellules en fonction du type de processus dans lequel elles interviennent. L’élément essentiel, dès ce stade de « provocation » du neutrophile, est le retard de survenue de sa mort programmée dont l’activation est spontanée [
6–
8]. La mort programmée du neutrophile s’explique, entre autres, par des mécanismes dépendants de la voie des caspases pouvant être activés de façon extrinsèque (via TNFα et FasL) et intrinsèque (via les mitochondries [
9]), mais aussi par des mécanismes indépendants des caspases [
10]. Cette mort programmée peut prendre l’aspect d’une apoptose avec, notamment, des modifications nucléaires par fragmentation de la chromatine. Elle peut être aussi de type non apoptotique avec essentiellement une vacuolisation cytoplasmique correspondant à de l’autophagie [
11]. Ces diverses voies de mort cellulaire sont retrouvées au cours du processus inflammatoire et semblent dépendre de la concentration locale accrue en oxygène [11,
12]. Le retard de la mort du neutrophile est associé à divers facteurs présents au cours du processus inflammatoire (exemple : G-CSF, GM-CSF, IFN-γ, IL-8, -1β, -4, TNFα à faibles concentrations, LPS…). Lorsque des neutrophiles humains sanguins sont maintenus en survie par la présence combinée de cytokines, le pourcentage de neutrophiles en survie décroît progressivement ; mais des neutrophiles sont encore indemnes d’apoptose après trois jours (évaluant par cytofluorométrie l’expression d’annexine 5 et l’incorporation d’iodure de propidium comme marqueurs, ou par microscopie confocale avec la méthode TUNEL ; travaux personnels). Cela sous-entend qu’un certain nombre de neutrophiles présents dans la circulation sanguine sont à un stade de différenciation moindre que les autres et sont susceptibles de survivre de façon prolongée. Ces cellules sont fonctionnellement actives. Leur morphologie globale et leur phénotype membranaire varient en fonction des facteurs présents localement pour les maintenir en survie. Ainsi, certains de ces neutrophiles survivants, ne présentant aucun critère de mort cellulaire, peuvent présenter un, deux, voire trois noyaux indépendants rendant difficile, voire impossible de caractériser, par leur morphologie, ces cellules comme des neutrophiles conventionnels (voir
http://www.crri.ca/fr/poubelle.html#video). Cette survie accrue permet au neutrophile d’exercer ses fonctions à la fois physiologiques, mais aussi pathologiques en participant directement, par exemple, à l’incitation et à l’entretien d’une arthrite auto-immune murine semblable à l’arthrite rhumatoïde [
13]. Enfin, certaines propriétés originales et pré-existantes du neutrophile en font une cellule essentielle de la transition entre l’immunité innée et acquise. Par exemple, une sous-population d’environ 5 à 8 % des neutrophiles sanguins est porteuse d’immunorécepteurs de type TCR dont l’activation permet d’augmenter sa survie et de stimuler la production d’IL-8 [
14]. L’utilité de cette fonction du neutrophile vis-à-vis d’un antigène spécifique est sa rapidité de réponse, permettant d’attendre le relais par la réponse classique des lymphocytes T aux antigènes. Le neutrophile peut aussi, par l’intermédiaire de la production de chimiokines spécifiques telles que CCL3, CCL4, CCL5 (RANTES), CCL20 (MIP-3α) ou de facteurs tels que les défensines ou la chimérine, faciliter le recrutement local et l’activation de cellules dendritiques et de lymphocytes T permettant ainsi une réponse immunitaire complète et adaptée [
15–
17]. À côté de ces fonctions immédiates du neutrophile au cours du processus inflammatoire et anti-infectieux, fonctions donnant déjà au neutrophile un rôle prépondérant à la fois dans les défenses innées et la préparation aux défenses acquises, d’autres propriétés de cette cellule en font un acteur efficace et rapide des défenses immunitaires de seconde intention. |
Neutrophile et immunité acquise Lymphocytes T et B sont les acteurs essentiels des défenses immunitaires, mais ces cellules réclament une orchestration, rôle dévolu aux cellules dendritiques dont l’étude des propriétés s’avère difficile [
18]. Cependant, il est actuellement certain que ces cellules dendritiques, dont l’origine est myéloïde et principalement monocytaire, sont au carrefour de l’immunité innée et acquise. Elles sont pour la plupart tissulaires, passant progressivement du stade immature au stade mature en présence d’un agent pathogène reconnu par des TLR à leur surface membranaire. Elles vont alors exprimer des molécules de co-stimulation, vont dégrader et préparer l’antigène reconnu, vont accroître leur expression de molécules du CMH et vont migrer vers les ganglions lymphatiques afin de présenter le peptide antigénique aux lymphocytes T naïfs et permettre ainsi une réponse immunitaire acquise spécifique. Ces divers critères fonctionnels dendritiques sont caractéristiques et ne sont plus l’apanage unique des monocytes-macrophages, mais aussi celui des neutrophiles dont la capacité à se transformer, se transdifférencier et se reprogrammer est remarquable par sa souplesse d’adaptation et son efficacité. |
Dégradation et préparation de l’antigène par le neutrophile La phagocytose d’un micro-organisme par les neutrophiles active fortement le métabolisme cellulaire et va déclencher divers événements intracellulaires aboutissant à la digestion complète du micro-organisme grâce aux lysosomes. Ceci va aussi permettre de préparer un peptide antigénique spécifique grâce au système endosomal du neutrophile [
19]. Le neutrophile possède les diverses activités enzymatiques requises, telles que les cathepsines B et D et l’ATPase vacuolaire permettant l’acidification et l’activation d’enzymes hydrolytiques. Ainsi, le peptide progressivement apprêté va passer des endosomes précoces aux endosomes tardifs, être transporté jusqu’à la membrane cellulaire par divers organites intracellulaires telles que les vésicules de type II et pouvoir s’associer aux molécules du CMH II. Ces dernières peuvent être rapidement transloquées à la membrane du neutrophile en présence d’anticorps anti-CD11b activant le récepteur CD18/CD11b lié à la phagocytose [
20]. Cette augmentation de la capacité à présenter l’antigène par l’activation de la phagocytose était déjà connue pour les macrophages [
21]. Ces diverses étapes préparatoires font appel à des mécanismes pouvant dépendre ou non de la production d’oxygène radicalaire par la NADPH-oxydase du neutrophile. |
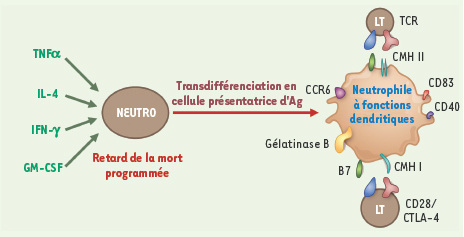
Présentation du peptide antigénique par le neutrophile Chimiokines et cytokines libérées par les cellules au site inflammatoire vont activer fortement le neutrophile, non seulement pour le conduire à détruire des micro-organismes, mais aussi pour le prédisposer à présenter un antigène comme le ferait une cellule dendritique. Le neutrophile au repos exprime uniquement les molécules du CMH de classe I. Le neutrophile activé en présence d’IFN-γ, GM-CSF, TNF-α, IL-4 va se modifier et exprimer à sa surface le CMH de classe II, CD83, CD40 et CCR6 mais, de plus, les molécules de co-stimulation CD80 (B7-1) et CD86 (B7-2), critères définissant une cellule dendritique [
22–
24]. Certains neutrophiles au repos possèdent déjà, dans leur cytoplasme, ces molécules pré-stockées ; ils en possèdent également d’autres comme CD20, 21, 22, marqueurs de lymphocytes B [
25]. La présentation antigénique par le neutrophile est efficace puisqu’il peut alors activer les lymphocytes T mis en présence du peptide antigénique par ce neutrophile, que ce soit un peptide conventionnel ou un superantigène [
26–
28]. Le neutrophile, devenu une cellule de type dendritique, semble être 10 000 fois plus efficace à présenter l’antigène qu’une cellule dendritique classique en provenance de monocytes [
23]. Le neutrophile peut aussi présenter un antigène peptidique en utilisant la voie du CMH de classe I [
29]. La Figure 1 résume ces fonctions.  | Figure 1.
Transdifférenciation du neutrophile en cellule présentatrice d’antigène. La stimulation du neutrophile par différentes cytokines, telles que GM-CSF (granulocyte/macrophage-colony stimulating factor), TNFα (tumor necrosis factor a), IL-4 (interleukine-4) et IFN-γ (interféron γ), va permettre, d’une part, le retard de la mort programmée du neutrophile et, d’autre part, la déviation du phénotype fonctionnel du neutrophile en celui d’une cellule présentatrice d’antigène (Ag). Ce changement de phénotype s’associe à l’expression, par les neutrophiles touchés, de marqueurs de type « dendritique » comme les molécules du CMH II (complexe majeur d’histocompatibilité de classe II) HLA-DR, CD40, CD83, CCR6 et les molécules de costimulation B7-1 et B7-2 (CD80 et CD86). Cette cellule « transdifférenciée » est alors capable d’activer directement les lymphocytes T via l’interaction du TCR (T-cell receptor) avec les CMH et les molécules de costimulation. De plus, elle peut exprimer et sécréter de la gélatinase B, dont l’intérêt est de dissoudre la matrice extracellulaire, facilitant ainsi la migration des autres cellules. |
Cette propriété de transdifférenciation du neutrophile en cellule de type dendritique in vitro, avec tous les critères phénotypiques et fonctionnels nécessaires, existe in vivo. Il en est ainsi des neutrophiles provenant de sites inflammatoires au cours de l’arthrite rhumatoïde ou de la maladie de Wegener [
30–
32]. De plus, des neutrophiles du liquide synovial rhumatoïde expriment la protéine RANK à la membrane, comme les cellules dendritiques dont l’apoptose est retardée par le ligand de RANK [
33,
34]. |
Les cellules de l’immunité acquise et le neutrophile Les nombreux facteurs locaux libérés lors de la réaction inflammatoire, outre leur action anti-apoptotique, stimulent l’activité de synthèse et de sécrétion par le neutrophile de multiples cytokines et chimiokines directement impliquées dans la différenciation et l’activation des cellules immunitaires [
35,
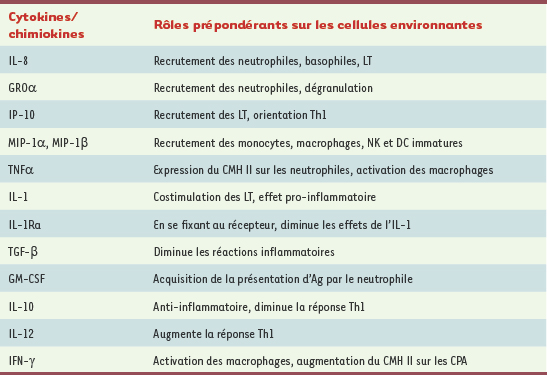
36]. Le Tableau I résume les divers produits ainsi formés. Il est également utile de rappeler que le neutrophile inflammatoire est aussi un pourvoyeur important de lipides bioactifs (exemple : LTB4, PAF) directement associés à la régulation des fonctions immunitaires.  | Tableau I.
Agents peptidiques sécrétés par le neutrophile et leurs effets. Résumé des différentes cytokines et chimiokines produites par le neutrophile lors d’une réponse inflammatoire et descriptions de leurs effets sur les cellules immunitaires. IL : interleukine ; IP-10 : IFN-g-inductible protein of 10 kDa ; MIP : macrophage-inflammatory protein ; NK : natural killer ; TNF : tumor necrosis factor ; IL-1Ra : IL-1 receptor antagonist ; TGF : transforming growth factor ; GM-CSF : granulocyte-macrophage-colony stimulating factor ; IFN : interféron. |
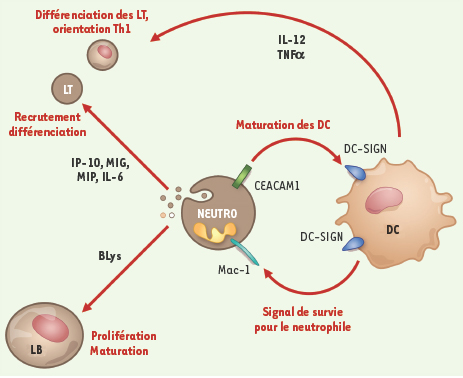
Enfin, les interactions directes entre neutrophiles et cellules de la réaction inflammatoire sont essentielles à la réponse immune acquise. Ainsi, l’interaction neutrophile-cellule dendritique active la maturation dendritique et la synthèse d’IL-12 et de TNF-α d’origine dendritique, augmentant ainsi l’efficacité des cellules dendritiques à activer les lymphocytes T [15,
37]. Cette interaction neutrophile-cellule dendritique s’effectue, respectivement, par l’intermédiaire des récepteurs CD18/CD11b et DC-SIGN de type lectine C. Elle est sélective et restreinte aux neutrophiles grâce à la spécificité des hydrates de carbone des structures Lewis X et Lewis Y présentes sur CD18/CD11b [37]. La maturation dendritique provoquée par le neutrophile oriente la prolifération des lymphocytes T vers des Th1. Cette déviation de la réponse T secondaire à l’action des neutrophiles est démontrée in situ à partir de tissus de la muqueuse intestinale de patients atteints de la maladie de Crohn [37]. Les divers effets de l’interaction neutrophile-cellule inflammatoire sont résumés dans la Figure 2. De plus, l’interaction neutrophile-cellule endothéliale permet de limiter l’adhésion des lymphocytes et leur rôle dans la réponse immune avancée, cet effet étant relié à l’inhibition par le neutrophile de l’expression de VCAM-1 par la cellule endothéliale [
38]. Enfin, le contact neutrophile-lymphocyte T au site inflammatoire stimule le neutrophile et pourrait participer à la régulation de la réaction locale [
39]. 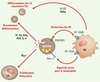 | Figure 2.
Interactions neutrophiles-cellules immunes. Les neutrophiles sont, à la fois, capables d’interagir directement avec les cellules dendritiques (DC) et d’influencer, à distance, les cellules du système immunitaire. Ainsi, au contact d’une DC immature le neutrophile, d’une part, reçoit un signal de survie par l’interaction des molécules de surface Mac-1/DC-SIGN et, d’autre part, stimule la maturation de la DC via l’interaction des molécules CEACAM-1 et DC-SIGN. La DC mature sécrète ensuite certaines cytokines, comme l’interleukine-12 (IL-12) et le TNFα dont l’action préférentielle sur la différenciation les lymphocytes T (LT) naïfs les oriente vers des LT de type Th1. Le neutrophile est également la source de nombreux facteurs peptidiques capables de recruter et de différencier d’autres cellules immunes. Par exemple, les chimiokines IP-10 ou MIP-1α/-1β vont recruter LT, macrophages et DC immatures au site de lésion et le BLys (TNF-related ligand B-lymphocyte stimulator) va participer à la prolifération et à la différenciation des lymphocytes B. |
|
Le neutrophile ne peut plus être considéré comme un simple phagocyte destructeur [
40]. De nombreuses preuves expérimentales et cliniques viennent appuyer le fait qu’il exerce un rôle dans les défenses innées et acquises, que ce soit en tant que neutrophile au repos ou surtout en tant que neutrophile directement engagé dans le processus infectieux et inflammatoire. Son action yin-yang en fait une cellule indispensable de l’homéostasie et le place dans une position vitale pour assurer le maintien de l’équilibre immunitaire que lui confère sa rapidité de déplacement, d’action et de lien avec les autres cellules de l’immunité. Le neutrophile est une cellule immunitaire à part entière.

|
Footnotes |
1. Beutler B. Inferences, questions and possibilities in Toll-like receptor signalling. Nature 2004; 430 : 257–63. 2. Chertov O, Yang D, Howard OM, Oppenheim JJ. Leukocyte granule proteins mobilize innate host defenses and adaptive immune responses. Immunol Rev 2000; 177 : 68–78. 3. Wagner C, Iking-Konert C, Denefleh B, et al. Granzyme B and perforin: constitutive expression in human polymorphonuclear neutrophils. Blood 2004; 103 : 1099–104. 4. Brinkmann V, Reichard U, Goosmann C, et al. Neutrophil extracellular traps kill bacteria. Science 2004; 303 : 1532–5. 5. Tsuda Y, Takahashi H, Kobayashi M, et al. Three different neutrophil subsets exhibited in mice with different susceptibilities to infection by methicillin-resistant Staphylococcus aureus. Immunity 2004; 21 : 215–26. 6. Frasch SC, Nick JA, Fadok VA, et al. p38 mitogen-activated protein kinase-dependent and -independent intracellular signal transduction pathways leading to apoptosis in human neutrophils. J Biol Chem 1998; 273 : 8389–97. 7. Goepel F, Weinmann P, Schymeinsky J, Walzog B. Identification of caspase-10 in human neutrophils and its role in spontaneous apoptosis. J Leukoc Biol 2004; 75 : 836–43. 8. Knepper-Nicolai B, Savill J, Brown SB. Constitutive apoptosis in human neutrophils requires synergy between calpains and the proteasome downstream of caspases. J Biol Chem 1998; 273 : 30530–6. 9. Fossati G, Moulding DA, Spiller DG, et al. The mitochondrial network of human neutrophils: role in chemotaxis, phagocytosis, respiratory burst activation, and commitment to apoptosis. J Immunol 2003; 170 : 1964–72. 10. Maianski NA, Maianski AN, Kuijpers TW, Roos D. Apoptosis of neutrophils. Acta Haematol 2004; 111 : 56–66. 11. Von Gunten S, Yousefi S, Seitz M, et al. Siglec-9 transduces apoptotic and nonapoptotic death signals into neutrophils depending on the proinflammatory cytokine environment. Blood 2005; 106 : 1423–31. 12. Cross A, Barnes T, Bucknall RC, et al. Neutrophil apoptosis in rheumatoid arthritis is regulated by local oxygen tensions within joints. J Leukoc Biol 2006; 80 : 521–8. 13. Wipke BT, Allen PM. Essential role of neutrophils in the initiation and progression of a murine model of rheumatoid arthritis. J Immunol 2001; 167 : 1601–8. 14. Puellmann K, Kaminski WE, Vogel M, et al. From the cover: a variable immunoreceptor in a subpopulation of human neutrophils. Proc Natl Acad Sci USA 2006; 103 : 14441–6. 15. Bennouna S, Denkers EY. Microbial antigen triggers rapid mobilization of TNF-alpha to the surface of mouse neutrophils transforming them into inducers of high-level dendritic cell TNF-alpha production. J Immunol 2005; 174 : 4845–51. 16. Wittamer V, Bondue B, Guillabert A, et al. Neutrophil-mediated maturation of chemerin: a link between innate and adaptive immunity. J Immunol 2005; 175 : 487–93. 17. Yang D, Chen Q, Chertov O, Oppenheim JJ. Human neutrophil defensins selectively chemoattract naive T and immature dendritic cells. J Leukoc Biol 2000; 68 : 9–14. 18. Banchereau J, Steinman RM. Dendritic cells and the control of immunity. Nature 1998; 392 : 245–52. 19. Ishikawa F, Miyazaki S. New biodefense strategies by neutrophils. Arch Immunol Ther Exp (Warsz) 2005; 53 : 226–33. 20. Sandilands GP, Ahmed Z, Perry N, et al. Cross-linking of neutrophil CD11b results in rapid cell surface expression of molecules required for antigen presentation and T-cell activation. Immunology 2005; 114 : 354–68. 21. Reis e Sousa C, Germain RN. Major histocompatibility complex class I presentation of peptides derived from soluble exogenous antigen by a subset of cells engaged in phagocytosis. J Exp Med 1995; 182 : 841–51. 22. Ellis TN, Beaman BL. Interferon-gamma activation of polymorphonuclear neutrophil function. Immunology 2004; 112 : 2–12. 23. Oehler L, Majdic O, Pickl WF, et al. Neutrophil granulocyte-committed cells can be driven to acquire dendritic cell characteristics. J Exp Med 1998; 187 : 1019–28. 24. Yamashiro S, Wang JM, Yang D, et al. Expression of CCR6 and CD83 by cytokine-activated human neutrophils. Blood 2000; 96 : 3958–63. 25. Sandilands GP, Hauffe B, Loudon E, et al. Detection of cytoplasmic CD antigens within normal human peripheral blood leucocytes. Immunology 2003; 108 : 329–37. 26. Fanger NA, Liu C, Guyre PM, et al. Activation of human T cells by major histocompatability complex class II expressing neutrophils: proliferation in the presence of superantigen, but not tetanus toxoid. Blood 1997; 89 : 4128–35. 27. Radsak M, Iking-Konert C, Stegmaier S, et al. Polymorphonuclear neutrophils as accessory cells for T-cell activation: major histocompatibility complex class II restricted antigen-dependent induction of T-cell proliferation. Immunology 2000; 101 : 521–30. 28. Reali E, Guerrini R, Moretti S, et al. Polymorphonuclear neutrophils pulsed with synthetic peptides efficiently activate memory cytotoxic T lymphocytes. J Leukoc Biol 1996; 60 : 207–13. 29. Potter NS, Harding CV. Neutrophils process exogenous bacteria via an alternate class I MHC processing pathway for presentation of peptides to T lymphocytes. J Immunol 2001; 167 : 2538–46. 30. Cross A, Bucknall RC, Cassatella MA, et al. Synovial fluid neutrophils transcribe and express class II major histocompatibility complex molecules in rheumatoid arthritis. Arthritis Rheum 2003; 48 : 2796–806. 31. Iking-Konert C, Vogt S, Radsak M, et al. Polymorphonuclear neutrophils in Wegener’s granulomatosis acquire characteristics of antigen presenting cells. Kidney Int 2001; 60 : 2247–62. 32. Sandilands GP, McCrae J, Hill K, et al. Major histocompatibility complex class II (DR) antigen and costimulatory molecules on in vitro and in vivo activated human polymorphonuclear neutrophils. Immunology 2006. 33. Poubelle PE, Chakravarti A, Fernandes MJ, et al. Differential expression of RANK/RANK-L and osteoprotegerin by synovial fluid neutrophils from patients with rheumatoid arthritis and by healthy human blood neutrophils. Arthritis Res Ther 2007; 9 : R25. 34. Wong BR, Josien R, Lee SY, et al. TRANCE (tumor necrosis factor [TNF]-related activation-induced cytokine), a new TNF family member predominantly expressed in T cells, is a dendritic cell-specific survival factor. J Exp Med 1997; 186 : 2075–80. 35. Cassatella MA. Neutrophil-derived proteins: selling cytokines by the pound. Adv Immunol 1999; 73 : 369–509. 36. Scapini P, Lapinet-Vera JA, Gasperini S, et al. The neutrophil as a cellular source of chemokines. Immunol Rev 2000; 177 : 195–203. 37. Van Gisbergen KP, Sanchez-Hernandez M, Geijtenbeek TB, Van Kooyk Y. Neutrophils mediate immune modulation of dendritic cells through glycosylation-dependent interactions between Mac-1 and DC-SIGN. J Exp Med 2005; 201 : 1281–92. 38. Stone PC, Lally F, Rahman M, et al. Transmigrated neutrophils down-regulate the expression of VCAM-1 on endothelial cells and inhibit the adhesion of flowing lymphocytes. J Leukoc Biol 2005; 77 : 44–51. 39. Zhang JH, Ferrante A, Arrigo AP, Dayer JM. Neutrophil stimulation and priming by direct contact with activated human T lymphocytes. J Immunol 1992; 148 : 177–81. 40. Nathan C. Neutrophils and immunity: challenges and opportunities. Nat Rev Immunol 2006; 6 : 173–82. |