| |
| Med Sci (Paris). 2007 October; 23(10): 805–807. Published online 2007 October 15. doi: 10.1051/medsci/20072310805.Traitement pharmacologique dans le syndrome de Rett Des résultats prometteurs chez la souris Jean-Christophe Roux* and Laurent Villard* Inserm U.491, Faculté de Médecine La Timone, 27, boulevard Jean Moulin, 13385 Marseille Cedex 5, France MeSH keywords: Inhibiteurs de la capture adrénergique, Animaux, Tronc cérébral, Cellules cultivées, Désipramine, Évaluation préclinique de médicament, Femelle, Humains, Protéine-2 de liaison au CpG méthylé, Souris, Souris knockout, Protéines tissu nerveux, Neurones, Norépinéphrine, Troubles respiratoires, Syndrome de Rett, Vésicules synaptiques, Tyrosine 3-monooxygenase |
Le syndrome de Rett est un grave désordre neurologique qui affecte le fonctionnement du système nerveux central [
1]. Cette neuropathie a une prévalence d’environ 1/10 000 naissances de filles et elle représente environ 10 % des retards mentaux profonds d’origine génétique chez la femme [
2]. Les manifestations cliniques sont caractérisées par un développement normal durant la période néonatale jusqu’à 6 à 18 mois, puis par un ralentissement du développement et une régression rapide des capacités intellectuelles et de communication associée à une microcéphalie, des stéréotypies manuelles et des troubles de motricité (ataxie/apraxie) [1]. Dès son individualisation, il a été remarqué que le syndrome de Rett ne frappait que les filles et que le caractère et l’homogénéité des signes cliniques de la maladie étaient compatibles avec une origine génétique. L’identification du gène responsable, en 1999, a confirmé qu’il s’agissait bien d’une maladie génétique et a permis d’entrevoir son mécanisme pathogénique. Il s’agit du gène Mecp2 localisé sur le chromosome X et codant pour une protéine régulatrice de la transcription [2,
3]. |
Déficits noradrénergiques à l’origine des troubles respiratoires dans le modèle murin Les filles atteintes du syndrome de Rett présentent, en plus de troubles cognitifs et moteurs, des déficits du système nerveux autonome. Plus particulièrement, les systèmes cardiorespiratoires présentent de sévères arythmies qui pourraient être responsables chez les filles Rett d’un quart des décès [
4]. Nous avons donc décidé d’aborder l’origine des troubles respiratoires en utilisant un modèle de souris déficientes pour la protéine Mecp2 (Mecp2−/y
) [
5]. Nos résultats ont apporté de nouveaux éléments physiopathologiques et ont permis en premier lieu de montrer que le modèle murin présentait, comme les patientes, des troubles respiratoires importants. Ceux-ci apparaissent chez les souris Mecp2−/y
vers l’âge d’un mois et s’aggravent jusqu’à l’arrêt respiratoire survenant vers l’âge de deux mois [
6]. Durant leur dernière semaine de vie, les souris mutantes présentent une respiration irrégulière marquée par de grandes périodes d’apnées. Quelle est l’origine de ces troubles respiratoires ? Bien que cette fonction soit contrôlée finement par une multitude de structures nerveuses périphériques et centrales, le tronc cérébral est connu comme la structure principale responsable de sa genèse et de sa régulation [
7]. Or, l’étude de cette structure chez les souris Mecp2−/y
a permis de montrer que les contenus en noradrénaline, neurotransmetteur essentiel à la commande respiratoire, sont fortement réduits à partir de l’âge d’un mois, ce qui coïncide avec l’apparition des troubles respiratoires chez ces mêmes animaux [7]. Par ailleurs, l’analyse de coupes histologiques révèle que le nombre de neurones exprimant l’enzyme limitante de la synthèse de la noradrénaline, la tyrosine hydroxylase (TH), est fortement réduit dans le tronc cérébral. Ce dernier résultat permet, en partie, d’expliquer les diminutions en noradrénaline par une réduction du nombre de neurones exprimant l’enzyme clé de sa synthèse. |
Traitement pharmacologique des souris modèles L’identification de déficits neurochimiques et cellulaires, pouvant expliquer l’origine des troubles respiratoires, laissait entrevoir la possibilité d’une intervention pharmacologique. D’autant plus que nous avions montré précédemment que l’ajout de noradrénaline exogène stabilise in vitro l’activité rythmique des neurones respiratoires situés dans le tronc cérébral de nos souris Mecp2−/y
, qui présentaient au préalable une activité erratique [6]. Quelle molécule utiliser ? Il existe un grand nombre d’agents pharmacologiques capables d’agir sur le métabolisme et l’activité des neurones noradrénergiques. La plupart de ces agents sont des antidépresseurs et notre choix s’est porté sur la désipramine car cette molécule est l’inhibiteur de recapture de la noradrénaline le plus spécifique et qu’elle possède déjà une autorisation de mise sur le marché, facilitant de fait tout transfert vers la clinique. Les souris Mecp2−/y
ont été traitées tous les jours par injection intrapéritonéale à partir de la période où apparaissaient des troubles respiratoires marqués (Figure 1). Les souris déficientes traitées par la désipramine présentent une amélioration notable du rythme respiratoire durant plusieurs semaines, maintenant le niveau d’apnée à un seuil très bas [
8]. De manière encore plus intéressante, le traitement prolonge la durée de vie des souris déficientes d’environ 50 % par rapport aux souris non traitées, ou traitées par un placebo. Deux questions particulièrement importantes restaient sans réponse. (1) Les neurones exprimant la TH dans le tronc cérébral sont-ils éliminés au cours du développement chez les souris Mecp2−/y
? (2) Quel est l’effet du traitement par la désipramine sur la disparition de ces neurones ? En premier lieu, nous avons pu montrer que la réduction du nombre de neurones exprimant la TH chez des souris non traitées n’est pas due à une mort cellulaire par apoptose. Cette observation est importante dans une perspective thérapeutique. En effet, il est plus facile de « réactiver » des neurones que d’obtenir une neurogenèse. Afin de répondre à la deuxième question, nous avons analysé histologiquement le tronc cérébral des souris Mecp2−/y
traitées par la désipramine durant 15 jours. Les résultats sont spectaculaires et montrent que, chez les souris mutantes traitées, le nombre de neurones exprimant la TH est similaire à celui des souris sauvages. L’absence de cellules exprimant des marqueurs de prolifération cellulaire a permis par ailleurs d’exclure l’hypothèse d’un recrutement de cellules souches au niveau du tronc cérébral, qui se différencieraient en neurones TH lors du traitement par la désipramine. L’ensemble des résultats sur le modèle murin du syndrome de Rett permet maintenant d’émettre l’hypothèse suivante : à un stade du développement, les neurones noradrénergiques des souris mutantes perdraient leur capacité à synthétiser correctement la noradrénaline et ce déficit serait la conséquence d’une atteinte de la TH, enzyme clé de la synthèse. Il apparaît donc à présent que la stimulation pharmacologique du métabolisme noradrénergique est une approche prometteuse dans le traitement des dysfonctions respiratoires qui causent une proportion importante de mort chez les filles Rett.  | Figure 1.
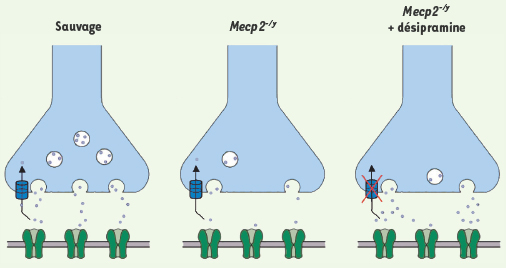
Synapse noradrénergique chez la souris sauvage, Mecp2−/yet Mecp2−/ytraitée par la désipramine. Chez la souris sauvage, la noradrénaline contenue dans des vésicules est libérée dans la fente synaptique et va pouvoir agir sur des récepteurs postsynaptiques (en vert). Il existe un mécanisme actif de recapture de la noradrénaline qui permet de recycler une quantité importante de noradrénaline libérée. Chez les souris Mecp2−/y
, les contenus en noradrénaline sont fortements réduits. Le traitement par la désipramine des souris Mecp2−/y
permet d’inhiber la recapture de la noradrénaline augmentant sa durée d’action et ainsi son efficacité. |
|
Implications thérapeutiques Le passage d’essais pharmacologiques sur l’animal à des essais cliniques chez l’homme représente toujours une étape complexe et incertaine. Dans ce cas précis, nous possédons des arguments scientifiques laissant espérer d’éventuels résultats. En premier, il existe un certain nombre de publications indiquant la présence de déficits catécholaminergiques chez les filles Rett [
9,
10]. Par ailleurs, le tronc cérébral, qui contrôle fortement la fonction respiratoire et qui contient tous les neurones noradrénergiques centraux, est une des structures nerveuses les mieux conservée au cours de l’évolution. Enfin, la désipramine est une molécule connue et utilisée chez l’homme depuis de nombreuses années dans le traitement de la dépression. La bonne connaissance de cette molécule, sa faible toxicité et le fait qu’elle ait déjà été utilisée chez l’enfant ouvrait donc la voie à des essais cliniques chez la fille Rett. Aussi, un essai clinique de phase II chez 36 filles Rett vient d’être lancé à Marseille, financé par le ministère de la santé sous forme d’un PHRC (programme hospitalier de recherche clinique) national et sous la responsabilité du Professeur Mancini, neuropédiatre à l’hôpital de la Timone. Le but de ce travail est de tester l’efficacité de la désipramine sur le fonctionnement du système nerveux autonome des filles Rett. Deux groupes de fillettes, dont l’âge est compris entre 7 et 18 ans, vont être traités par deux doses différentes de désipramine alors qu’un troisième groupe recevra un placebo. Cette étude sera réalisée en double aveugle dans six centres hospitaliers répartis sur tout le territoire. Les résultats seront rassemblés au centre de pharmacologie clinique et d’essais thérapeutique de Marseille (responsable : Pr Olivier Blin) et les conclusions de ce travail devraient êtres connus au cours de l’année 2008. |
Nos résultats suggèrent que la stimulation du système noradrénergique pourrait avoir des effets bénéfiques pour les patientes Rett. Les résultats de l’essai clinique seront particulièrement attendus car ils représentent le premier cas de transfert de résultat de la recherche fondamentale chez une souris modèle vers un essai thérapeutique dans le syndrome de Rett. De plus, la possibilité d’améliorer la fonction respiratoire, qui cause une proportion importante de décès chez les filles Rett, pourrait avoir également une incidence positive sur l’activité générale des neurones et par conséquent sur les différentes fonctions, cognitives, motrices et autonomes, qu’ils contrôlent. |
1. Hagberg B. Rett syndrome: clinical peculiarities and biological mysteries. Acta Paediatr 1995; 84 : 971–6. 2. Moretti P, Zoghbi HY. MeCP2 dysfunction in Rett syndrome and related disorders. Curr Opin Genet Dev 2006; 16 : 276–81. 3. Amir RE, Van den Veyver IB, Wan M, et al. Rett syndrome is caused by mutations in X-linked MECP2, encoding methyl-CpG-binding protein2. Nat Genet 1999; 23 : 185–8. 4. Kerr AM, Armstrong DD, Prescott RJ, et al. Rett syndrome: analysis of deaths in the British survey. Eur Child Adolesc Psychiatry 1997; 6 (suppl 1) : 71–4. 5. Guy J, Hendrich B, Holmes M, et al. A mouse Mecp2-null mutation causes neurological symptoms that mimic Rett syndrome. Nat Genet 2001; 27 : 322–6. 6. Viemari JC, Roux JC, Tryba AK, et al. Mecp2 deficiency disrupts norepinephrine and respiratory systems in mice. J Neurosci 2005; 25 : 11521–30. 7. Feldman JL, Mitchell GS, Nattie EE. Breathing: rhythmicity, plasticity, chemosensitivity. Annu Rev Neurosci 2003; 26 : 239–66. 8. Roux JC, Dura E, Moncla A, et al. Treatment with desipramine improves breathing and survival in a mouse model for Rett syndrome. Eur J Neurosci 2007; 25 : 1915–22. 9. Nomura Y. Neurophysiology of Rett syndrome. Brain Dev 2001; 23 : S50–7. 10. Saito Y, Ito M, Ozawa Y, et al. Reduced expression of neuropeptides can be related to respiratory disturbances in Rett syndrome. Brain Dev 2001; 23 : S122–6. |