Les traumatismes et les maladies peuvent endommager les tissus et parfois entraîner une perte cellulaire conséquente. Un axe de recherche qui a pour but de maintenir, réparer ou reconstruire les organes et tissus endommagés et qui progresse très rapidement, est celui de la médecine régénératrice, une discipline multidisciplinaire qui associe thérapie cellulaire, utilisation de facteurs de croissance, génie génétique, et science des biomatériaux.
La thérapie cellulaire utilise des cellules progénitrices ou des cellules souches, stratégie fort prometteuse car, ces cellules ayant la capacité de se différencier vers différentes lignées tissulaires, elle offre ainsi la possibilité de régénérer certains tissus. Un effort considérable a été entrepris pour identifier et isoler les cellules souches des différents tissus ou organes, et étudier leur potentiel de différenciation. Mais curieusement, il est rare que, dans ces études de différenciation, il soit fait référence au sexe des cellules souches utilisées, ou que soit comparé le potentiel de cellules souches provenant de mâles ou de femelles. Pour des raisons techniques, les cellules mâles sont plus souvent utilisées car elles sont plus faciles à détecter après transplantation chez un hôte femelle (hybridation fluorescente pour le chromosome Y), que ne le seraient les cellules femelles dans un hôte mâle. Or, les hommes et les femmes ne sont pas égaux quant au vieillissement, au développement - ou à la guérison - de maladies, et il semble important d’étudier si le sexe des cellules souches et des progéniteurs qui participent à la pérennité du fonctionnement de nos tissus, affecte leur potentiel de différenciation. Si une différence était révélée, ce paramètre pourrait influencer certains protocoles de thérapie cellulaire pour la médecine régénératrice.
Notre groupe, dirigé par le Dr J. Huard de l’université de Pittsburgh, concentre ses études sur les cellules souches isolées du muscle squelettique. Grâce à leur potentiel très large, pluripotent, ces cellules, isolées chez la souris et identifiées sous le nom de muscle-derived stem cells (MDSC), peuvent se différencier en cellules du muscle squelettique, cellules osseuses et chondrocytaires, mais aussi en cellules neuronales, endothéliales, et hématopoïétiques [ 1– 4]. Nous avons démontré que les MDSC isolées de souris normales et injectées dans le muscle squelettique dystrophique de la souris mdx, un modèle animal de la dystrophie musculaire de Duchenne, peuvent se différencier et régénérer des fibres musculaires exprimant la dystrophine [1, 5]. Mais l’indice de régénération (IR), calculé sur la base du nombre de fibres musculaires exprimant la dystrophine, était très variable en fonction des différentes populations testées. Une telle hétérogénéité dans les populations de cellules souches isolées du muscle squelettique a déjà été soulignée dans d’autres études [ 6– 8]. Or, nous avons découvert, au cours de notre évaluation de ces différentes populations de MDSC, que le caractère mâle ou femelle des cellules, rarement pris en compte dans nos études, était un paramètre susceptible d’interférer avec les résultats obtenus in vivo.
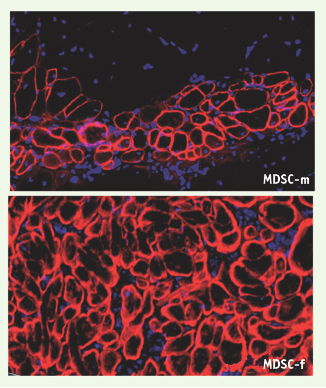
Ainsi, la transplantation de MDSC issues de souris femelles aboutit à la régénération du muscle squelettique dystrophique des souris mdx plus efficacement que ne le fait la transplantation de cellules similaires isolées chez les souris mâles (Figure 1) [ 9]. Cette différence était très significative : en effet, l’IR était deux fois plus élevé avec les MDSC femelles qu’avec les MDSC mâles (n= 15, IR = 230 ± 52 pour les premières, versus n=10, IR = 95 ± 20 pour les secondes, p = 0,035). Deux seulement des populations de MDSC mâles transplantées démontraient un IR s’approchant de 200. En comparaison, 60% des populations de MDSC femelles permettaient d’obtenir un IR supérieur à l’IR moyen obtenu chez les mâles, et 40% un IR supérieur à l’IR maximal observé lorsque les populations de MDSC mâles étaient greffées [9]. Encore plus intéressant, cette supériorité de régénération par des cellules femelles était indépendante du sexe du receveur. Toutes les stratégies que nous avons testées pour tenter de corriger le déficit de régénération des MDSC mâles (différentes techniques d’isolement, prétraitement des cellules avec des hormones) ont échoué.
| Figure 1.
Régénération de tissus musculaires après transplantation de MDSC dans les souris mdx. Une meilleure régénération musculaire a été observée après greffe de MDSC femelles par rapport aux MDSC mâles. Images représentatives de muscles squelettiques dystrophiques de souris mdx ayant reçu des MDSC mâles (MDSC-m, image du haut) et des MDSC femelles (MDSC-f, image du bas). Le niveau de régénération est déterminé par la positivité des fibres musculaires pour la dystrophine (rouge). Le noyau cellulaire est visualisé après marquage par le Hoechst. |
L’analyse par microarrays des MDSC femelles et mâles a révélé des variations dans l’expression d’un certain nombre de gènes impliqués dans l’apoptose, l’hypoxie et le stress oxydatif [9]. En particulier, l’expression du gène anti-apoptotique bcl2 était plus élevée dans les MDSC femelles que mâles. Mais la surexpression de bcl2 dans les MDSC mâles n’a pas corrigé leur déficit de régénération après transplantation dans le muscle dystrophique. Une seconde possibilité était que la réponse des MDSC mâles au stress oxydatif et à des conditions d’anoxie telles qu’elles peuvent en rencontrer après leur injection dans le muscle squelettique, soit moins efficace que celle des MDSC femelles. Nous avons testé cette hypothèse in vitro en soumettant les MDSC mâles et femelles à des conditions d’hypoxie et de stress oxydatif et en analysant leur capacité à s’engager dans la lignée de différenciation myogénique dans ces conditions [9]. Aucune différence de viabilité cellulaire n’a été détectée en hypoxie, mais l’hypoxie a augmenté le pourcentage de MDSC mâles exprimant la desmine, un marqueur myogénique. De même, après un stress oxydatif, un plus grand pourcentage de MDSC mâles exprimait la chaîne lourde de la myosine par rapport aux MDSC femelles. Au vu de ces résultats, nous pensons que ces différences identifiées in vitro peuvent expliquer le comportement cellulaire in vivo. Nous suggérons l’hypothèse suivante (Figure 2) : en réponse au stress oxydatif et à l’hypoxie auxquelles sont confrontées les MDSC après leur transplantation in vivo, les MDSC mâles s’engagent immédiatement dans un processus de différenciation myogénique en fusionnant pour former des fibres musculaires. En revanche, placées dans les mêmes conditions, les MDSC femelles ne se différencient pas tout de suite et maintiennent leur statut immature en s’autorenouvelant, ou en se maintenant dans un état quiescent. Il en résulte une amplification de la population de MDSC femelles disponibles pour fusionner une fois dissipés les stress cellulaires, expliquant l’IR plus élevé lorsque l’on greffe des MDSC femelles. Des études in vivo plus approfondies sont nécessaires pour confirmer l’état de prolifération et de différenciation des MDSC mâles et femelles, ainsi que le taux d’oxygène et d’agents oxydatifs dans le muscle squelettique lors de la transplantation des cellules. Néanmoins, ce travail démontre qu’il existe des différences entre les MDSC femelles et mâles quant à leur capacité à régénérer le muscle squelettique.
| Figure 2.
Mécanisme proposé pour expliquer les différences liées au sexe des MDSC lors de la régénération du muscle squelettique. Suite à un stress oxydatif et⁄ou une hypoxie in vivo, les MDSC femelles se maintiennent dans un stade de renouvellement ou un état quiescent, tandis que les MDSC mâles s’engagent dans la lignée de différenciation myogénique. Ces différences entraînent une augmentation du nombre de MDSC femelles, ce qui explique une régénération plus élevée avec les MDSC femelles qu’avec les MDSC mâles. |
Une question que notre groupe aborde également est celle des différences liées au sexe dans la différenciation des MDSC vers les autres lignées tissulaires. Nos résultats démontrent que les MDSC mâles se différencient plus rapidement en cellules osseuses que les MDSC femelles [ 10]. Cela est à rapprocher de l’observation récente faite in vitro d’une meilleure différenciation vers la lignée osseuse de cellules souches du tissu adipeux provenant de patients mâles comparée à celle des cellules femelles [ 11].
Les conséquences exactes que pourraient avoir ces observations dans la conduite d’essais de thérapie cellulaire ne sont pas encore très claires. Nous pensons qu’il est important d’identifier ces différences dans les populations de cellules souches obtenues à partir du muscle squelettique humain, et d’autres tissus, car on ne peut exclure qu’une meilleure compréhension du mécanisme à l’origine de ces différences facilite le développement de stratégies plus efficaces de thérapie cellulaire. Nous espérons que nos études sur l’influence du sexe cellulaire sur la différenciation de cellules souches, comme les MDSC, encourageront d’autres chercheurs à étudier l’effet du sexe des cellules souches utilisées dans leurs études.