Le muscle strié squelettique adulte est capable de régénérer après une lésion grâce aux cellules satellites, qui sont les principales cellules souches myogéniques adultes, capables à la fois de s’autorenouveler et de participer à la reconstitution des fibres musculaires [ 1]. Lors d’une lésion, les cellules satellites s’activent - elles deviennent alors des cellules précurseurs myogéniques - prolifèrent, migrent et fusionnent entre elles ou avec les fibres musculaires existantes afin de restituer l’intégrité du tissu.
La présence massive de macrophages est observée tout au long du processus de régénération, suggérant un rôle plus large que la simple phagocytose des débris tissulaires provoqués par la lésion. Nous avons montré par des études in vitro que les interactions entre cellules myogéniques et macrophages humains induisent des effets biologiques variés [ 2, 3] : (1) les cellules myogéniques attirent spécifiquement les monocytes circulants via cinq systèmes chimiotactiques : CCL2, CCL22, CX3CL1 (ou fractalkine), VEGF (vascular endothelial growth factor), système de l’urokinase ; (2) la stimulation mutuelle augmente l’activité chimiotactique des deux types cellulaires ; (3) les macrophages stimulent la croissance des cellules myogéniques de façon dose-dépendante, et ce, d’une part, en sécrétant des facteurs solubles mitogènes, et d’autre part, en établissant des contacts directs cellule-cellule qui protègent les cellules myogéniques de l’apoptose, et dans lesquels sont impliqués les couples VCAM-1/VLA-4 (vascular cell adhesion molecule-1/ very late antigen-4), ICAM-1/LFA-1 (intercellular cell adhesion molecule/lymphocyte function-associated antigen-1), PECAM-1/PECAM-1(platelet endothelial cell adhesion molecule) et CX3CL1/CX3CR1.
Dans nos derniers travaux [ 4], nous avons examiné quel type de macrophage était impliqué dans la régénération musculaire. En effet, les macrophages sont très versatiles. Plusieurs états d’activation ont été décrits, mais l’on ne sait pas si le statut des macrophages reste continuellement modulable ou non [ 5, 6]. L’existence de sous-populations de monocytes circulants augmente la complexité du système. Les monocytes Gr-1[Ly6-C]+CX3CR1lo CCR2+ (CD14 +CD16− chez l’homme) sont recrutés dans les tissus lors de l’inflammation, alors que la sous-population Gr-1−CX3CR1hiCCR2− (CD14loCD16+ chez l’homme), augmentée dans certaines pathologies chroniques, patrouillerait dans les tissus [5, 7, 8].
Après une lésion (provoquée par l’injection de notexine dans le tibialis anterior de souris CX3CR1+/GFP), les monocytes/macrophages présents dans le muscle les 2 premiers jours sont Gr-1+CX3CR1lo. Ensuite, ils diminuent au profit d’une population de phénotype Gr-1− CX3CR1hi qui devient majoritaire dès le jour 3. À l’aide de marquages qui permettent de suivre les sous-populations monocytaires circulantes [8], nous avons montré que le muscle lésé recrute uniquement les monocytes Gr-1+ CX3CR1lo, qui changent ensuite de phénotype au sein du muscle pour devenir Gr-1−CX3CR1hi. Les cellules recrutées Gr-1+CX3CR1lo présentent un profil non proliférant et pro-inflammatoire (expression accrue de TNFα et IL-1β) alors que les monocytes/macrophages Gr-1−CX3CR1hi ont un profil anti-inflammatoire (expression accrue de TGFβ, IL-10, PPARγ, peroxisome proliferator activated receptor gamma) et prolifèrent, expliquant la quantité massive de macrophages présents dans le muscle lors de la phase régénérative. Ces résultats montrent que les monocytes inflammatoires recrutés par le muscle deviennent des monocytes/macrophages anti-inflammatoires au cours de la régénération. Un tel changement de phénotype a pu être réalisé in vitro par la phagocytose de cellules myogéniques nécrotiques, qui induit une inversion de la sécrétion cytokinique par les macrophages. Cela suggère un rôle important de la phagocytose des débris musculaires dans le changement de phénotype des macrophages.
Toujours in vitro, nous avons montré que les macrophages pro-inflammatoires (mimant les monocytes/macrophages Gr-1+CX3CR1lo recrutés) stimulent fortement la prolifération des cellules myogéniques et répriment leur différenciation. À l’inverse, les macrophages anti-inflammatoires (mimant les macrophages Gr-1− CX3CR1hi présents après le changement de phénotype) sont de puissants inducteurs de la myogenèse et de la fusion des cellules myogéniques. In vivo, l’inhibition du recrutement des monocytes dans le muscle par déplétion des monocytes circulants (injection de toxine diphtérique dans la souris transgénique CD11b-DTR, diphteria toxin receptor) empêche totalement la régénération musculaire de s’opérer, indiquant le rôle crucial de ces cellules dans la réparation du tissu. La déplétion des macrophages intramusculaires lors de la phase régénérative réduit le diamètre des nouvelles myofibres, confirmant l’effet des macrophages anti-inflammatoires sur la différenciation et la fusion myogéniques.
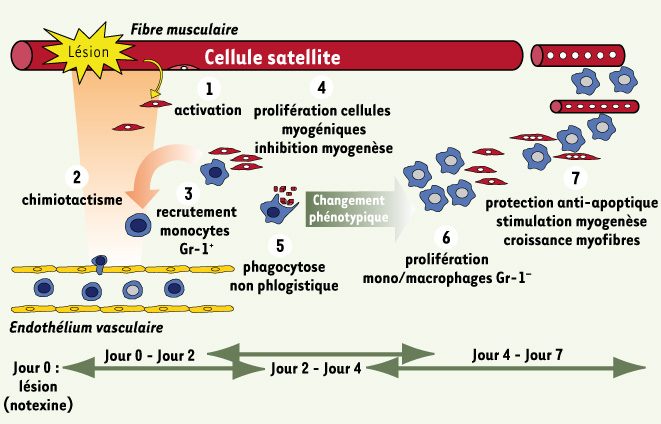
L’ensemble de ces travaux permet de proposer un modèle de l’action des macrophages au cours de la régénération musculaire (Figure 1) qui présente la diversité des interactions entre macrophages recrutés et cellules myogéniques. N’y figure pas le compartiment des macrophages résidants du muscle, situés dans l’épimysium (tissu conjonctif entourant le muscle), qui joue un rôle de régulateur des flux macrophagiques dans le muscle, aussi bien lors de leur recrutement après la lésion que lors de leur clairance une fois la régénération achevée (F. Chrétien, travaux non publiés).
| Figure 1.
Modèle du rôle des macrophages au cours de la régénération musculaire après une lésion toxique. La lésion induit l’activation des cellules satellites (1), qui sécrètent des facteurs chimiotactiques pour les monocytes circulants (2). Les monocytes recrutés (3) présentent un profil Gr-1+ CX3CR1lo inflammatoire. Ils stimulent la prolifération des cellules myogéniques et empêchent leur différenciation (4). Ils s’interstimulent avec les cellules myogéniques pour amplifier le recrutement des monocytes (2). Dans le même temps, les monocytes/macrophages Gr-1+ phagocytent les débris nécrotiques provoqués par la lésion (5). Cette phagocytose non phlogistique (du grec phlogiston : « la terre inflammable ») participe au changement phénotypique des monocytes/macrophages observé dans le muscle. À partir de ce moment, ils présentent majoritairement un profil Gr-1− CX3CR1hi anti-inflammatoire. Ils prolifèrent (6), puis soutiennent la myogenèse (7) en protégeant les cellules myogéniques de l’apoptose, en stimulant la différenciation myogénique et la croissance des fibres en régénération. |
Au-delà du tissu musculaire, ces résultats confirment le rôle essentiel des macrophages dans la résolution de l’inflammation indispensable à la réparation tissulaire [ 9, 10], par une adaptation de leur phénotype. De plus, les actions biologiques spécifiques des différents phénotypes macrophagiques sur la différenciation des cellules spécifiques du tissu montrent que les macrophages ont un rôle dans l’homéostasie tissulaire qui dépasse largement leur rôle dans l’immunité innée.