| |
| Med Sci (Paris). 2007 January; 23(1): 18–20. Published online 2007 January 15. doi: 10.1051/medsci/200723118.Calcium et contrôle de la photosynthèse C4
Mécanisme de signalisation et phosphorylation de la phosphoénolpyruvate carboxylase Jean Vidal,1* Jean-Noël Pierre,1 Aurélie Gousset-Dupont,1 Bénédicte Lebouteiller,1 Patrice Meimoun,1 Jose-Antonio Monreal,2 Anna Feria Bourrellier,1 Sofia García-Mauriño,2 and Cristina Echevarría2 1Institut de Biotechnologie des Plantes, Université de Paris-Sud, UMR CNRS 8618 et GDR 2688, 91405 Orsay Cedex, France 2Laboratoire de Physiologie Végétale, Faculté de Biologie, 91405 Orsay Cedex, France MeSH keywords: Calcium, Modèles biologiques, Phosphoenolpyruvate carboxylase, Phosphorylation, Photosynthèse, Protéines végétales, Transduction du signal |
Cadre anatomique et métabolique de la photosynthèse C 4
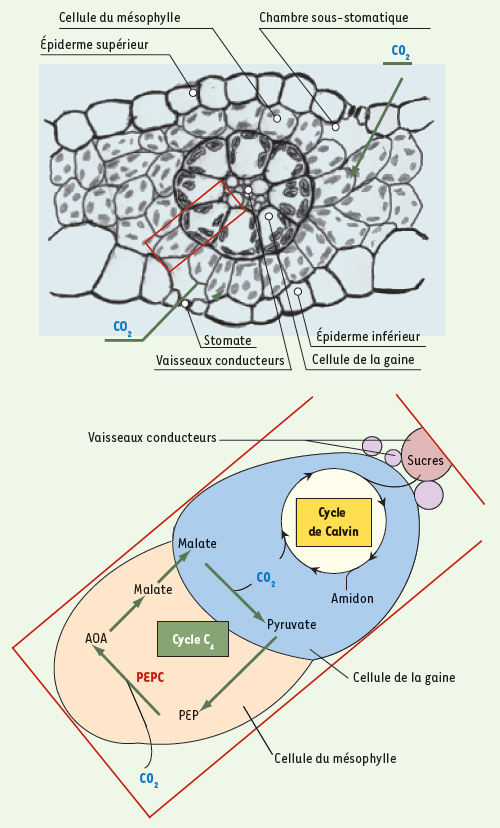
Les plantes de type C4 présentent des caractéristiques anatomiques et biochimiques qui composent ce que l’on nomme communément le syndrome C4. L’architecture de la feuille est en couronne (anatomie Kranz), formée de deux strates cellulaires concentriques, le mésophylle et la gaine périvasculaire (Figure 1). Il existe plusieurs variantes du modèle C4 mais le schéma général de division des tâches dans ces deux types cellulaires est conservé. Ainsi, deux cycles, C4 et de Benson-Calvin coopèrent à la fonction d’assimilation du CO2 par la feuille (Figure 1). Dans ce contexte photosynthétique fondé sur une séparation physique des enzymes et impliquant un intense trafic intercellulaire de métabolites, la phosphoénolpyruvate carboxylase (PEPC, EC 4.1.1.31) catalyse la première étape de la voie métabolique (carboxylation du PEP par le bicarbonate) dans le mésophylle et fait l’objet d’une régulation particulièrement élaborée.  | Figure 1.
Coupe transversale d’une feuille de sorgho. On distingue l’organisation concentrique des tissus photosynthétiques, mésophylle, gaine périvasculaire, entourant les vaisseaux conducteurs. L’image agrandie décrit la distribution des enzymes (cycle C4 et de Benson-Calvin) et la circulation des métabolites dans ce contexte photosynthétique. AOA : acide oxaloacétique ; PEP : acide phosphoénolpyruvique. |
|
La phosphorylation de la PEPC photosynthétique par la PEPC kinase module ses propriétés fonctionnelles La PEPC photosynthétique est un homotétramère de masse 440 kDa dont l’activité est sous contrôle métabolique ; le malate (rétro-inhibiteur), le glucose-6-P (G-6P), les trioses-P (T-P) et la glycine (activateurs allostériques) en sont les principaux effecteurs. La phosphorylation de l’enzyme à la lumière sur une sérine du domaine amino-terminal de la sous-unité (ERHHSIDAQLR) module l’affinité des effecteurs, de sorte qu’une protection accrue contre le malate est observée (par exemple, Vmax et Ki malate augmentent, Ka G-6P diminue) [
1,
2]. Le clonage de l’ADNc et des gènes de PEPC kinase (PEPCk) a été réalisé récemment à partir de plantes C3, C4 et CAM [
3,
4], permettant d’établir la structure primaire de l’enzyme et de révéler des caractéristiques originales : (1) sa taille (32 kDa) est celle d’une sous unité catalytique, sans extensions ; (2) son activité est contrôlée au niveau transcriptionnel (quantité), processus fortement stimulé par les stress salins (NaCl, LiCl) [
5], et par des métabolites effecteurs (malate et G-6P) ; (3) elle est phylogénétiquement apparentée aux CDPK (calcium dependent protein kinases, superfamille des CDPK/SnRK), bien qu’elle ne possède pas de site de fixation du calcium : (4) enfin, la seule cible physiologique connue de cette enzyme est la PEPC. L’inhibition de la phosphorylation de la PEPC in vivo lors d’un traitement des feuilles par la cycloheximide (CHX : composé bloquant la synthèse de la PEPCk et l’augmentation de son activité catalytique) [
6] provoque une perte presque totale de la fixation photosynthétique de CO2 [
7]. Nous avons recherché par quel mécanisme l’activité de la PEPCk est mise en place à la lumière dans le mésophylle. |
L’activité de la PEPCk est contrôlée par une chaîne de transduction du signal lumineux impliquant les flux calciques dans le mésophylle Une technique d’obtention de protoplastes de cellules de mésophylle (Digitaria sanguinalis et sorgho), et une approche combinant la pharmacologie cellulaire, la microscopie confocale et la cytométrie de flux ont été mises au point pour décrypter le mécanisme de transduction du signal lumineux [
8]. Cette démarche expérimentale nous a permis dans un premier temps d’identifier certains relais de la chaîne, notamment et en séquence : (1) un métabolite photosynthétique, l’acide 3-phosphoglycérique (formé dans la gaine périvasculaire par le cycle de Benson-Calvin et transporté dans les chloroplastes des cellules de mésophylle sous forme protonée) provoque l’alcalinisation du pH cytosolique (pHc) : (2) un efflux de Ca2+ vacuolaire dû à une phospholipase C (PI-PLC) et la production transitoire d’IP3 ; (3) l’activation d’une protéine kinase dépendante du Ca2+; (4) la synthèse de la PEPCk, indépendante du Ca2+. Dans ce mécanisme de transduction, l’implication du calcium n’est qu’inférée des données pharmacologiques. Appliquées aux protoplastes de mésophylle C4, les techniques classiques d’imagerie de cet ion sont mal adaptées en raison de fluorescences parasites. Cependant, lorsqu’ils sont traités simultanément par un ionophore du calcium (A23187) et un chélateur de cations bivalents (EGTA) l’induction de la PEPCk et la phosphorylation de la PEPC ne sont plus observées. L’ajout de calcium dans le milieu restaure le processus, confirmant que cet ion est bien un messager secondaire impliqué dans la cascade [
9]. Récemment, les tentatives de transposition des données cellulaires au niveau de l’organe foliaire (disques de feuilles de sorgho) ont modifié la vision, inachevée, que nous avions du rôle du calcium dans ce système de signalisation. En effet, in vivo, la chaîne est partiellement bloquée lorsque de l’EGTA est présent dans le milieu d’incubation des disques ; l’inhibition totale du processus intervient lorsque l’agent chélateur est associé au composé pharmacologique U73123 (inhibiteur de la PI-PLC et de la production d’IP3), ou au TMB-8 (inhibiteur des canaux calciques endogènes). Collectivement, ces résultats montrent que le calcium mobilisé dans le mésophylle provient de deux sources, externe (Ca2+e) et interne (Ca2+i) ; ils suggèrent de plus que des canaux calciques plasmalemmiques, peu actifs dans les protoplastes, sont fonctionnels dans le système intégré de la feuille. Il doit donc exister une régulation fine du flux de ce messager secondaire dans le cytosol par ces deux voies qui peuvent être séquentielles : le Ca2+e provoque l’activation de la PI-PLC conduisant à une amplification par mobilisation du Ca2+i. En corollaire, ces nouvelles données rendent compte, au moins en partie, du mécanisme de régulation de cette enzyme (de type δ chez les plantes) jusqu’ici mal compris. De plus, le pHc, dont la variation est rapide et précoce et qui se stabilise vers 7,3, exerce un contrôle coordonné sur des composants du système (activité et régulation : exemples, la PEPC, la PEPCk) qui pourrait également concerner des canaux calciques du plasmalemme. En aval de la chaîne, l’identité de l’enzyme cible du calcium n’est pour l’instant pas connue. Le candidat est à rechercher parmi les protéine kinases de type CCaMK, ou CDPK (suggéré par l’effet inhibiteur du W7). Cependant, en raison de la grande diversité de ces protéines chez la plante (34 gènes de CDPK chez Arabidopsis), l’identification n’est pas aisée. Par ailleurs, des expériences pharmacologiques récentes utilisant le butanol suggèrent l’implication d’une phospholipase D (PLD) dans la cascade de transduction. Les PLD végétales possèdent un domaine C2 se liant au calcium, mais le mécanisme de régulation lié à cet ion in vivo n’est pas clairement établi. Dès lors, l’intervention d’un autre messager secondaire, l’acide phosphatidique (PA), produit de cette enzyme, est probable. Mais comment s’insére-t-il dans le dispositif de signalisation ? Une hypothèse cohérente est que l’enzyme recherchée est à la fois activée par le calcium et des phospholipides incluant le PA, ce qui évoque les PKC. Il n’existe pas de PKC canonique chez les végétaux, mais bien une CDPK [
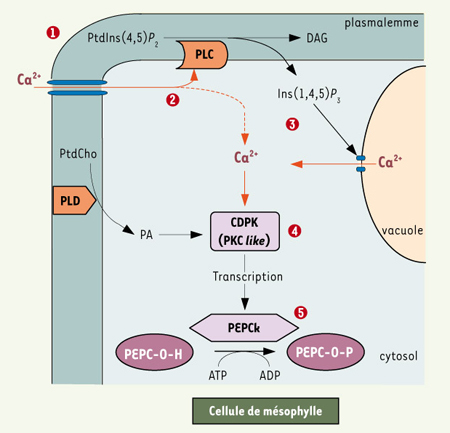
10] qui répond à ces critères de régulation (PKC-like). Une telle enzyme est présente dans les feuilles de la plante C4 et sa caractérisation fonctionnelle est en cours. Un schéma hypothétique d’organisation des éléments de chaîne indiquant les points d’impact du calcium dans les cellules du mésophylle est proposé sur la Figure 2.  | Figure 2.
Rôle hypothétique du calcium dans la chaîne de transduction contrôlant la phosphorylation de la PEPC dans les cellules du mésophylle. 1. Dès l’illumination, l’alcalinisation du cytosol (due au transport du 3-APG dans les chloroplastes ; non montré) est détectée par microscopie confocale. 2. Elle est suivie par une entrée de calcium externe contribuant à l’activation de la PI-PLC (PLC). 3. L’inositol 1,4,5 trisphosphate (Ins (1,4,5)P
3 provoque l’ouverture de canaux calciques du tonoplaste, ce qui amplifie la concentration de calcium cytosolique (Ca2+). 4. En aval une CDPK de type PKC serait activée à la fois par le cation et l’acide phosphatidique (PA) produit par une PLD. 5. Dans l’état actuel de nos connaissances, nous proposons que cette protéine kinase contrôle l’expression du gène de PEPCk (phosphorylation d’un facteur de transcription). La PEPC dans son état phosphorylé (PEPC-OP) maintient la production de malate au niveau requis par le cycle de Benson-Calvin dans les cellules de la gaine. DAG : diacylglycérol ; Ptdlns(4,5)P2 ; phosphatidylinositol 4,5-bisphosphate ; PtdCho : phosphatidylcholine. |
|
Conclusions et perspectives Ce système illustre chez la plante les interactions étroites qui lient métabolisme et signalisation ainsi que l’échange d’information entre cellules pour concourir à la réalisation du processus photosynthétique. Le rôle central du calcium est mis en exergue. Il est probable que ce messager secondaire ne se limite pas au seul contexte photosynthétique, contribuant simultanément au déclenchement et à l’intégration d’un ensemble de processus physiologiques dans le mésophylle. Les expériences que nous développons actuellement tentent de valider génétiquement les composants protéiques (identifiés par pharmacologie) chez Arabidopsis, plante modèle C3 qui possède dans ses feuilles une chaîne de transduction similaire à celle des plantes C4. Arabidopsis offre de plus la possibilité de visualiser les flux calciques à la lumière chez des lignées transformées par l’Aequorine, ainsi d’approfondir les mécanismes régulant les flux du cation dans les feuilles à la lumière. |
1. Chollet R. Vidal J. O’Leary M. Phosphoenolpyruvate carboxylase : a ubiquitous, highly regulated enzyme in plants. Annual Rev Plant Physiol Plant Mol Biol 1996; 47 : 273–98. 2. Vidal J, Chollet R. Regulatory phosphorylation of C4 PEP carboxylase. Trends Plant Sci 1997; 2 : 230–7. 3. Nimmo HG. Control of the phosphorylation of phosphoenolpyruvate carboxylase in higher plants. Arch Biochem Biophys 2003; 414 : 189–96. 4. Taybi T, Patil S, Chollet R, Cushman JC. A minimal serine/threonine protein kinase circadianly regulates phosphoenolpyruvate carboxylase activity in crassulacean acid metabolism-induced leaves of the common ice plant. Plant Physiol 2000; 123 : 1471–81. 5. Garcia-Mauriño S, Monreal JA, Alvarez R, Vidal J, Echevarria C. Characterization of salt-enhanced phosphoenolpyruvate carboxylase kinase activity in leaves of Sorghum vulgare : independence of osmotic stress, involvement of ion toxicity and significance of dark phosphorylation. Planta 2003; 4 : 648–55. 6. Jiao J, Echevarría C, Vidal J, Chollet R. Protein turnover as a component in the light/dark regulation of phophoenolpyruvate carboxylase protein-serine kinase activity in C4 plants. Proc Natl Acad Sci USA 1991; 88 : 2712–15. 7. Bakrim N, Prioul JL, Deleens E, et al. Regulatory phosphorylation of C4 PEPC, a cardinal event influencing the photosynthesis rate in Sorghum and maize. Plant Physiol 1993; 101 : 891–7. 8. Giglioli-Guivarc’h N, Pierre JN, Brown S, et al. The light-dependent transduction pathway controlling the regulatory phosphorylation of C4-phosphoenolpyruvate carboxylase in protoplasts from Digitaria sanguinalis. Plant Cell 1996; 8 : 573–86. 9. Pierre JN, Pacquit V, Vidal J, Gadal P. Regulatory phosphorylation of phosphoenolpyruvate carboxylase in protoplasts from Sorghum mesophyll cells : pH and Ca2+ as possible components of the light-transduction pathway. Eur J Biochem 1992; 210 : 531–7. 10. Hrabak EM, Chan CW, Gribskov M, et al. The Arabidopsis CDPK-SnRK superfamily of protein kinases. Plant Physiol 2003; 132 : 666–80. |