Le paludisme, maladie causée par des parasites du genre Plasmodium, tue plus d’un million de personnes par an dans le monde (→). Les symptômes et les complications de cette maladie sont la conséquence de la multiplication du parasite dans les érythrocytes de l’hôte. L’infection commence par une phase dite pré-érythrocytaire, pendant laquelle le parasite inoculé dans le derme par le moustique vecteur doit rejoindre le foie, où il se multiplie et se transforme dans la forme parasitaire qui infecte les érythrocytes (Figure 1).
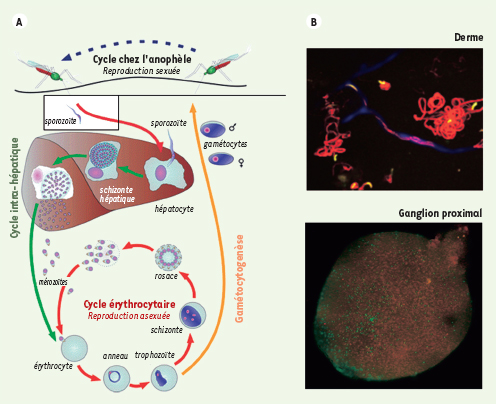
| Figure 1.
Plasmodium (A) et étapes nouvellement décrites de la phase pré-érythrocytaire du cycle de vie (B). Le stade du parasite appelé « sporozoïte » est inoculé par le moustique lors d’une piqûre. La première destination du sporozoïte est le foie. Chaque sporozoïte se multiplie à l’intérieur d’un hépatocyte en milliers de mérozoïtes, forme du parasite qui infecte les érythrocytes et entraîne tous les symptômes de la maladie. Le parasite est transmis à un nouveau moustique après ingestion de formes sexuées. Une étude récente a montré qu’une proportion des sporozoites inoculés dans le derme par le moustique restait dans le derme après cessation de leur pouvoir de mobilité, alors que d’autres se retrouvaient dans le ganglion lymphatique drainant le site de piqûre. |
(→) m/s 2005, n° 2, p. 123, n° 3, p. 243, n° 5, p. 463, n° 8-9, p. 700
La phase pré-érythrocytaire du cycle de vie de Plasmodium, découverte en 1948 [ 1], soit 68 ans après la découverte de la forme érythrocytaire du parasite par Alphonse Laveran, reste encore mal connue [ 2]. Seuls quelques parasites contenus dans les glandes salivaires du moustique, appelés sporozoïtes, sont injectés dans le derme durant une piqûre. Ces parasites sont retrouvés après quelques minutes ou heures dans les hépatocytes, où ils se différentient en quelques jours dans le stade du parasite qui infecte les érythrocytes, mais la voie empruntée par les sporozoïtes entre le site d’inoculation et le foie reste incertaine. Cette phase de l’infection est pourtant connue pour constituer une cible de choix pour la vaccination anti-palustre. On sait en effet depuis la fin des années 1960 que l’injection de sporozoïtes irradiés, qui envahissent normalement les hépatocytes mais ne s’y développent qu’incomplètement, protège de façon complète et durable contre l’injection ultérieure de sporozoïtes infectieux, dans les modèles rongeurs comme chez le singe et chez l’homme [ 3, 4]. Une telle stratégie, bien qu’attrayante puisqu’elle vise à prévenir l’infection sanguine génératrice de la pathologie, a longtemps été considérée comme impraticable en vaccination de masse, en particulier en raison de la difficulté de production et de conservation de sporozoïtes vivants. Cependant, le manque de succès probant jusqu’à maintenant des vaccins synthétiques contre les divers stades de Plasmodium, ainsi que la démonstration récente que des sporozoïtes génétiquement modifiés pouvaient, comme les sporozoïtes irradiés, induire une protection durable dans les modèles rongeurs [ 5, 6], ont redonné de l’intérêt aux stratégies vaccinales fondées sur des parasites vivants. La firme américaine Sanaria a déjà planifié la mise au point et la distribution de doses vaccinales de sporozoïtes vivants atténués de Plasmodium falciparum, l’espèce responsable de plus de 90 % de la mortalité chez l’homme [ 7].
La protection induite par les sporozoïtes irradiés a été largement analysée dans divers modèles, et semble reposer en grande partie sur une réponse relayée par les lymphocytes CD8 et dirigée contre les hépatocytes infectés [ 8]. En revanche, l’infection primaire par les sporozoïtes reste difficile à étudier. Jusqu’à maintenant, les sporozoïtes, cellules douées d’une vigoureuse mobilité dite « en glissant », étaient supposés trouver leur chemin jusqu’aux capillaires sanguins du derme et, une fois dans la circulation sanguine, être retenus spécifiquement par les hépatocytes, leur destination finale, via une interaction entre les héparane sulfate protéoglycanes hépatiques et la protéine majoritaire de surface du parasite [ 9].
Des progrès obtenus ces dernières années dans la transformation génétique de Plasmodium ainsi que dans les techniques d’imagerie in vivo ont permis pour la première fois une analyse quantitative et en temps réel du devenir des sporozoïtes après transmission naturelle par le moustique [ 10]. Des sporozoïtes de Plasmodium berghei exprimant la protéine GFP, couplée à l’utilisation de techniques d’imagerie confocale intravitale chez la souris, ont révélé que près de la moitié des sporozoïtes inoculés par des moustiques Anopheles stephensi restent dans le derme après cessation de leur pouvoir de mobilité. Parmi les sporozoïtes qui quittent le site de piqûre, ~70 % envahissent les capillaires sanguins alors que les 30 % restants envahissent les vaisseaux lymphatiques. Alors que les sporozoïtes présents dans le sang rejoignent le foie, ceux présents dans la circulation lymphatique sont arrêtés dans le ganglion lymphatique proximal. Là, en 4 heures, plus de 50 % des parasites sont internalisés dans des cellules dendritiques, où ils sont rapidement dégradés. De façon encore plus inattendue, une faible proportion des sporozoïtes échappent à cette dégradation et entament un développement partiel. Les parasites ne se développent pas dans des cellules hématopoïétiques, mais en association avec des cellules exprimant la podoplanine, un antigène de cellules endothéliales du système lymphatique. Ce développement ne permet pas la production de parasites infectieux, mais s’accompagne néanmoins de la production d’antigènes parasitaires précoces (couvrant la première moitié du développement normal du sporozoïte), que l’on pensait jusqu’à maintenant produits uniquement dans les hépatocytes.
Cette première étude quantitative de la transmission de Plasmodium du moustique au mammifère révèle donc de nouvelles étapes dans le cycle de vie du parasite, au moins chez les espèces infectant les rongeurs. Il semble exister au moins trois destinations possibles pour le sporozoïte inoculé : le derme, le ganglion lymphatique proximal drainant le site de piqûre, et le foie. Le devenir des sporozoïtes qui restent dans le derme est pour l’instant inconnu, alors que les sporozoïtes intra-ganglionnaires peuvent être dégradés rapidement ou se développer, au moins partiellement. Il existe donc une surprenante multiplicité de voies d’infection pour les sporozoïtes, dont l’importance relative fluctue probablement selon de nombreux paramètres, notamment la voie d’inoculation naturelle ou expérimentale. Les études futures devront confirmer que ce nouveau tableau de la phase pré-érythrocytaire de l’infection est valable pour d’autres espèces plasmodiales. Elles devront aussi préciser la contribution de chacune de ces voies d’infection dans les modèles murins de réponses immunitaires et de vaccination, notamment à l’aide de sporozoïtes mutants, qui peuvent désormais être caractérisés in vivo de façon quantitative. La dissection des effets potentiellement antagonistes de certaines de ces voies, vers la tolérance ou la protection, devrait permettre de cerner de meilleures méthodologies vaccinales, que celles-ci reposent sur des sporozoïtes vivants atténués ou sur une autre formulation.