| |
| Med Sci (Paris). 2006 October; 22(10): 878–880. Published online 2006 October 15. doi: 10.1051/medsci/20062210878.Tuberculose et VIH : drame de l’Afrique Dominique Labie* Département de génétique, développement et pathologie moléculaire, Institut Cochin, 24, rue du Faubourg Saint-Jacques, 75014 Paris, France MeSH keywords: Adolescent, Adulte, Afrique, Enfant, Enfant d'âge préscolaire, Infections à VIH, Humains, Adulte d'âge moyen, Tuberculose |
Depuis quelques décennies, on avait cru à une régression de la tuberculose. Les conditions d’hygiène s’amélioraient. Avec le BCG, on avait un vaccin, imparfait certes, mais néanmoins efficace. Mais au cours de ces dernières années, la maladie a repris avec une amplitude sans précédent et a fait l’objet de toute une série d’articles dans le numéro du Lancet du 12 mars 2006. Les auteurs distinguent quatre variantes dans l’épidémiologie de la tuberculose [
1]. La maladie est devenue rare dans nos pays industrialisés, liée essentiellement à l’immigration. En pays sous-développés, mais dans lesquels le VIH reste rare, elle se présente sous les formes que nous avons classiquement connues. Deux problèmes nouveaux aggravent actuellement la situation. À la suite de traitements sans doute insuffisants, la présence de souches multirésistantes est fréquente dans les pays de l’Est. Mais c’est en Afrique sub-saharienne, surtout de l’extrême sud et de l’est qu’on observe la situation la plus dramatique, quand la tuberculose se développe en même temps que le VIH. Cette association crée des défis nouveaux qui dépendent, au moins partiellement, de l’amélioration de l’accès aux traitements antiviraux. |
Rappelons d’abord quelques données épidémiologiques chiffrées. Un rapport de l’OMS donne des observations faites en 2003 [
2]. On avait cette année-là enregistré 8,8 millions de nouveaux cas de tuberculose et 1,7 millions de décès, dont respectivement 27 et 31 % en Afrique [
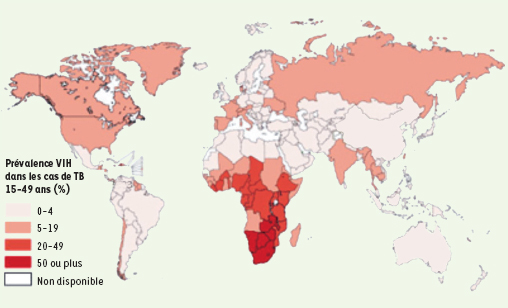
3]. Si, en valeur absolue, on compte plus de cas en Asie (Inde, Sud-Est Asiatique, Indonésie, Chine), la proportion est de beaucoup supérieure dans les pays où l’endémie de tuberculose coïncide avec l’expansion du VIH, en moyenne 38 % de tuberculeux VIH positifs dans les pays africains, jusqu’à 75 % dans certaines régions (Zimbabwe, Kenya, Malawi…) (Figure 1). La tuberculose, comme infection opportuniste, est la cause majeure de décès des sidéens, et se présente souvent comme le premier signe révélateur d’une infection par le VIH. Chez des sujets immunodéprimés, la proportion de tuberculeux a augmenté de plus de 6 % par an. En Afrique du Sud où la proportion d’individus VIH+ dépasse 20 %, l’incidence des tuberculoses pulmonaires atteint 461 à 719 cas pour 100.000 habitants (contre 5 pour 100 000 aux États-Unis). La durée de contagiosité chez les sidéens est nettement inférieure est ce qu’elle est chez les sujets VIH négatifs, alors que leur susceptibilité à la contagion est très supérieure. Ces deux facteurs, susceptibilité accrue et contagiosité prolongée des non sidéens expliquent bien l’incidence élevée. La tuberculose se présente majoritairement comme une maladie touchant les hommes, surtout les hommes jeunes (statistiques faites en 2004), mais il n’est pas exclu que les conditions de recensement de la population introduisent des biais statistiques.  | Figure 1.
Distribution de la tuberculose dans le monde en 2003. Chaque couleur indique une incidence de toutes les formes de la tuberculose rapportée à 100 000 habitants. |
|
Le problème du diagnostic Une difficulté supplémentaire tient au fait que le diagnostic peut être difficile, les symptômes étant souvent atypiques ou banaux : pneumonie aiguë, toux traînante, fièvre, diarrhée. Des autopsies dans plusieurs pays ont montré qu’un diagnostic exact n’avait été fait que dans 50 % des cas environ. De nombreux diagnostics sont tardifs, ayant permis la contagion à partir de cas non détectés. Dans les pays où coexistent les deux pathologies à l’état endémique, la recherche du VIH s’impose chez tout tuberculeux. Une difficulté sociologique réside aussi dans le fait que les approches diagnostiques sont historiquement différentes. Les campagnes anti-tuberculeuses ont été publiques, alors que la recherche du Sida est, en principe, individuelle et confidentielle. Or il semble qu’actuellement le VIH ne soit recherché que chez environ 10 % des Africains atteints de tuberculose pulmonaire [
4]. La technique actuelle, examen des crachats au microscope, n’a pas beaucoup changé depuis les années 1880 : elle explore 0,2 μl de matériel ; un résultat positif exige une concentration de 10 000 bacilles par ml, même si on regarde une centaine de champs. Le résultat est donc inconstant, le temps d’exploration est lent, il est souvent négatif chez les sidéens. Le seul avantage est le faible investissement en matériel mais une amélioration technique est impérative quand on sait qu’environ 10 % des sujets VIH+ présentent une tuberculose active, et réciproquement. À ces diagnostics faits chez des sujets qui se présentent eux-mêmes comme malades, il faudrait sûrement ajouter une recherche active dans la population. Une expérience faite au Pérou, dans les bidonvilles de Lima, par une équipe de Harvard (Cambridge, États-Unis), est à ce titre intéressante [
5] : l’examen systématique des sujets habitant la maison d’un malade, ainsi que ceux des deux maisons voisines, a permis l’identification de cas asymptomatiques mais contagieux (0,91 % dans l’habitat du malade, 0,18 % chez les voisins). |
Prise en charge et traitement Un diagnostic avéré est une condition majeure pour une optimisation du traitement. La prise en charge se trouve profondément modifiée par l’amélioration de la disponibilité des antirétroviraux. Elle est définie en 2005 pour les années à venir par le MDG (Millenium Development Goal) pour les quinze pays les plus affectés. L’effet d’un traitement antirétroviral peut, en effet, être très rapide, mais la mortalité au cours du premier mois reste fréquente, surtout quand le taux de cellules CD4 est très bas. C’est dire l’importance d’un diagnostic simultané des deux affections [
6]. Il ne faut pas négliger la persistance d’un déficit immunitaire, et la fréquence des rechutes (jusqu’à 19,1 % chez les sidéens hospitalisés en Afrique du Sud). Une surveillance attentive cherchera à éviter l’émergence de souches multirésistantes (à l’isoniazide, à la rifampicine qui sont les traitements les moins onéreux). Le schéma classique antituberculeux comporte quatre produits pendant deux mois, puis deux produits pendant quatre à six mois. Toutefois, les patients se sentant rapidement mieux, le défaut de compliance est fréquent. Le traitement antirétroviral HAART (highly active anti-retroviral therapy) doit-il être introduit aussitôt ou faut-il attendre quelques semaines ? Une expérience faite au Brésil suggère qu’attendre quatre semaines est préférable [
7]. Outre ces problèmes logistiques, il faut savoir aussi qu’il existe des interactions médicamenteuses. Les antirétroviraux utilisés dans les pays pauvres sont métabolisés par les enzymes du cytochrome P450 (CYP450). Or, la concentration plasmatique de CYP 450 est diminuée de façon importante (20 % à 30 %) par les antituberculeux habituels, rifampicine, nevirapine. Ces interférences pourraient faire émerger des souches résistantes ou s’avérer hépatotoxiques. Des produits antituberculeux moins actifs sur CYP450 existent, mais ils sont peu accessibles car beaucoup plus onéreux. L’action du traitement HAART, en reconstituant une immunité, peut également entraîner une aggravation des symptômes. Il n’existe actuellement pas de protocole simple validé. |
Les priorités de la recherche Plusieurs directions s’imposent, la première étant une amélioration du diagnostic [
8]. Les résultats espérés en 1991 dans ce domaine n’ont pas été atteints en 2005 : moins de 50 % des cas seraient diagnostiqués, alors que les méthodes existantes devraient en cibler 60 %. L’examen microscopique des crachats n’est pas suffisant. Des méthodes de culture rapides et de nouvelles stratégies devraient être instaurées. Comment diagnostiquer, surtout chez l’enfant, les formes sans manifestations pulmonaires ? La connaissance du génome de la mycobactérie et de ses voies métaboliques devrait permettre de mieux cerner l’abord thérapeutique. Les développements pharmacologiques sont une priorité absolue [
9]. Il faut mettre au point des produits pénétrant dans des sites mal accessibles ; ils pourraient cibler des bactéries à l’état dormant, dont la demi-vie sera longue. Les progrès des dernières décennies avaient diminué l’émulation commerciale de nombreuses compagnies pharmaceutiques. La recrudescence de tuberculose pulmonaire sous la pression du VIH semble l’avoir ranimée. À la demande de la Fondation Rockefeller, plusieurs compagnies majeures (Astra-Zeneca, GlaxoSmithKline, Novartis…) ont formé une TB Alliance soutenue par des organismes publics (OMS, NIH, CDC…) et de grandes fondations privées. Cette coopération multicentrique devrait aboutir à la mise au point de produits nouveaux. Une autre orientation de la recherche est celle des vaccins [
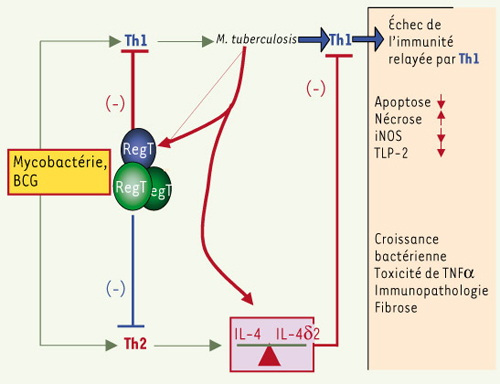
10]. Le BCG, mis au point, en 1921, a réduit la mortalité chez l’enfant, il a peu d’effet sur la tuberculose pulmonaire du jeune adulte, sa durée de protection n’a pu être augmentée. Cet effacement de l’immunité serait dû à la présence de mécanismes annulant l’effet de la réponse Th1, et sans doute à une réponse Th2 inappropriée, ou à une dérégulation de l’activité des cellules T régulatrices. Un vaccin efficace devrait donc agir sur cette régulation, afin d’obtenir une réponse Th1 robuste, avec production d’IL-12, IFNγ, de TNF, et sans doute d’autres facteurs moins bien identifiés. De plus, des sujets gravement atteints sont souvent anergiques, avec une cuti-réaction redevenue négative. Seul, un travail fondamental et de longue haleine permettra de comprendre la problématique de la réponse immune, de contrôler la régulation des cellules T, d’identifier les antigènes exprimés et de prédire l’effet qu’ils auront sur la réponse immune (Figure 2).  | Figure 2.
Hypothèse d’une protection de durée variable après une vaccination par le BCG. Les mycobactéries de l’environnement suscitent et entretiennent dans l’organisme un mélange en proportions variables de Th1, Th2, d’interleukines, et de cellules T réactives (RegT). Le vaccin devrait, au mieux, limiter la réaction Th2, mais, en fonction des conditions locales, il se peut qu’il agisse surtout sur Th1. Cela peut compromettre l’action dominante de la réponse Th1 et se traduire par une réaction immunopathologique. Un vaccin efficace devra, non seulement stimuler Th1, mais aussi moduler les cellules RegT et Th2. |
|
La tuberculose pulmonaire est un problème de santé publique Un premier cadre de travail, défini en 1995 par l’OMS, prévoyait un système DOTS qui a permis la prise en charge de 20 millions de sujets en 10 ans [
11]. Ce système était basé sur l’implication des gouvernements, le diagnostic microscopique, un traitement standardisé, l’approvisionnement en médicaments, et une surveillance régulière. Il est cependant actuellement insuffisant pour faire face à la coexistence du VIH, à l’apparition de souches multirésistantes et aux exigences formulées par le MDG. Des approches complémentaires doivent être mises sur pied pour obtenir d’ici 2015 une réduction de 50 % de la prévalence et des décès dus à la tuberculose par rapport à 1990. Face aux problèmes majeurs, deux défis sont prioritaires : le TB/HIV et le MDR-TB. Fondés, comme les précédents, sur la politique, les diagnostics, les traitements, et la surveillance, ils font appel à toutes les collaborations, nationales, internationales, privées (la fondation Bill Gates s’est largement impliquée). Ils comportent aussi un volet social d’information et d’éducation, en même temps qu’une stimulation de la recherche. Les efforts doivent être ciblés sur des populations à risque, habitants de bidonvilles, prisonniers, migrants, drogués, ainsi que chez les diabétiques. Ce plan, défini en 2005 (Global Plan to Stop TB) est orienté spécifiquement vers les populations pauvres [
12]. Il doit donc comporter à la fois le volet social cernant ces populations, et le volet économique qui en permettra l’application. Il faudra identifier les barrières limitant l’accès aux soins, les éliminer, et mieux définir les groupes qui nécessitent une considération spécifique. On peut penser que des pays comme l’Inde et la Chine, qui représentent à eux seuls environ 35 % des nouveaux cas chaque année, ont une situation économique qui leur permettra la prise en charge de leurs malades. L’effort international doit donc aller prioritairement vers les pays qui cumulent la maladie et le sous-développement. |
1. Corbett EI, Marston B, Churchyard GJ, De Cock KM. Tuberculosis in sub-Saharan Africa : opportunities, challenges, and change in the of antiretroviral treatment. Lancet 2006; 367 : 926–37. 2. World Health Organization. Global tuberculosis control : surveillance, planning, financing. WHO report 2005. WHO/HTM/TB/2005.349. Genève : OMS, 2005. 3. Dye C. Global epidemiology of tuberculosis. Lancet 2006; 367 : 938–40. 4. Perkins MD, Roscigno G, Zumla A. Progress towards improved tuberculosis diagnostics for developing countries. Lancet 2006; 367 : 942–3. 5. Becerra MC, Pachao-Torreblanca I, Bayona J, et al. Expanding tuberculosis case detection by screening households contacts. Publ Health Rep 2005; 120 : 271–7. 6. Harries AD, Chimzizi R, Zachariah R. Safety, effectiveness, and outcomes of concomitant use of highly active antiretroviral therapy with drugs for tuberculosis in resource-poor settings. Lancet 2006; 367 : 944–5. 7. Pedral-Sampaio DB, Alves CR, Netto EM, et al. Efficacy and safety of efavirenz in HIV patients on rifampin for tuberculosis. Braz J Infect Dis 2004; 8 : 211–6. 8. Onyebujoh P, Rodriguez W, Mwaba P. Priorities in tuberculosis research. Lancet 2006; 367 : 940–1. 9. Spigelman M, Gillespie S. Tuberculosis drug development pipelines : progress and hope. Lancet 2006; 367 : 945–7. 10. Doherty TM, Rook G. Progress and hindrances in tuberculosis vaccine development. Lancet 2006; 367 : 947–9. 11. Raviglione MC, Uplekar MW. WHO’s new stop TB strategy. Lancet 2006; 367 : 952–5 12. Squire SB, Obasi A, Nhlema-Simwaka B. The Global plan to stop TB : a unique opportunity to address poverty and the Millenium development goals. Lancet 2006; 367 : 955–7. |