| |
| Med Sci (Paris). 2006 August; 22(8-9): 739–744. Published online 2006 August 15. doi: 10.1051/medsci/20062289739.Cellules natural killer et immunité innée contre le paludisme Sophie Roetynck, Myriam Baratin, Éric Vivier, and Sophie Ugolini* Centre d’immunologie de Marseille-Luminy, Inserm-CNRS, Université de la Méditerranée, Parc scientifique et technologique de Luminy, Case 906, 13288 Marseille Cedex 09, France |
Plasmodium falciparum : agent responsable du paludisme chez l’homme Le paludisme est une maladie causée par un parasite intracellulaire obligatoire du genre Plasmodium, appartenant au phylum des Apicomplexa. Parmi les quatre espèces plasmodiales pouvant infecter l’homme, Plasmodium falciparum (Pf) est responsable des cas les plus nombreux et les plus sévères de paludisme. En effet, ce parasite est à l’origine de plusieurs centaines de millions d’infections, et de 1 à 2 millions de morts chaque année sur la planète [
1].
Plasmodium est transmis à l’homme sous forme de sporozoïtes lors du repas sanguin du moustique vecteur, l’anophèle femelle. Les sporozoïtes sont transportés jusqu’au foie, où ils se multiplient pour produire plusieurs milliers de mérozoïtes. Cette première phase, totalement silencieuse du point de vue clinique, est suivie par un cycle intra-érythrocytaire. En effet, les mérozoïtes infectent et se multiplient de manière cyclique dans les globules rouges. À ce stade, la libération périodique et massive de molécules parasitaires dans le sang est à l’origine de la plupart des signes cliniques, notamment des accès fébriles, observés au cours de la maladie [
2]. L’invasion des hématies par le parasite induit des modifications drastiques de leur surface membranaire, qui résultent en l’exposition de multiples molécules [
3]. Certaines, identifiées comme des ligands pour des récepteurs cellulaires de l’hôte, confèrent aux érythrocytes parasités (Pf-E) une capacité de cyto-adhérence à l’endothélium vasculaire. Cette propriété, considérée comme l’un des facteurs majeurs de la virulence de Pf, serait notamment utilisée par le parasite pour limiter son élimination dans la rate. Au cours de sa maturation, le parasite produit un certain nombre de molécules impliquées dans la modulation des processus pathogéniques, en grande partie à travers leurs effets sur le système immunitaire inné [
4]. La détection de l’infection par le système immunitaire permet de limiter la fréquence de cellules infectées circulantes, ainsi que les manifestations cliniques [
5]. En revanche, une activation excessive et inappropriée du système immunitaire peut se révéler délétère pour l’hôte, et contribuer à l’apparition de formes sévères (anémies, acidoses métaboliques, paludisme cérébral…) pouvant conduire à la mort [4]. L’élucidation des mécanismes très complexes mis en jeu au cours des réponses immunitaires antiplasmodiales mérite donc une attention toute particulière. |
Une réponse précoce des cellules natural killer
Des études cliniques, ainsi que des modèles murins de paludisme, suggèrent un rôle des réponses immunitaires innées dans le contrôle des primo-infections paludéennes. Chez la souris, la résistance au paludisme est dépendante de signaux liés à la production précoce d’IFNγ-, d’IL-12 et de TNF-α (tumor necrosis factor-α) [
6–
9]. De même, une réponse IFNγ robuste est associée chez l’homme à une susceptibilité plus faible à l’infection [
10,
11]. La production d’IL18 serait également un élément important de la réponse immunitaire contre le parasite [
12–
14]. De plus, au cours du paludisme de l’enfant, les concentrations de granzymes A et B solubles, ainsi que des cytokines (IL-12p70, IL-10), sont augmentées dans le sérum [
15]. Par ailleurs, la réponse immunitaire précoce a été étudiée chez des volontaires sains non immuns infectés par une souche de Pf inoculée par piqûre de moustiques. Du granzyme A soluble, de l’IFN-γ, de l’IL-12 et de l’IL-8 ont été détectés dans le sérum de ces individus, avant même l’apparition de signes cliniques et d’une parasitémie détectable [15]. Ces résultats suggèrent la mise en place d’une réponse immunitaire innée, impliquant en partie des cellules à capacité cytotoxique au cours de la phase précoce de l’infection. Cette étude in vivo est venue corroborer des expériences in vitro détectant une production de TNFα, d’IL12 et d’IFNγ dans du surnageant de cellules mononuclées du sang périphérique (PBMC) humaines, 10 heures après exposition à des Pf-E [
16]. Des études récentes suggèrent que les cellules NK pourraient être l’une des sources de cette production précoce de cytokines. En effet, le groupe du Dr E. Riley a identifié les cellules NK, au sein des PBMC, comme la source principale d’IFNγ après exposition in vitro à des hématies infectées par une souche Pf de laboratoire [
17]. Cette production précoce d’IFNγ en réponse aux Pf-E a été confirmée par d’autres études du même groupe [
18,
19], et étendue à plusieurs autres souches de Pf, y compris certains isolats cliniques [
20]. La capacité de production d’IFNγ en réponse aux Pf-E est variable en fonction des donneurs [17], mais cette variabilité interindividuelle est également observée lorsque l’on mesure la réponse NK à des cibles tumorales [20] (résultats non publiés), et pourrait ne pas être attribuée exclusivement à un défaut de réponse contre le parasite. En effet, lorsque l’on mesure l’activation des cellules NK par d’autres moyens de lecture tels que l’expression des marqueurs de surface CD25 et CD69, tous les donneurs testés répondent à l’infection [19, 20], suggérant que la sensibilité des cellules NK à la présence du parasite est une propriété largement conservée au sein de la population humaine étudiée. |
La reconnaissance par les cellules NK des globules rouges infectés est-elle directe ? Les cellules NK sont des lymphocytes présents à la fois dans le sang, les organes lymphoïdes et les tissus périphériques [
21]. Elles sont impliquées, grâce à des récepteurs de surface, dans la reconnaissance directe de cellules ayant subi un stress infectieux ou tumoral [
22]. Des études épidémiologiques montrent l’existence d’une corrélation entre une forte activité des cellules NK et une diminution de l’incidence de cancer chez l’homme, suggérant que cette reconnaissance, observée in vitro, pourrait avoir des conséquences importantes in vivo dans la surveillance immunitaire anticancéreuse [
23]. Ces cellules sont également impliquées dans l’initiation de la réponse immunitaire adaptative [
24]. De plus, l’expression d’un récepteur du fragment Fc des immunoglobulines (CD16, FcγRIIIA) leur confère un répertoire de reconnaissance très large (celui des IgG1 et IgG3 circulantes), et leur permet ainsi d’être également des acteurs à part entière de la réponse immunitaire adaptative. Les fondements moléculaires de la reconnaissance de cellules tumorales par les cellules NK commencent à être bien élucidés (Figure 1). Plusieurs récepteurs de surface des NK ont été identifiés : certains sont spécifiquement exprimés par ces lymphocytes, tandis que d’autres peuvent être exprimés par d’autres types cellulaires [
25]. L’activité fonctionnelle des cellules NK est également régulée grâce à des récepteurs inhibiteurs : les plus étudiés reconnaissent des molécules du CMH (complexe majeur d’histocompatibilité) de classe I, classiques ou non, et participent en partie à la tolérance des cellules NK pour les cellules du soi saines [22]. Concernant le stade sanguin de l’infection par Pf, il est notable que les globules rouges n’expriment aucune molécule de CMH. Ainsi, théoriquement, la seule expression à leur surface d’un ligand activateur, induite par l’infection, pourrait les rendre sensibles à la lyse ou à la reconnaissance par les cellules NK.
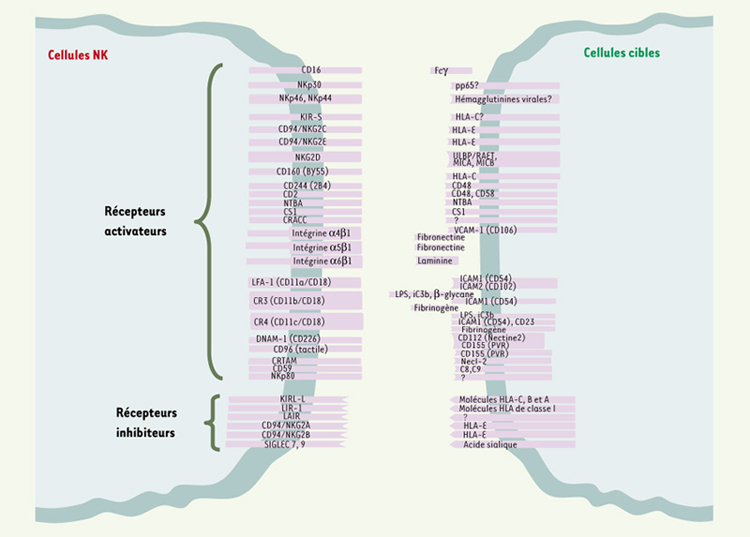
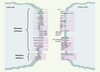 | Figure 1.
Récepteurs activateurs et inhibiteurs des cellules NK. De nombreuses molécules ont été décrites à la surface des cellules NK comme impliquées dans la reconnaissance de certaines de leurs cibles. En fonction de la cible considérée, le programme d’activation des cellules NK est régulé par l’engagement simultané de plusieurs de ces récepteurs de surface. La nature et l’intensité de la réponse dépendent d’un équilibre entre signaux inhibiteurs et activateurs. Par ailleurs, de nombreux récepteurs pour des cytokines et chimiokines, non représentés sur ce schéma, sont également impliqués dans la régulation des réponses NK. Les fondements moléculaires de la reconnaissance des érythrocytes infectés par Pf demeurent inconnus. |
Les résultats actuels suggèrent que l’activation très rapide des cellules NK au sein des PBMC en réponse aux Pf-E est le résultat d’une reconnaissance directe des Pf-E par les cellules NK et de leur activation indirecte par d’autres cellules du système immunitaire inné, présentes en culture. Les arguments en faveur de cette hypothèse sont détaillés ci-après. Cyto-adhérence entre cellules NK et érythrocytes infectés Nous avons montré que des lignées NK humaines sont capables de former des rosettes avec des globules rouges infectés par certaines souches de Pf [ 20] (Figure 2). La formation de conjugués entre des Pf-E et des cellules NK fraîchement isolées des PBMC a également été décrite [ 18, 19]. Cette interaction spécifique suggère l’existence d’un ou plusieurs récepteurs sur les cellules NK impliqués dans la reconnaissance directe des Pf-E.
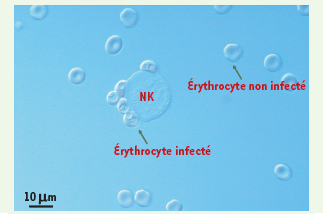
 | Figure 2.
Cyto-adhérence des érythrocytes infectés par
Pf
à la surface des cellules NK. Après 1 h 30 de coculture, la lignée NK humaine NK92 forme des rosettes avec des érythrocytes infectés par la souche plasmodiale FcR3CSA. L’absence d’interaction entre les cellules NK et les érythrocytes non infectés présents dans la culture souligne la spécificité de la reconnaissance. |
Cytotoxicité des cellules NK L’une des grandes caractéristiques fonctionnelles des cellules NK est leur capacité à tuer leur cible de manière directe. En fonction du test utilisé, la réponse à la question cruciale du potentiel cytotoxique des cellules NK à l’encontre des Pf-E n’est toutefois pas claire. Deux études suggèrent une cytotoxicité des cellules NK contre des Pf-E [
26,
27], observée en utilisant un test classique de relargage de chrome 51 par des cellules cibles radiomarquées. Cependant, dans ces deux études, le mode de purification des cellules NK ne permet pas d’obtenir une pureté de 100 %, et la présence d’autres types cellulaires (cellules Tγδ, notamment) dans la préparation de cellules effectrices ne peut être exclue. Pour éviter cet écueil expérimental qui rend difficile l’interprétation des résultats, il est possible d’utiliser un test mesurant, par cytométrie de flux, l’exposition des protéines Lamp 1 et Lamp 2 (CD107a et b) à la surface des cellules NK, au cours de la dégranulation induite durant le processus de cytotoxicité. Ce protocole expérimental permet de quantifier précisément le nombre d’effecteurs qui ont réagi à leur cible pendant la durée du test, et ne nécessite aucune purification préalable [
28,
29]. En utilisant ce test, nous n’avons pas détecté de dégranulation de cellules NK fraîchement isolées du sang périphérique et mises en présence de Pf-E pendant 2h à 6 h [ 20]. Cependant, ce résultat n’exclut pas que les cellules NK puissent interrompre le cycle parasitaire par un autre mécanisme. Par ailleurs, il est possible qu’une pré-activation des cellules NK soit nécessaire pour révéler cette activité cytotoxique. De fait, une exposition des marqueurs Lamp peut être détectée à la surface des cellules NK après qu’elles aient été mises en culture 24h avec des Pf-E [ 19]. Cependant, la validité de ces marqueurs en tant que témoins de la cytotoxicité reste à démontrer pour de telles cinétiques d’incubation. Les cellules NK pourraient également jouer un rôle plus tardivement, lorsqu’une réponse immunitaire adaptative a été mise en place, via la reconnaissance de Pf-E recouverts d’anticorps grâce à leur récepteur CD16 [27]. Le rôle de ce phénomène in vivo doit encore être évalué. Production de cytokines par les cellules NK Les cellules NK ont également la capacité de produire un certain nombre de cytokines et de chimiokines en réponse à différents stimulus. Elles sécrètent notamment l’IFN-γ, le TNF-α, de l’IL-10, de l’IL-13 et du GM-CSF ( granulocyte/macrophage-colony stimulating factor) [
30]. En testant la production de plusieurs facteurs solubles par des cellules NK purifiées en réponse à des Pf-E, nous avons trouvé une sécrétion spécifique d’IL-8 par des cellules NK purifiées du sang périphérique de plusieurs donneurs [ 20], ainsi que par la lignée NKL (résultats non publiés). La présence du parasite permet également la surexpression de surface du récepteur CD69. Ces résultats suggèrent que l’interaction observée entre les deux types cellulaires a des conséquences fonctionnelles mesurables. Cependant, les cellules NK purifiées ne produisent pas d’IFN-γ en présence de Pf-E [ 18, 20]. Il existe donc dans les PBMC une ou plusieurs autres populations cellulaires capables de donner aux cellules NK des signaux supplémentaires d’activation, nécessaires pour que cette sécrétion ait lieu. L’activation des cellules NK doit donc être replacée dans le contexte plus général de la réponse immunitaire innée. |
La réponse NK replacée dans le contexte de la réponse immunitaire innée La réponse immunitaire contre Plasmodium, étudiée plus en détail chez la souris, est très complexe et implique plusieurs effecteurs des réponses immunitaires innées et acquises. Outre les cellules NK, ces effecteurs incluent des anticorps, des lymphocytes Tαβ CD4+ et CD8+, des lymphocytes Tγδ, des NKT (cellules T natural killer), des cellules dendritiques et des macrophages. La production d’IL-12 par des cellules encore non identifiées est requise pour la production d’IFN-γ par les cellules NK [17]. Cependant, l’ajout d’IL-12 à une coculture entre PBMC humains et Pf-E n’est pas suffisante pour induire la production d’IFN-γ par des cellules NK purifiées [17, 20]. La réponse NK s’intègre donc dans une réponse immunitaire innée impliquant plusieurs types cellulaires [
31]. En effet, plusieurs récepteurs exprimés par ces cellules ont été impliqués dans la reconnaissance de produits de P. falciparum
(Tableau I).
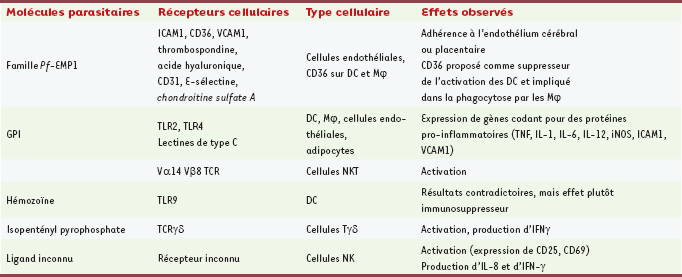
 | Tableau I.
Activité biologique des molécules de
Plasmodium falciparum
sur les cellules du système immunitaire inné (d’après [ 4]). DC : cellules dendritiques ; Mj : macrophages ; Pf-EMP1 : Pf-erythrocyte membrane protein 1 ; GPI : glycosylphosphatidylinositol ; ICAM1 : intercellular adhesion molecule 1 ; IFNγ : interferon γ ; IL : interleukines ; iNOS : inducible nitric-oxide synthase ; TCR : récepteur des cellules T ; TLR : Toll like receptor ;TNF : tumor necrosis factor ; VCAM1 : vascular cell-adhesion molecule 1. |
Autres cellules du système immunitaire inné capables de reconnaître Pf
Parmi les cellules en première ligne dans la réponse immunitaire innée après infection par Pf, on distingue les cellules dendritiques (DC), les lymphocytes Tγδ et les macrophages (Tableau I). L’effet du contact avec des Pf-E est différent selon les sous-populations de DC considérées. Les DC plasmacytoïdes (PDC) sont activées via leur récepteur TLR9, et produisent de l’INF-αen réponse à des lysats de Pf-E [
32]. Cette activation serait importante pour aider à la production d’IFN-γ par les cellules Tγδ [32]. Une autre étude a montré que, in vitro, les Pf-E étaient également responsables d’une modulation négative de l’activation de DC dérivées de monocytes [
33]. Cette modulation négative, dépendante d’une interaction avec le récepteur CD36, se traduit par une absence d’expression des molécules du CMH, des molécules d’adhésion et de costimulation, ainsi qu’une absence de production d’IL-12 normalement observée en présence de LPS (lipopolysaccharide). Il reste cependant un grand nombre de questions ouvertes sur le rôle effectif des DC au cours du paludisme [
34]. Les cellules Tγδ sont, elles aussi, capables de reconnaître des molécules produites par Pf. Elles sont notamment activées par des phospho-antigènes non peptidiques de Pf [
35,
36]. Ces cellules, capables de produire de l’IFNγ, sont également cytotoxiques face à des Pf-E [31,
37]. Néanmoins, leur activation semble nécessiter, en plus de la reconnaissance directe par le TCR des érythrocytes infectés, des cytokines exogènes, suggérant que les réponses Tγδ pourraient être elles aussi dépendantes de l’activation d’autres types cellulaires, tels que les monocytes et les cellules dendritiques [31]. Les monocytes/macrophages humains sont également activés (production de protéines pro-inflammatoires comme le TNFα) par des glycosylphosphatidylinositols (GPI) provenant de Pf. Les récepteurs impliqués dans cette reconnaissance sont TLR2 et, dans une moindre mesure, TLR4 [
38,
39]. Par ailleurs, le récepteur CD36 semble important dans la phagocytose de Pf-E par les macrophages. Coopération spécifique entre cellules NK et macrophages Nous avons testé le rôle des différentes cellules du système immunitaire inné capables de reconnaître Pf dans la production d’IFN-γ par les cellules NK, en présence de doses suboptimales d’IL-12. Malgré leur activation dans notre système expérimental, la déplétion sélective des PDC, des DC conventionnelles ou des cellules Tγδ par cytométrie de flux n’inhibe pas la production d’IFN-γ [ 20] (et nos résultats non publiés). En revanche, nous avons montré le rôle majeur des monocytes/macrophages dans la production d’IFN-γ par les cellules NK. Cette coopération cellulaire est dépendante de la production d’IL-18 par les macrophages. Par ailleurs, le blocage partiel de l’activation des macrophages par un anticorps anti-TLR2 (bloquant l’interaction entre les Pf-E et TLR2) ne conduit ni à une diminution de leur production d’IL-18, ni à une inhibition de la production d’IFN-γ par les cellules NK. Ces résultats suggèrent que plusieurs récepteurs sont impliqués de manière complémentaire dans l’activation des macrophages en réponse à l’infection parasitaire, et soulignent la complexité de la réponse immunitaire mise en place au tout début de l’infection. |
Conclusions et perspectives Les études décrites ci-dessus soulignent l’importance de la coopération entre les cellules NK et d’autres acteurs du système immunitaire inné. Les cellules NK ont été originellement décrites comme « armées », capables de produire une réponse effectrice rapide. Il apparaît aujourd’hui qu’une coopération cellulaire avec les DC, mais également les macrophages, est nécessaire à leur activation optimale [20, 24,
40]. En particulier, dans ce modèle d’infection par Pf, nous avons identifié le rôle majeur de la production d’IL-18 par les macrophages dans la production d’IFN-γ par les cellules NK [20]. Ces résultats viennent compléter l’importance déjà décrite de l’IL-12 dans ce système [17]. Une réponse IFN-γ précoce et adaptée est importante pour le pronostic évolutif du paludisme. La production d’IFN-γ par les cellules NK pourrait donc jouer un rôle clé dans le contrôle initial du stade sanguin de l’infection. Par ailleurs, leur sécrétion de la chimiokine IL8 en réponse aux Pf-E pourrait être impliquée dans le recrutement d’autres types cellulaires dans des lieux stratégiques. Cependant, chez l’homme comme chez la souris, une production excessive d’IFN-γ peut conduire à une immunopathologie induisant des complications sévères [4]. Il est donc tout a fait prématuré de conclure à un rôle positif ou négatif des cellules NK dans l’évolution de la maladie. De nombreuses interrogations (Figure 3) subsistent donc dans ce champ de recherche. Les fondements moléculaires de la reconnaissance directe des Pf-E par les cellules NK doivent encore ê tre identifiés. Les cellules NK, initialement décrites comme des effecteurs cytotoxiques contre des cibles tumorales ou infectées par des virus, pourraient, outre leur capacité à produire des cytokines, avoir un effet direct sur la viabilité des parasites. Cette question, qui selon les systèmes expérimentaux conduit à des conclusions contradictoires [20, 27] mérite aussi plus d’investigations.
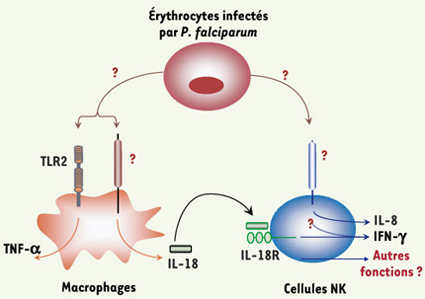
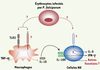 | Figure 3.
Activation des cellules NK par
Pf. Ce modèle résume les connaissances actuelles et les questions non résolues concernant l’activation des cellules NK en présence d’érythrocytes infectés par Pf. Les cellules NK sont capables de reconnaître directement des Pf-E grâce à un ou des récepteurs encore non identifiés. Cette interaction directe conduit à l’activation des cellules NK et à leur production d’IL-8. En revanche, leur production d’IFN-γ est dépendante d’une coopération avec des macrophages, notamment via la production d’IL-18 par ces derniers. L’engagement du récepteur TLR2 par des produits de Pf est partiellement impliqué dans la production de TNF-α par les macrophages, mais n’est pas nécessaire à la coopération NK/macrophages. Le ou les récepteurs impliqués dans la production d’IL-18 par les macrophages restent inconnus dans ce système expérimental. Les questions à résoudre sont représentées par des points d’interrogation : quels sont les ligands de Pf impliqués dans la reconnaissance directe des Pf-E par les cellules NK ? Quel(s) est(sont) le(s) récepteur(s) à la surface des cellules NK ? Cette reconnaissance directe NK/Pf-E est-elle requise pour la production d’IFN-γ par les cellules NK ? Quelles sont les molécules impliquées dans la production d’IL-18 par les macrophages ? Y a-t-il d’autres conséquences fonctionnelles de l’activation des cellules NK ? |
|
Footnotes |
1. Snow RW, Guerra CA, Noor AM, et al. The global distribution of clinical episodes of Plasmodium falciparum malaria. Nature 2005; 434 : 214–7 2. Kwiatkowski D, Nowak M. Periodic and chaotic host-parasite interactions in human malaria. Proc Natl Acad Sci USA 1991; 88 : 5111–3. 3. Marti M, Good RT, Rug M, et al. Targeting malaria virulence and remodeling proteins to the host erythrocyte. Science 2004; 306 : 1930–3. 4. Schofield L, Grau GE. Immunological processes in malaria pathogenesis. Nat Rev Immunol 2005; 5 : 722–35. 5. Bruce MC, Day KP. Cross-species regulation of Plasmodium parasitemia in semi-immune children from Papua New Guinea. Trends Parasitol 2003; 19 : 271–7. 6. Favre N, Ryffel B, Bordmann G, et al. The course of Plasmodium chabaudi chabaudi infections in interferon-gamma receptor deficient mice. Parasite Immunol 1997; 19 : 375–83. 7. Stevenson MM, Tam MF, Wolf SF, et al. IL-12-induced protection against blood-stage Plasmodium chabaudi AS requires IFN-gamma and TNF-alpha and occurs via a nitric oxide-dependent mechanism. J Immunol 1995; 155 : 2545–56. 8. De Souza JB, Williamson KH, Otani T, et al. Early gamma interferon responses in lethal and nonlethal murine blood-stage malaria. Infect Immun 1997; 65 : 1593–8. 9. Jacobs P, Radzioch D, Stevenson MM. A Th1-associated increase in tumor necrosis factor alpha expression in the spleen correlates with resistance to blood-stage malaria in mice. Infect Immun 1996; 64 : 535–41. 10. Luty AJ, Lell B, Schmidt-Ott R, et al. Interferon-gamma responses are associated with resistance to reinfection with Plasmodium falciparum in young African children. J Infect Dis 1999; 179 : 980–8. 11. Dodoo D, Omer FM, Todd J, et al. Absolute levels and ratios of proinflammatory and anti-inflammatory cytokine production in vitro predict clinical immunity to Plasmodium falciparum malaria. J Infect Dis 2002; 185 : 971–9. 12. Kojima S, Nagamine Y, Hayano M, et al. A potential role of interleukin 18 in severe falciparum malaria. Acta Trop 2004; 89 : 279–84. 13. Perkmann T, Winkler H, Graninger W, et al. Circulating levels of the interleukin (IL)-4 receptor and of IL-18 in patients with Plasmodium falciparum malaria. Cytokine 2005; 29 : 153–8. 14. Nagamine Y, Hayano M, Kashiwamura S, et al. Involvement of interleukin-18 in severe Plasmodium falciparum malaria. Trans R Soc Trop Med Hyg 2003; 97 : 236–41. 15. Hermsen CC, Konijnenberg Y, Mulder L, et al. Circulating concentrations of soluble granzyme A and B increase during natural and experimental Plasmodium falciparum infections. Clin Exp Immunol 2003; 132 : 467–72. 16. Scragg IG, Hensmann M, Bate CA, et al. Early cytokine induction by Plasmodium falciparum is not a classical endotoxin-like process. Eur J Immunol 1999; 29 : 2636–44. 17. Artavanis-Tsakonas K, Riley EM. Innate immune response to malaria: rapid induction of IFN-gamma from human NK cells by live Plasmodium falciparum-infected erythrocytes. J Immunol 2002; 169 : 2956–63. 18. Artavanis-Tsakonas K, Eleme K, McQueen KL, et al. Activation of a subset of human NK cells upon contact with Plasmodium falciparum-infected erythrocytes. J Immunol 2003; 171 : 5396–405. 19. Korbel DS, Newman KC, Almeida CR, et al. Heterogeneous human NK cell responses to Plasmodium falciparum-infected erythrocytes. J Immunol 2005; 175 : 7466–73. 20. Baratin M, Roetynck S, Lepolard C, et al. Natural killer cell and macrophage cooperation in MyD88-dependent innate responses to Plasmodium falciparum. Proc Natl Acad Sci USA 2005; 102 : 14747–52. 21. Ferlazzo G, Munz C. NK cell compartments and their activation by dendritic cells. J Immunol 2004; 172 : 1333–9. 22. Stewart CA, Vivier E, Colonna M. Strategies of natural killer cell recognition and signaling. Curr Top Microbiol Immunol 2006; 298 : 1–21. 23. Imai K, Matsuyama S, Miyake S, et al. Natural cytotoxic activity of peripheral-blood lymphocytes and cancer incidence: an 11-year follow-up study of a general population. Lancet 2000; 356 : 1795–9. 24. Zitvogel L, Terme M, Borg C, et al. Dendritic cell-NK cell cross-talk: regulation and physiopathology. Curr Top Microbiol Immunol 2006; 298 : 157–74. 25. Bottino C, Moretta L, Moretta A. NK cell activating receptors and tumor recognition in humans. Curr Top Microbiol Immunol 2006; 298 : 175–82. 26. Orago AS, Facer CA. Cytotoxicity of human natural killer (NK) cell subsets for Plasmodium falciparum erythrocytic schizonts: stimulation by cytokines and inhibition by neomycin. Clin Exp Immunol 1991; 86 : 22–9. 27. Mavoungou E, Luty AJ, Kremsner PG. Natural killer (NK) cell-mediated cytolysis of Plasmodium falciparum-infected human red blood cells in vitro. Eur Cytokine Netw 2003; 14 : 134–42. 28. Rubio V, Stuge TB, Singh N, et al.
Ex vivo identification, isolation and analysis of tumor-cytolytic T cells. Nat Med 2003; 9 : 1377–82. 29. Alter G, Malenfant JM, Altfeld M. CD107a as a functional marker for the identification of natural killer cell activity. J Immunol Methods 2004; 294 : 15–22. 30. Cooper MA, Fehniger TA, Caligiuri MA. The biology of human natural killer-cell subsets. Trends Immunol 2001; 22 : 633–40. 31. Stevenson MM, Riley EM. Innate immunity to malaria. Nat Rev Immunol 2004; 4 : 169–80. 32. Pichyangkul S, Yongvanitchit K, Kum-arb U, et al. Malaria blood stage parasites activate human plasmacytoid dendritic cells and murine dendritic cells through a Toll-like receptor 9-dependent pathway. J Immunol 2004; 172 : 4926–33. 33. Urban BC, Ing R, Stevenson MM. Early interactions between blood-stage plasmodium parasites and the immune system. Curr Top Microbiol Immunol 2005; 297 : 25–70. 34. Stevenson MM, Urban BC. Antigen presentation and dendritic cell biology in malaria. Parasite Immunol 2006; 28 : 5–14. 35. Behr C, Poupot R, Peyrat MA, et al.
Plasmodium falciparum stimuli for human gammadelta T cells are related to phosphorylated antigens of mycobacteria. Infect Immun 1996; 64 : 2892–6. 36. Fournie JJ, Bonneville M. Stimulation of gamma delta T cells by phosphoantigens. Res Immunol 1996; 147 : 338–47. 37. Farouk SE, Mincheva-Nilsson L, Krensky AM, et al. Gamma delta T cells inhibit in vitro growth of the asexual blood stages of Plasmodium falciparum by a granule exocytosis-dependent cytotoxic pathway that requires granulysin. Eur J Immunol 2004; 34 : 2248–56. 38. Krishnegowda G, Hajjar AM, Zhu J, et al. Induction of proinflammatory responses in macrophages by the glycosylphosphatidylinositols of Plasmodium falciparum: cell signaling receptors, glycosylphosphatidylinositol (GPI) structural requirement, and regulation of GPI activity. J Biol Chem 2005; 280 : 8606–16. 39. Zhu J, Krishnegowda G, Gowda DC. Induction of proinflammatory responses in macrophages by the glycosylphosphatidylinositols of Plasmodium falciparum: the requirement of extracellular signal-regulated kinase, p38, c-jun n-terminal kinase and nf-{kappa}b pathways for the expression of proinflammatory cytokines and nitric oxide. J Biol Chem 2005; 280 : 8617–27. 40. Moretta A. The dialogue between human natural killer cells and dendritic cells. Curr Opin Immunol 2005; 17 : 306–11. |