| |
| Med Sci (Paris). 2006 April; 22(4): 381–388. Published online 2006 April 15. doi: 10.1051/medsci/2006224381.Régulation du métabolisme énergétique par l’AMPK Une nouvelle voie thérapeutique pour le traitement des maladies métaboliques et cardiaques Marc Foretz,1 Nellie Taleux,2 Bruno Guigas,2 Sandrine Horman,2 Christophe Beauloye,3 Fabrizio Andreelli,4 Luc Bertrand,3 and Benoît Viollet1* 1Inserm U567, CNRS URM8104, Université Paris5, Institut Cochin, Département Endocrinologie, Métabolisme et Cancer, 24, rue du Faubourg Saint-Jacques, 75014 Paris, France 2Unité Hormones et Métabolisme, Institut Christian de Duve de Pathologie Cellulaire (ICP), Université catholique de Louvain 7529, avenue Hippocrate 75, 1200 Bruxelles, Belgique 3Unité de Pathologie Cardio-Vasculaire, École de Médecine, Université catholique de Louvain, CARD 5550, avenue Hippocrate 55, 1200 Bruxelles, Belgique 4Service d’Endocrinologie, Diabétologie, Maladies Métaboliques, Hôpital Bichat-Claude Bernard, 16, rue Henri Huchard, 75877 Paris Cedex 18, France |
L’AMPK (AMP-activated protein kinase) a été, pour la première fois, caractérisée en 1975 comme étant la protéine kinase phosphorylant et inhibant la 3-hydroxy-3-méthylglutaryl-coenzyme A réductase, une enzyme impliquée dans la synthèse du cholestérol. Puis, en 1980, une protéine kinase également dépendante de l’AMP et inhibant l’acétyl-CoA carboxylase (ACC), enzyme contrôlant la synthèse des acides gras, a été découverte. Ce n’est, cependant, qu’en 1987 que l’AMPK est formellement identifiée comme étant l’unique enzyme responsable de l’inhibition conjointe de la synthèse du cholestérol et des acides gras. Grâce à son clonage en 1994, les rôles de l’AMPK ont pu être mieux définis. L’AMPK est alors apparue comme un senseur métabolique incontournable permettant l’ajustement précis des besoins et disponibilités énergétiques cellulaires. |
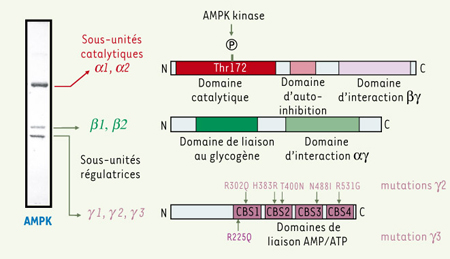
Structure et régulation de l’AMPK L’AMPK existe sous la forme d’un complexe hétérotrimérique composé d’une sous-unité catalytique (α) et de deux sous-unités régulatrices (β et γ), chacune représentée par différentes isoformes (α1, α2, β1, β2, γ1, γ2 et γ3) codées par des gènes distincts (Figure 1). Ainsi, il est théoriquement possible de réaliser 12 combinaisons hétérotrimériques αβγ différentes dont les fonctions dépendront des isoformes présentes dans les complexes formés. Les variations des profils d’expression tissulaire, de la localisation subcellulaire et de la sensibilité à l’AMP des différents hétérotrimères αβγ, apportent une complexité supplémentaire dans la compréhension du mode d’action et du rôle physiologique de l’AMPK [
1,
2]. Bien que les rôles spécifiques joués par ces différents complexes soient encore peu connus, il est aisé d’imaginer l’existence de propriétés tissus spécifiques. Ainsi, la représentation majoritaire de l’hétérotrimère α2β2γ3 dans le muscle squelettique humain [
3,
4] renforce l’idée d’une action physiologique spécialisée des hétérotrimères AMPK au niveau de voies métaboliques spécifiques dans ce tissu. La sous-unité catalytique α contient le domaine kinase dans sa région aminoterminale, suivi d’un domaine d’auto-inhibition actif uniquement en absence d’AMP et d’un domaine d’interaction avec les sous-unités β et γ. On retrouve une forte expression de l’isoforme α1 dans le rein, le poumon et le tissu adipeux alors que l’isoforme α2 est exprimée principalement dans le cœur et le muscle squelettique. La localisation à la fois cytoplasmique et nucléaire de l’isoforme α2 permet de contrôler directement l’expression d’un certain nombre de gènes par la phosphorylation de facteurs de transcription [
5,
8] (Figure 2B). La sous-unité β contient également un domaine d’interaction protéine-protéine qui permet la liaison des sous-unités α et γ, permettant ainsi la formation du complexe enzymatique hétérotrimérique. Cette sous-unité contient aussi un domaine de liaison au glycogène dont la fonction physiologique reste encore à élucider [
9,
10]. La sous-unité γ possède une répétition de quatre motifs CBS (cystathionine-β-synthase) formant un site allostérique pour la liaison de l’AMP et de l’ATP avec des affinités qui diffèrent pour chacune de ses isoformes [1]. L’importance des domaines CBS a été mise en évidence par la découverte des conséquences induites par différentes mutations de la sous-unité γ. Ainsi, une mutation, chez le porc, de la sous-unité γ3, isoforme d’expression restreinte au muscle squelettique [1], entraîne une augmentation du glycogène au niveau musculaire ayant une influence néfaste sur la qualité de la viande alors que des mutations de la sous-unité γ2 chez l’homme (Figure 1) sont associées à une accumulation de glycogène dans le cœur provoquant un trouble de conduction cardiaque, le syndrome de Wolff-Parkinson-White [
11]. 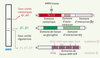 | Figure 1.
Structure du complexe AMPK. Le profil de migration en gel d’électrophorèse dénaturant du complexe AMPK purifié à partir de foie de rat est présenté à gauche de la figure. L’AMPK est une enzyme hétérotrimérique comprenant une sous-unité catalytique α et deux sous-unités régulatrices β et γ qui sont indiquées sur le coté du gel d’électrophorèse. Chez les mammifères, il existe deux isoformes pour les sous-unités α (α1, α2) et β (β1, β2), et trois isoformes pour la sous-unité γ (γ1, γ2 et γ3) de telle sorte qu’il est possible de réaliser 12 combinaisons αβγ différentes dans chaque tissu de l’organisme. La structure des sous-unités α, β et γ est représentée schématiquement dans la partie droite de la figure. La sous-unité catalytique α contient dans sa région aminoterminale le domaine kinase ainsi que le site de phosphorylation (Thr172) par l’AMPK kinase suivi d’un domaine d’auto-inhibition et d’un domaine d’interaction avec les sous-unités β et γ. La sous-unité β contient un domaine de liaison au glycogène et un domaine d’interaction protéine-protéine permettant la formation du complexe enzymatique hétérotrimérique par la liaison des sous-unités α et γ. La sous-unité γ possède une répétition de quatre motifs CBS (cystathionine-β-synthase) impliqués dans la liaison de l’AMP et de l’ATP. La localisation de cinq mutations de la sous-unité γ2 identifiées chez l’homme qui ont été associées à une accumulation de glycogène dans le cœur (syndrome de Wolff-Parkinson-White) et de la mutation de la sous-unité γ3 entraînant une augmentation du glycogène au niveau musculaire chez le porc est indiquée par des flèches. |
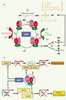 | Figure 2.
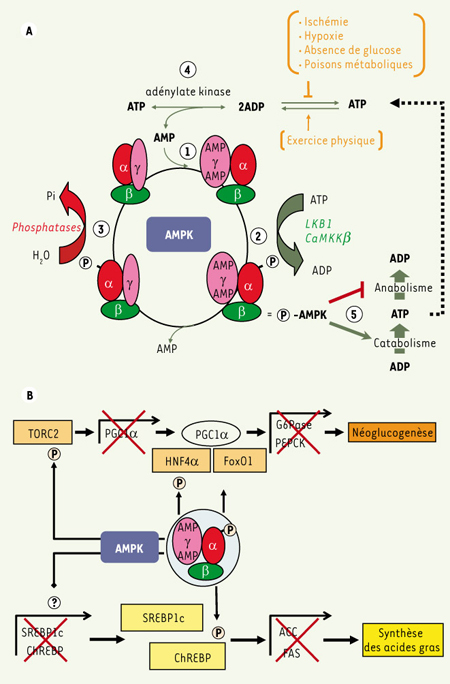
Régulation et activation de l’AMPK. A. Les changements de concentration en AMP et ATP sont les principaux régulateurs de l’activité de l’AMPK. L’AMPK est activée de façon allostérique par l’AMP et inhibée par l’ATP par compétition pour un même site de fixation sur la sous-unité régulatrice γ de l’AMPK (point ➀). La liaison de l’AMP favorise la phosphorylation de la sous-unité catalytique α par les AMPK kinases (LKB1 et CaMMKβ) (point ➁), essentielle pour assurer l’activation de l’AMPK, et empêche également sa déphosphorylation par les protéines phosphatases (point ➂). C’est l’augmentation du rapport AMP/ATP qui détermine l’activation de l’AMPK en réponse aux épisodes de stress énergétique comme l’absence de glucose, l’exercice physique, l’ischémie ou l’hypoxie. Lorsque la balance énergétique cellulaire est perturbée, les rapports ATP/ADP et ATP/AMP sont alors automatiquement modifiés par l’intervention de l’adénylate kinase (point ➃). Une fois activée, l’AMPK favorise les réactions métaboliques génératrices d’ATP et réduit les voies anaboliques consommatrices d’ATP (point ➄). B. Régulation transcriptionnelle des gènes de la lipogenèse et de la néoglucogenèse par l’AMPK. L’activation de l’AMPK inhibe l’expression des gènes codant le co-activateur PGC1α en phosphorylant le coactivateur TORC2, empêchant son accumulation nucléaire. L’inhibition de la transcription des facteurs SREBP1c et ChREBP est réalisée par un mécanisme encore inconnu. L’AMPK phosphoryle également les facteurs de transcription ChREBP et HNF4α, bloquant leur accumulation nucléaire ou provoquant leur dégradation protéolytique. |
L’activité du complexe hétérotrimérique de l’AMPK est contrôlée de manière extrêmement sensible en réponse à de faibles variations des concentrations en nucléotides intracellulaires et plus particulièrement de l’AMP. La régulation de l’activité AMPK par l’AMP est complexe car elle implique différents niveaux de régulation (Figure 2A). Tout d’abord, l’activité de l’AMPK est modulée de façon allostérique par l’AMP (stimulation) et l’ATP (inhibition) de manière compétitive (Figure 2A, point ➀). En effet, ces nucléotides se fixent sur le même site de fixation formé par les domaines CBS de la sous-unité γ. De plus, la liaison de l’AMP favorise la phosphorylation de l’AMPK au niveau de son résidu Thr172 localisé dans la boucle d’activation du domaine catalytique (Figure 1 et Figure 2A, point ➁). Cette phosphorylation est essentielle pour assurer l’activation de l’AMPK. La liaison de l’AMP protège également l’AMPK d’une déphosphorylation par les protéines phosphatases (Figure 2A, point ➂). Deux protéines kinases capables de phosphoryler et d’activer l’AMPK ont été récemment identifiées : il s’agit de la protéine kinase suppresseur de tumeur LKB1 [
12–
14] et de la protéine kinase CaMKKb [
15,
16]. Étrangement, dans la cellule, LKB1 ne répond pas aux variations du rapport AMP/ATP et semble être constitutivement active. C’est, en fait, la liaison de l’AMP au complexe AMPK qui permettrait d’expliquer l’activation de l’AMPK par LKB1, en modifiant la structure de l’AMPK et en permettant l’accessibilité du résidu Thr172 à LKB1. Le mécanisme d’activation de l’AMPK par la CaMKKβ, ainsi que son implication potentielle dans des phénomènes physiopathologiques, restent encore à éclaircir. |
Rôle physiologique de l’AMPK Chez les mammifères, les cellules doivent maintenir une balance énergétique positive et stable, caractérisée par un rapport ATP/ADP élevé (ratio 10/1). Lorsque cette balance énergétique est perturbée par un facteur environnemental, la production d’ATP chute. Le rapport ATP/ADP ainsi que le rapport ATP/AMP sont alors automatiquement modifiés par l’intervention de l’adénylate kinase (Figure 2A, point ➃). C’est l’augmentation du rapport AMP/ATP qui détermine l’activation de l’AMPK en réponse aux épisodes de stress énergétique comme l’absence de glucose, l’exercice physique, l’ischémie ou l’hypoxie. Une fois activée, l’AMPK participe au maintien de l’homéostasie énergétique cellulaire en contrôlant, à court terme, l’activité de certaines enzymes et à long terme, l’expression de certains gènes, la plupart impliqués dans le métabolisme énergétique [
17,
19]. Ainsi, afin de réajuster la balance énergétique cellulaire, l’activation de l’AMPK stimule des voies cataboliques impliquées dans la synthèse d’ATP (oxydation des acides gras, glycolyse) et inhibe des voies anaboliques ou consommatrices d’ATP (synthèse des protéines, de cholestérol et des acides gras) (Figure 2A, point ➄). Ce système senseur du métabolisme énergétique constitue un mécanisme de survie cellulaire hautement conservé chez les eucaryotes, son apparition remontant à un milliard d’années. De nombreux orthologues de l’AMPK sont en effet retrouvés, entre autres, chez la mouche, le nématode, la levure ou les plantes. Chez la levure Saccharomyces cerevisiae, la perte d’activité AMPK (SNF1) provoque, par exemple, l’incapacité de croissance en absence de glucose et, chez la mousse Physcomitrella patens, l’AMPK contrôle les changements métaboliques imposés au cours de la transition entre les périodes de lumière et d’obscurité. |
Contrôle du métabolisme du glucose et des lipides par l’AMPK L’AMPK joue un rôle important dans le contrôle du métabolisme lipidique en phosphorylant et inactivant l’ACC. L’ACC catalyse la transformation de l’acétyl-CoA en malonyl-CoA ce qui, dans le foie et le tissu adipeux, constitue la première réaction de la biosynthèse des acides gras. En inactivant l’ACC, l’AMPK est donc responsable d’une inhibition de la synthèse des acides gras dans ces tissus lipogéniques. L’AMPK a également un effet de régulation à long terme sur la transcription des gènes de la lipogenèse, ACC et synthase des acides gras [19], en inhibant l’expression et l’activité des facteurs de transcription SREBP1c (sterol regulatory element binding protein 1c) [19,
20] et ChREBP (carbohydrate response element binding protein) [5, 19] (Figure 2B). En outre, dans le foie mais également dans les muscles striés (squelettiques et myocardiques), le malonyl-CoA produit par l’ACC joue le rôle d’élément régulateur : il bloque, en effet, le transport des acides gras du cytosol vers la mitochondrie en inhibant la carnitine-palmitoyl transférase-1 (CPT-1). Dans ces tissus, l’activation de l’AMPK entraîne donc une diminution de la concentration cytosolique de malonyl-CoA, facilitant ainsi la pénétration des acides gras dans la mitochondrie et leur oxydation. Par ce mécanisme, il a été récemment démontré que la leptine et l’adiponectine, deux adipokines sécrétées par le tissu adipeux, stimulent l’oxydation des acides gras dans le foie et le muscle squelettique secondairement à une activation de l’AMPK dans ces tissus [
21,
23]. L’effet de déplétion lipidique obtenu dans ces tissus permet alors l’amélioration des paramètres métaboliques dans différents modèles de rongeurs insulinorésistants. En effet, l’accumulation des triglycérides dans le foie et le muscle squelettique participe à la physiopathologie de l’insulinorésistance chez l’homme et l’animal, alors que la déplétion lipidique de ces tissus améliore la sensibilité à l’insuline (concept de lipotoxicité). On voit donc tout l’intérêt métabolique que peut avoir une activation de l’AMPK et la réduction de la lipotoxicité qui l’accompagne. Ainsi, l’activation de l’AMPK par un agent pharmacologique, l’AICAR (5-aminoimidazole-4-carboxamide-1-β-ribofuranoside), entraînant une augmentation intracellulaire de ZMP, un analogue non métabolisable de l’AMP, améliore les paramètres métaboliques de rongeurs insulinorésistants en favorisant la déplétion lipidique des tissus [
24]. Par ailleurs, il a été récemment démontré que l’AMPK favorise la biogenèse mitochondriale musculaire par activation du facteur de transcription PGC-1α (peroxisome proliferator-activated receptor γ coactivator-1α), ce qui permet d’optimiser l’oxydation des substrats [
25]. L’AMPK participe également à la régulation du métabolisme glucidique. Ainsi, l’activation de l’AMPK favorise le transport insulino-indépendant du glucose dans le muscle squelettique et le cœur [
26,
27]. Une fois capté dans le muscle squelettique, le glucose est immédiatement oxydé plutôt que stocké sous forme de glycogène, réaction coûteuse en énergie, via l’inhibition de la glycogène synthase par l’AMPK [
28]. Dans le muscle cardiaque, l’AMPK stimule la glycolyse par un mécanisme faisant intervenir la 6-phosphofructo-2 kinase (PFK-2) [
29]. L’AMPK phosphoryle et active la PFK-2, entraînant une augmentation du fructose-2,6-bisphosphate intracellulaire, un puissant stimulateur allostérique de la PFK-1, enzyme clé de la glycolyse. D’autre part, il a été démontré que l’activation de l’AMPK hépatique par l’AICAR ou l’adiponectine réprime l’expression des principaux gènes impliqués dans la néoglucogenèse, glucose-6-phosphatase (G6Pase) et phosphoénolpyruvate carboxykinase (PEPCK), et inhibe la production hépatique de glucose [19,
22,
30]. Cela a également été montré en utilisant une forme constitutivement active de l’AMPK d’expression exclusivement hépatique. En effet, une activation spécifique de l’AMPK dans le foie, en réduisant l’expression des gènes clés de la néoglucogenèse, est suffisante pour normaliser la glycémie de souris ob/ob et de souris rendues diabétiques par la streptozotocine [19]. Le modèle actuel de régulation transcriptionnelle des gènes de la néoglucogenèse par l’AMPK implique l’inhibition de la translocation nucléaire du co-activateur TORC2 (transducer of regulated cyclic-AMP response element binding activator 2) et, en conséquence, de l’expression du co-activateur PGC-1α [
6] (Figure 2B). PGC-1α est un co-activateur essentiel à l’activation des gènes de la néoglucogenèse (G6Pase, PEPCK) par l’intermédiaire des facteurs de transcription HNF4α (hepatocyte nuclear factor 4α) et FoxO1 (forkhead box transcription factor O1). L’inhibition transcriptionnelle des gènes de la néoglucogenèse peut être également réalisée par la phosphorylation par l’AMPK des facteurs de transcription HNF4α et FoxO1, provoquant ainsi leur dégradation protéolytique [
7, 8,
18] (Figure 2B). Une autre stratégie pour étudier les effets métaboliques de l’AMPK consiste à créer des modèles murins déficients en AMPK. La délétion de l’isoforme α2 de l’AMPK provoque une insulinorésistance, une intolérance au glucose, une hypertriglycéridémie et une sensibilité accrue aux effets délétères d’un régime riche en lipides [
31,
32], c’est-à-dire un phénotype équivalent au syndrome métabolique chez l’homme. Cela est intéressant à plus d’un titre : d’une part, il est confirmé que l’AMPK joue un rôle crucial dans la régulation métabolique et pondérale ; d’autre part, l’AMPK pourrait être un nouveau gène candidat associé au syndrome métabolique chez l’homme. Avec l’ensemble de ces données, on peut logiquement imaginer qu’une activation pharmacologique de l’AMPK pourrait être une nouvelle voie thérapeutique dans la prise en charge de l’insulinorésistance et du diabète insulino-indépendant. Les mécanismes d’action de l’AMPK expliquent d’ailleurs, en partie, les effets métaboliques bénéfiques chez l’homme de deux familles d’anti-diabétiques, les biguanides (metformine et phenformine) et les thiazolidinediones (rosiglitazone), qui activent chacune l’AMPK [20,
33]. |
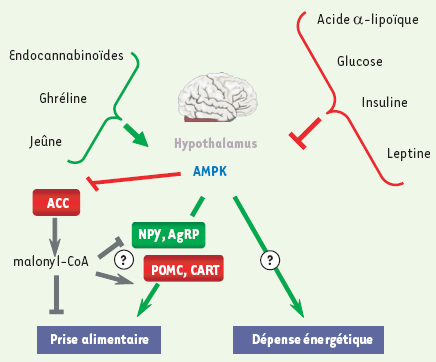
Régulation de la prise alimentaire Outre son rôle de détecteur de l’état énergétique cellulaire, l’AMPK pourrait être également impliquée dans le contrôle central de la satiété au niveau de l’hypothalamus (Figure 3), une région du cerveau jouant un rôle central dans l’homéostasie énergétique de l’organisme en régulant la prise alimentaire et la dépense énergétique. Il a ainsi été récemment montré que l’activité de l’AMPK hypothalamique varie avec le statut nutritionnel, l’AMPK étant activée à jeun et inhibée en période de satiété [
34]. Un parallèle intéressant a également été mis en évidence entre le niveau d’activité de l’AMPK hypothalamique et la prise alimentaire en réponse à différentes hormones ou métabolites connus pour être modulés par l’état nutritionnel : la ghréline et les endocannabinoïdes activent l’AMPK et induisent la prise alimentaire alors que l’insuline, le glucose et la leptine agissent de manière opposée [34–
36]. Plusieurs résultats montrent également que des variations du statut énergétique de l’hypothalamus sont capables de moduler directement l’activité AMPK. Ainsi, une déplétion en ATP causée par le 2-désoxyglucose (analogue non métabolisable du glucose) active l’AMPK et la prise alimentaire alors qu’une augmentation de l’état énergétique due à l’injection intrahypothalamique de C75 (inhibiteur de la synthèse des acides gras) ou d’acide α-lipoïque (acide gras à chaîne courte) inhibe l’AMPK et la prise alimentaire [
37,
38]. De même, la surexpression hypothalamique d’une forme constitutivement active de l’AMPK chez la souris conduit à une augmentation sensible de sa prise alimentaire alors que l’expression d’une forme inactive de l’AMPK ou l’injection intra-hypothalamique de composé C, un inhibiteur de l’AMPK, a un effet inverse [34, 37, 38]. L’ensemble de ces résultats montre que l’AMPK hypothalamique constitue une cible commune à de nombreux facteurs affectant le comportement alimentaire. En revanche, les voies de signalisation par lesquelles l’AMPK contrôle la prise alimentaire, notamment via l’expression des neuropeptides orexigéniques NPY (neuropeptide Y) et AgRP (agouti related protein) et anorexigéniques POMC (proopiomélanocortine) et CART (cocaine- and amphetamine-regulated transcript), restent encore mal connues. La mise en évidence d’une hyperphagie couplée à une activation de l’AMPK hypothalamique chez des souris rendues diabétiques par injection de streptozotocine [
39] conforte également l’idée que l’AMPK pourrait constituer une cible thérapeutique intéressante pour la prise en charge des troubles du comportement alimentaire. Néanmoins, il faut souligner que l’AMPK est régulée de façon différente dans l’hypothalamus et les tissus périphériques. Par exemple, la leptine active l’AMPK dans le muscle squelettique et l’inhibe dans l’hypothalamus, ce qui suggère que les mécanismes de régulation impliqués sont différents. Ainsi, sauf à pouvoir délivrer localement des concentrations thérapeutiques déterminées, l’utilisation d’inhibiteurs pharmacologiques de l’AMPK pour réduire la prise alimentaire pourrait se révéler difficile en raison de leurs effets préjudiciables attendus sur le métabolisme énergétique des tissus périphériques. 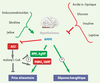 | Figure 3.
Régulation de l’activité de l’AMPK hypothalamique par les signaux hormonaux et nutritionnels. L’hypothalamus joue un rôle central dans l’homéostasie énergétique de l’organisme en contrôlant à la fois la prise alimentaire et la dépense énergétique. Des neurones hypothalamiques intègrent de nombreux signaux hormonaux et nutritionnels et induisent un changement du comportement alimentaire et métabolique. Le réseau de signalisation intégrant ces régulations est complexe et des études récentes ont accordé à l’AMPK hypothalamique une place centrale dans le contrôle de la prise alimentaire. En effet, l’activité de l’AMPK hypothalamique varie avec le statut nutritionnel : le jeûne active l’AMPK alors que la prise alimentaire l’inhibe. Parmi les nombreux facteurs circulants qui varient au cours du cycle nutritionnel, l’insuline, le glucose et la leptine sont connus comme étant des inhibiteurs puissants de la prise alimentaire et également de l’activité de l’AMPK hypothalamique. La ghréline et les endocannabinoïdes ont des effets opposés. Plusieurs travaux suggèrent que le malonyl-CoA est un médiateur clé en aval de l’AMPK dans le contrôle de la prise alimentaire. L’activation de l’AMPK induit une baisse de l’activité de l’ACC qui, en conséquence, diminue l’accumulation de malonyl-CoA intra-hypothalamique. Cette réduction de malonyl-CoA hypothalamique influence probablement la prise alimentaire par la régulation de l’expression des neuropeptides orexigéniques (NPY, AgRP) et anorexigéniques (POMC, CART). |
|
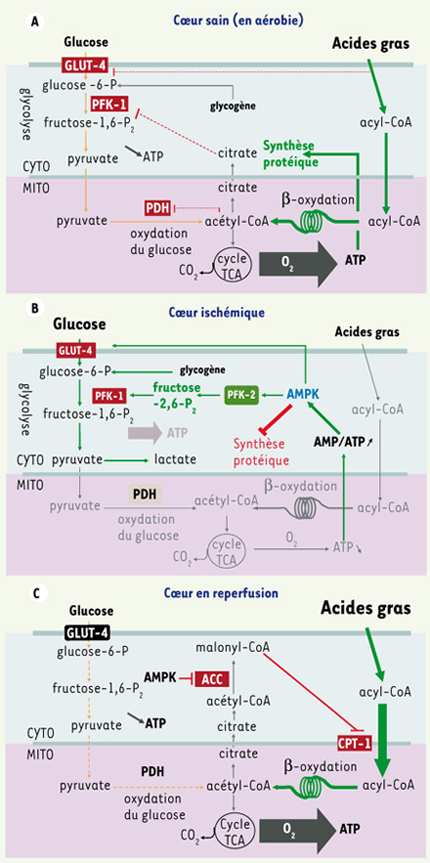
Contrôle du métabolisme myocardique par l’AMPK Le cœur doit produire quotidiennement près de 35 kg d’ATP pour assurer son activité contractile et son rôle de pompe. Il tire son énergie de l’oxydation de substrats comme les acides gras et le glucose (Figure 4A). Pour cela, un apport continu en oxygène est fourni par les artères coronaires. Le rétrécissement ou l’occlusion d’une artère coronaire produit une diminution de la perfusion du myocarde (ischémie) et par conséquent une réduction de l’apport en substrat et en oxygène. En l’absence d’oxygène, le métabolisme oxydatif cesse et la glycolyse devient la seule voie métabolique susceptible de produire de l’ATP (Figure 4B). L’énergie est produite à partir du glucose exogène mais aussi à partir de la dégradation du glycogène (glycogénolyse). Face à cette situation de stress métabolique, la glycolyse est stimulée, permettant de fournir un minimum d’énergie pour maintenir la survie cellulaire. L’AMPK joue un rôle clé dans cette stimulation. D’une part, l’activation de l’AMPK entraîne une translocation du transporteur de glucose GLUT-4 au niveau de la membrane plasmique facilitant la pénétration du glucose dans le cardiomyocyte par un mécanisme indirect et encore inconnu [27]. D’autre part, l’AMPK phosphoryle et active la PFK-2, entraînant une augmentation du fructose-2,6-bisphosphate intracellulaire, un puissant stimulateur allostérique de la PFK-1 [29]. De plus, les voies anaboliques consommatrices d’énergie sont inhibées au cours de l’ischémie. Ainsi, la synthèse des protéines (responsable de 30 % de la consommation d’ATP en métabolisme basal) est réduite par phosphorylation et inhibition du facteur d’élongation eEF-2 par l’AMPK, rendant impossible l’élongation des chaînes peptidiques. Lorsque la perfusion myocardique est rétablie, le métabolisme oxydatif est à nouveau possible et l’oxydation des acides gras devient la source principale d’énergie fournissant de 80 % à 90 % de la production d’ATP. Le mécanisme moléculaire proposé fait, une fois de plus, intervenir l’AMPK par son action sur l’ACC, facilitant la pénétration des acides gras dans la mitochondrie et donc leur oxydation (Figure 4C). Il a été en effet démontré que l’AMPK reste active au cours des premiers moments de la reperfusion et que cela provoque une inhibition de l’ACC, une diminution de la concentration en malonyl-CoA et donc une augmentation de l’oxydation des acides gras [
40].
 | Figure 4.
Contrôle du métabolisme énergétique dans le cœur. A. La production d’ATP par le cœur sain est assurée en condition d’aérobie par l’oxydation de différents substrats comme les acides gras et le glucose, le substrat préférentiel étant les acides gras (70 %) dont la voie métabolique d’oxydation inhibe celle du glucose (cycle de Randle). B. Lorsque l’ischémie myocardique survient, la glycolyse devient la seule voie métabolique susceptible de produire de l’ATP. L’AMPK joue un rôle crucial dans cette situation en réponse à l’augmentation du rapport AMP/ATP. L’AMPK augmente le transport de glucose dans le myocarde ischémique en favorisant la translocation du transport de glucose GLUT-4, phosphoryle et active la PFK-2, entraînant une augmentation du fructose-2,6-bisphosphate intracellulaire, un puissant stimulateur allostérique de la PFK-1, ce qui stimule la glycolyse. L’activation de l’AMPK a donc un effet favorable sur la viabilité des cellules myocardiques situées dans le territoire ischémique. C. Lorsque la perfusion myocardique est rétablie, l’oxydation des acides gras redevient la source principale d’énergie (80-90 %) et fait intervenir l’AMPK par la phosphorylation et l’inactivation de l’ACC, favorisant la synthèse de malonyl-CoA et l’entrée puis l’oxydation des acides gras dans la mitochondrie (MITO). CYTO : cytoplasme. |
L’importance de l’AMPK dans la protection métabolique du cœur ischémique a été bien démontrée grâce à l’utilisation de modèles murins d’invalidation génique ou de transgenèse. L’isoforme α2 de l’AMPK est essentielle pour la protection métabolique : les cœurs isolés perfusés de souris AMPKα2−/−
développent une contracture de manière plus précoce et plus importante lorsqu’ils sont soumis à un épisode ischémique. Celle-ci est le résultat d’une chute plus rapide d’ATP. La surexpression cardiaque d’une forme dominante négative de l’AMPK inhibe l’activation de l’AMPK, la stimulation de la glycolyse et la production de lactate au cours de l’ischémie et entraîne une aggravation des lésions ischémiques (mort cellulaire) [
41,
42]. Récemment, l’AMPK a été impliquée dans les effets cardioprotecteurs de l’adiponectine en inhibant l’apoptose des cardiomyocytes [
43]. |
Un grand nombre d’effets métaboliques favorables apportés par l’action des adipokines, leptine et adiponectine, ou de composés pharmacologiques sont dépendants d’une activation de l’AMPK. Ainsi, par ses multiples actions tissulaires sur le métabolisme énergétique, l’AMPK apparaît comme une cible thérapeutique de choix pour la prise en charge des maladies métaboliques (diabète, insulinorésistance, obésité) et de pathologies cardiaques (ischémie cardiaque, complications liées au diabète). |
Nos travaux ont été financés par l’Institut National de la Santé et de la Recherche Médicale (Inserm), le Ministère de la Recherche, la Région Rhône-Alpes (programme EURODOC), l’Institut Benjamin Delessert, GlaxoSmithKline, le Fond National de la Recherche Scientifique (FNRS) Belge, la bourse post-doctorale « Michel de Visscher » et la Commission des Communautés Européennes (QLG1-CT-2001-01488, AMPDIAMET et LSHM-CT-2004-005272, EXGENESIS).
|
Footnotes |
1. Cheung PC, Salt IP, Davies SP, et al. Characterization of AMP-activated protein kinase gamma-subunit isoforms and their role in AMP binding. Biochem J 2000; 346 : 659–69. 2. Salt I, Celler JW, Hawley SA, et al. AMP-activated protein kinase : greater AMP dependence, and preferential nuclear localization, of complexes containing the alpha2 isoform. Biochem J 1998; 334 : 177–87. 3. Mahlapuu M, Johansson C, Lindgren K, et al. Expression profiling of the gamma-subunit isoforms of AMP-activated protein kinase suggests a major role for gamma3 in white skeletal muscle. Am J Physiol Endocrinol Metab 2004; 286 : E194–200. 4. Wojtaszewski JF, Birk JB, Frosig C, et al. 5’AMP activated protein kinase expression in human skeletal muscle : effects of strength training and type 2 diabetes. J Physiol 2005; 564 : 563–73. 5. Kawaguchi T, Osatomi K, Yamashita H, et al. Mechanism for fatty acid “sparing” effect on glucose-induced transcription : regulation of carbohydrate-responsive element-binding protein by AMP-activated protein kinase. J Biol Chem 2002; 277 : 3829–35. 6. Koo SH, Flechner L, Qi L, et al. The CREB coactivator TORC2 is a key regulator of fasting glucose metabolism. Nature 2005; 437 : 1109–11. 7. Hong YH, Varanasi US, Yang W, Leff T. AMP-activated protein kinase regulates HNF4alpha transcriptional activity by inhibiting dimer formation and decreasing protein stability. J Biol Chem 2003; 278 : 27495–501. 8. Barthel A, Schmoll D, Kruger KD, et al. Regulation of the forkhead transcription factor FKHR (FOXO1a) by glucose starvation and AICAR, an activator of AMP-activated protein kinase. Endocrinology 2002; 143 : 3183–6. 9. Hudson ER, Pan DA, James J, et al. A novel domain in AMP-activated protein kinase causes glycogen storage bodies similar to those seen in hereditary cardiac arrhythmias. Curr Biol 2003; 13 : 861–6. 10. Polekhina G, Gupta A, Michell BJ, et al. AMPK beta subunit targets metabolic stress sensing to glycogen. Curr Biol 2003; 13 : 867–71. 11. Scott JW, Hawley SA, Green KA, et al. CBS domains form energy-sensing modules whose binding of adenosine ligands is disrupted by disease mutations. J Clin Invest 2004; 113 : 274–84. 12. Woods A, Johnstone SR, Dickerson K, et al. LKB1 is the upstream kinase in the AMP-activated protein kinase cascade. Curr Biol 2003; 13 : 2004–8. 13. Hawley SA, Boudeau J, Reid JL, et al. Complexes between the LKB1 tumor suppressor, STRAD alpha/beta and MO25 alpha/beta are upstream kinases in the AMP-activated protein kinase cascade. J Biol 2003; 2 : 28. 14. Shaw RJ, Kosmatka M, Bardeesy N, et al. The tumor suppressor LKB1 kinase directly activates AMP-activated kinase and regulates apoptosis in response to energy stress. Proc Natl Acad Sci USA 2004; 101 : 3329–35. 15. Woods A, Dickerson K, Heath R, et al. C(Ca2+)/calmodulin-dependent protein kinase kinase-beta acts upstream of AMP-activated protein kinase in mammalian cells. Cell Metab 2005; 2 : 21–33. 16. Hawley SA, Pan DA, Mustard KJ, et al. Calmodulin-dependent protein kinase kinase-beta is an alternative upstream kinase for AMP-activated protein kinase. Cell Metab 2005; 2 : 9–19. 17. Foretz M, Carling D, Guichard C, et al. AMP-activated protein kinase inhibits the glucose-activated expression of fatty acid synthase gene in rat hepatocytes. J Biol Chem 1998; 273 : 14767–71. 18. Leclerc I, Lenzner C, Gourdon L, et al. Hepatocyte nuclear factor-4alpha involved in type 1 maturity-onset diabetes of the young is a novel target of AMP-activated protein kinase. Diabetes 2001; 50 : 1515–21. 19. Foretz M, Ancellin N, Andreelli F, et al. Short-term overexpression of a constitutively active form of AMP-activated protein kinase in the liver leads to mild hypoglycemia and fatty liver. Diabetes 2005; 54 : 1331–9. 20. Zhou G, Myers R, Li Y, et al. Role of AMP-activated protein kinase in mechanism of metformin action. J Clin Invest 2001; 108 : 1167–74. 21. Minokoshi Y, Kim YB, Peroni OD, et al. Leptin stimulates fatty-acid oxidation by activating AMP-activated protein kinase. Nature 2002; 415 : 339–43. 22. Yamauchi T, Kamon J, Minokoshi Y, et al. Adiponectin stimulates glucose utilization and fatty-acid oxidation by activating AMP-activated protein kinase. Nat Med 2002; 8 : 1288–95. 23. Tomas E, Tsao TS, Saha AK, et al. Enhanced muscle fat oxidation and glucose transport by ACRP30 globular domain : acetyl-CoA carboxylase inhibition and AMP-activated protein kinase activation. Proc Natl Acad Sci USA 2002; 99 : 16309–13. 24. Iglesias MA, Ye JM, Frangioudakis G, et al. AICAR administration causes an apparent enhancement of muscle and liver insulin action in insulin-resistant high-fat-fed rats. Diabetes 2002; 51 : 2886–94. 25. Zong H, Ren JM, Young LH, et al. AMP kinase is required for mitochondrial biogenesis in skeletal muscle in response to chronic energy deprivation. Proc Natl Acad Sci USA 2002; 99 : 15983–7. 26. Hayashi T, Hirshman MF, Kurth EJ, et al. Evidence for 5’ AMP-activated protein kinase mediation of the effect of muscle contraction on glucose transport. Diabetes 1998; 47 : 1369–73. 27. Russell RR, 3rd, Bergeron R, Shulman GI, Young LH. Translocation of myocardial GLUT-4 and increased glucose uptake through activation of AMPK by AICAR. Am J Physiol 1999; 277 : H643–9. 28. Jorgensen SB, Viollet B, Andreelli F, et al. Knockout of the alpha2 but not alpha1 5’-AMP-activated protein kinase isoform abolishes 5-aminoimidazole-4-carboxamide-1-beta-4-ribofuranosidebut not contraction-induced glucose uptake in skeletal muscle. J Biol Chem 2004; 279 : 1070–9. 29. Marsin AS, Bertrand L, Rider MH, et al. Phosphorylation and activation of heart PFK-2 by AMPK has a role in the stimulation of glycolysis during ischaemia. Curr Biol 2000; 10 : 1247–55. 30. Bergeron R, Previs SF, Cline GW, et al. Effect of 5-aminoimidazole-4-carboxamide-1-beta-D-ribofuranoside infusion on in vivo glucose and lipid metabolism in lean and obese Zucker rats. Diabetes 2001; 50 : 1076–82. 31. Viollet B, Andreelli F, Jorgensen SB, et al. The AMP-activated protein kinase alpha2 catalytic subunit controls whole-body insulin sensitivity. J Clin Invest 2003; 111 : 91–8. 32. Villena JA, Viollet B, Andreelli F, et al. Induced adiposity and adipocyte hypertrophy in mice lacking the AMP-activated protein kinase-alpha2 subunit. Diabetes 2004; 53 : 2242–9. 33. Fryer LG, Parbu-Patel A, Carling D. The anti-diabetic drugs rosiglitazone and metformin stimulate AMP-activated protein kinase through distinct signaling pathways. J Biol Chem 2002; 277 : 25226–32. 34. Minokoshi Y, Alquier T, Furukawa N, et al. AMP-kinase regulates food intake by responding to hormonal and nutrient signals in the hypothalamus. Nature 2004; 428 : 569–74. 35. Andersson U, Filipsson K, Abbott CR, et al. AMP-activated protein kinase plays a role in the control of food intake. J Biol Chem 2004; 279 : 12005–8. 36. Kola B, Hubina E, Tucci SA, et al. Cannabinoids and ghrelin have both central and peripheral metabolic and cardiac effects via AMP-activated protein kinase. J Biol Chem 2005;280 : 25196–201. 37. Kim MS, Park JY, Namkoong C, et al. Anti-obesity effects of alpha-lipoic acid mediated by suppression of hypothalamic AMP-activated protein kinase. Nat Med 2004; 10 : 727–33. 38. Kim EK, Miller I, Aja S, et al. C75, a fatty acid synthase inhibitor, reduces food intake via hypothalamic AMP-activated protein kinase. J Biol Chem 2004; 279 : 19970–6. 39. Namkoong C, Kim MS, Jang PG, et al. Enhanced hypothalamic AMP-activated protein kinase activity contributes to hyperphagia in diabetic rats. Diabetes 2005; 54 : 63–8. 40. Sambandam N, Lopaschuk GD. AMP-activated protein kinase (AMPK) control of fatty acid and glucose metabolism in the ischemic heart. Prog Lipid Res 2003; 42 : 238–56. 41. Xing Y, Musi N, Fujii N, et al. Glucose metabolism and energy homeostasis in mouse hearts overexpressing dominant negative alpha2 subunit of AMP-activated protein kinase. J Biol Chem 2003; 278 : 28372–7. 42. Russell RR 3rd, Li J, Coven DL, et al. AMP-activated protein kinase mediates ischemic glucose uptake and prevents postischemic cardiac dysfunction, apoptosis, and injury. J Clin Invest 2004; 114 : 495–503. 43. Shibata R, Sato K, Pimentel DR, et al. Adiponectin protects against myocardial ischemia-reperfusion injury through AMPK- and COX-2-dependent mechanisms. Nat Med 2005; 11 : 1096–103. |