Dans le régime occidental, les lipides alimentaires représentent près de 40 % des apports caloriques journaliers, alors que les recommandations nutritionnelles sont 10 % plus faibles. Cet apport excessif participe à l’augmentation de la prévalence de l’obésité et des pathologies associées (atteintes vasculaires, diabète de type II, hypertension). Des études déjà anciennes indiquent que les sujets obèses ont une préférence accrue pour les aliments riches en graisses comparativement aux personnes minces [ 1, 2]. Ces travaux suggèrent qu’une perception inappropriée des lipides alimentaires pourrait contribuer à la mise en place d’une surcharge pondérale dans l’espèce humaine.
L’origine de cette préférence pour les corps gras est encore mal connue. Jusqu’à une période récente, on pensait que seules la texture et l’odeur des lipides étaient responsables de leur perception sensorielle. Cette vision restrictive a été battue en brèche par une série d’études comportementales réalisées chez le rat et la souris par l’équipe de Tohru Fushiki de l’Université de Kyoto (Japon). Utilisant le test du double choix, ces chercheurs ont pu établir que ces animaux ont une préférence innée pour les solutions enrichies en lipides par rapport à des solutions qui en sont dépourvues. Le fait que cette attirance spontanée soit indépendante de la texture, de la perception olfactive et des régulations métaboliques post-ingestives [ 3, 4] suggère l’existence d’un système oro-sensoriel dédié à la reconnaissance des lipides alimentaires.
En théorie, la perception orale des lipides requiert la présence d’un ensemble de molécules permettant : (1) une hydrolyse partielle des triglycérides constitutifs des graisses ; (2) la solubilisation des acides gras à longue chaîne (AGLC) ainsi libérés dans la salive ; et (3) leur détection au niveau de cellules neuro-sensorielles des bourgeons du goût. Chez le rat et la souris, l’ensemble de ces conditions semble rempli. En effet, les glandes de von Ebner sécrètent la lipase linguale dont le rôle dans la détection orale des lipides alimentaires est important puisque son inhibition pharmacologique s’accompagne d’une chute de la préférence pour la boisson enrichie en triglycérides dans le test de double choix [ 5]. Localisées à la base des papilles gustatives caliciformes, ces glandes délivrent la lipase à proximité immédiate des bourgeons du goût. Cette disposition anatomique est particulièrement adéquate pour une libération et une détection efficace d’AGLC. Ces glandes produisent également une lipocaline, la VEGP (von Ebner’s gland protein), dont les propriétés de liaison permettent la solubilisation et le transport des AGLC dans la salive. Au niveau des bourgeons du goût, la détection des AGLC requiert la présence d’un récepteur spécifique. La protéine CD36, également appelé fatty acid transporter (FAT), présente les caractéristiques requises pour une telle fonction. En effet, cette protéine membranaire, qui possède une poche extracellulaire pouvant fixer avec une forte affinité jusqu’à 3 AGLC [ 6], a été identifiée au niveau de la papille caliciforme chez le rat [ 7] et chez la souris [ 8].Dans cette dernière espèce, nos travaux montrent que le CD36 a un positionnement idéal pour exercer une fonction de lipidorécepteur, puisqu’il est spécifiquement trouvé au niveau de la partie apicale de certaines cellules neurosensorielles des bourgeons du goût [8].
Afin d’explorer cette hypothèse, des tests de double choix ont été entrepris chez des souris dont le gène codant pour le CD36 a été invalidé [ 9]. Ces animaux ont une attirance pour les solutions sucrées et une aversion pour les solutions amères équivalentes aux souris de type sauvage. En revanche, elles ne sont plus capables de faire la différence entre une solution enrichie en AGLC et une solution aqueuse. Cette absence de discrimination est toujours constatée avec des teneurs extrêmement élevées en AGLC (10 % d’acide linoléique). En l’absence de CD36, le système gustatif semble donc fonctionner normalement sauf pour la détection des AGLC.
Il est connu que la présence de glucides au niveau lingual est suffisante pour déclencher une hyperinsulinémie transitoire. Aussi pouvait-on penser que la détection orale de lipides par le CD36 pouvait également s’accompagner de changements sécrétoires précoces facilitant la digestion des graisses. Pour conforter cette hypothèse, un dépôt oral d’AGLC a été réalisé chez des animaux porteurs d’une ligature œsophagienne (pour éviter toute ingestion) et d’un cathétérisme du canal pancréatobiliaire. Comme escompté, on observe une augmentation du flux pancréatobiliaire et du contenu en protéines du suc pancréatique 5 minutes après le dépôt oral chez les souris de type sauvage. En revanche, ces changements n’existent plus chez les souris dépourvues de CD36, ni chez des rats si l’AGLC est déposé sur le palais où le CD36 est naturellement absent des papilles gustatives [8].
Nos résultats démontrent donc que le CD36 lingual se comporte comme un lipidorécepteur participant à la couverture des besoins énergétiques de l’organisme en sélectionnant et en favorisant l’absorption des nutriments lipidiques (Figure 1). Cette fonction inédite est probablement avantageuse pour l’animal quand la nourriture est rare. En revanche, elle pourrait participer à la mise en place d’une surcharge pondérale en cas de pléthore alimentaire permanente. On ignore actuellement si une fonction similaire existe chez l’homme. L’identification de marqueurs pertinents et non invasifs devrait permettre de répondre à cette question dans un proche avenir.
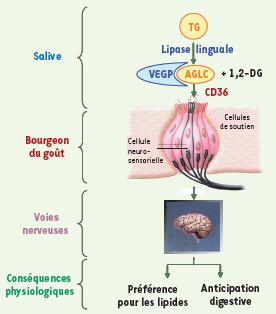
| Figure 1.
Modélisation de la détection oro-sensorielle des lipides alimentaires chez le rat et la souris. L’hydrolyse de triglycérides (TG) par la lipase linguale libère des acides gras à longue chaîne (AGLC) dans la salive, près des bourgeons du goût, où ils peuvent être solubilisés par la VEGP (von Ebner’s gland protein) et/ou captés par le récepteur CD36 situé à la surface de certaines cellules neurosensorielles. L’interaction AGLC/CD36 affecte le comportement alimentaire et les sécrétions digestives. On ignore actuellement la cascade de signalisation mise en route au niveau des bourgeons du goût et les voies nerveuses impliquées. 1,2-DG : 1,2- diglycérides. Le schéma du bourgeon du goût a été reproduit avec l’aimable autorisation du Dr N.A. Abumrad (Washington University St Louis Missouri, USA) |