Nous avons testé l’hypothèse d’un mécanisme général d’interaction entre tabac et β-carotène (aliments et compléments) pour l’ensemble des cancers liés au tabac chez la femme, au sein de la cohorte E3N (Étude épidémiologique de femmes de la Mutuelle Générale de l’Éducation Nationale). Cette cohorte, mise en route en 1990 afin d’étudier les facteurs de risque de cancer chez la femme [
6], est constituée de 98 995 femmes habitant en France, âgées de 40-65 ans en 1990 et adhérentes de la MGEN (Mutuelle Générale de l’Éducation Nationale). Les données sont collectées par auto-questionnaires approximativement tous les 24 mois, depuis 1994 en ce qui concerne la présente étude. Les données alimentaires ont été collectées une fois, entre juin 1993 et juillet 1995, et une table de composition dérivée de la table de référence française du CIQUAL1 permet d’estimer les apports alimentaires quotidiens en β-carotène et autres micro- et macronutriments. Le questionnaire envoyé en 1994 incluait une question sur la supplémentation en différents micronutriments au moins 3 fois par semaine. La consommation globale de β-carotène (aliments et compléments) a été classée ainsi : consommation « uniquement » alimentaire < 3,1 mg (représentant le 1er tertile), entre 3,1 et 4,4 mg (représentant le 2e tertile), supérieure à 4,4 mg (3e tertile), et « consommation avec adjonction » de compléments de β-carotène (4e catégorie, soit consommation élevée). Le statut tabagique a été évalué dans le questionnaire de 1994. Les femmes n’ayant fumé qu’occasionnellement (moins d’une cigarette par jour) ont été considérées comme non fumeuses.
Au total, 59 910 femmes ont été analysées. Parmi celles-ci, 700 ont eu un premier cancer lié directement [
7] ou indirectement (par l’intermédiaire de l’état précancéreux [
8,
9]) au tabac entre leur date de réponse au questionnaire de 1994 et juillet 2002 (date de fin de cette étude), se décomposant en : 25 cancers ORL, 5 cancers de l’œsophage, 11 cancers de l’estomac, 7 cancers du foie, 28 cancers du pancréas, 224 cancers colorectaux, 8 cancers de l’anus, 38 cancers urovésicaux, 57 cancers du poumon, 58 cancers du col utérin, 143 cancers de la thyroïde et 96 cancers de l’ovaire. Les 2 342 sujets ayant eu un cancer d’une autre localisation (exceptés les cancers cutanés basocellulaires) ont été inclus comme non-cas dans les analyses et censurés à la date de diagnostic.
Nous avons calculé les risques relatifs (RR) et leurs intervalles de confiance à 95 % (95 % IC) de cancer en utilisant le modèle de Cox, avec l’âge en continu comme échelle de temps. Des analyses stratifiées sur le statut tabagique (ayant déjà fumé/n’ayant jamais fumé) ont été réalisées pour évaluer le risque de cancers associé à l’apport en β-carotène. Les analyses multivariées étaient ajustées sur l’apport énergétique total sans alcool, l’indice de masse corporelle, l’alcool, et l’activité physique de loisirs. Chez les fumeuses, nous avons également ajusté sur le nombre de cigarettes par jour, le nombre d’années de tabagisme, et le nombre d’années depuis l’arrêt du tabac.
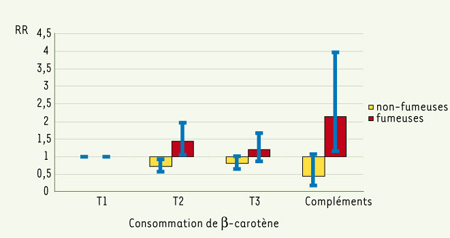
Nous avons observé une interaction statistiquement significative entre le statut tabagique et l’apport en β-carotène (p = 0,017). Les résultats des modèles stratifiés sur le statut tabagique sont présentés dans la Figure 1. Chez les femmes n’ayant jamais fumé, le risque de cancer diminuait avec l’apport croissant en β-carotène. Les risques relatifs multivariés étaient respectivement de 0,72 (0,57 - 0,92), 0,80 (0,64 - 1,01), et 0,44 (0,18 - 1,07) pour les 2e et 3e tertiles alimentaires et pour la catégorie de consommation élevée de β-carotène, comparés au 1er tertile d’apport alimentaire, p tendance = 0,03. À l’inverse, chez les femmes ayant déjà fumé, la consommation de β-carotène augmentait le risque de cancer, les risques relatifs correspondants étant de 1,43 (1,05 - 1,96), 1,20 (0,86 - 1,67) et 2,14 (1,16 - 3,97), p tendance = 0,09. Nous n’avons pas mis en évidence d’hétérogénéité significative entre les fumeuses et les ex-fumeuses. Le risque absolu de cancer sur 10 ans pour 10000 femmes non fumeuses était de 181,8 cas pour un apport faible de β-carotène et 81,7 cas pour un apport élevé ; pour 10000 femmes fumeuses, il était de 174,0 cas pour un apport faible de β-carotène et 368,3 cas pour un apport élevé. Cet effet opposé du β-carotène chez les fumeuses et les non-fumeuses était spécifique des cancers liés au tabac, il n’était pas retrouvé pour les cancers non liés au tabac (sein et autres).
 | Figure 1.
β-carotène et risque de cancer selon le statut tabagique. P tendance = 0,03 pour les non-fumeuses et 0,09 pour les fumeuses. T : tertile ; RR : risque relatif. |
Nos résultats suggèrent que le β-carotène est inversement associé au risque de certains cancers chez les femmes n’ayant jamais fumé régulièrement au cours de leur vie, vraisemblablement en raison de son effet anti-oxydant. Chez ces femmes, la consommation de β-carotène devrait donc être encouragée, en particulier sous forme de fruits et légumes riches en β-carotène comme les carottes et les épinards, qui pourraient également apporter d’autres anti-oxydants. En revanche, chez les femmes ayant déjà fumé régulièrement, il paraît important de décourager la supplémentation en β-carotène. Nos résultats sont cohérents avec certaines données épidémiologiques [1–5,
10] et expérimentales chez l’animal ou sur des lignées cellulaires [
11–
13]. Ils doivent encourager des travaux à plus large échelle afin de mieux comprendre pour chaque site de cancer lié au tabac l’effet cocarcinogène éventuel du β-carotène [
14].